高分辨磁共振血管壁成像在颅内动脉夹层中的研究进展
2020-10-12柏夏薇吴昆华孟迪
柏夏薇 吴昆华 * 孟迪
颅内动脉夹层 (intracranial arterial dissection,IAD)又称颅内动脉剥离,指各种原因引起血管壁撕裂分层,裂口受到强有力的血液冲击,循环血液通过裂口进入其间隙,导致血管壁间剥离形成血肿[1-2]。IAD在东亚人群中发病率较高[3],是引起青中年人缺血性脑卒中和蛛网膜下腔出血的重要病因[4],以IAD为主要病因的卒中病人占所有病人的20%[5]。IAD有较高的致残率及病死率,早期明确诊断至关重要[2]。迄今国内外对IAD均未有统一的影像诊断及分型标准。目前诊断颅内血管病变的影像技术主要包括数字减影血管造影(DSA)、CT血管成像(CTA)、磁共振血管成像(MRA)等,但这些技术虽可直接显示血流情况,但只能间接反映血管腔及血管壁改变,对血管壁结构显示不清,对IAD的病因诊断存在不足。多项研究[6-7]表明,高分辨磁共振血管壁成像(high-resolution magnetic resonance vessel wall imaging,HRMR-VWI)技术可以清晰显示颅内动脉管壁,对IAD的影像特征显示更加直观。本文通过文献回顾,主要介绍HRMR-VWI在对IAD研究中的状况和相关进展。
1 HRMR-VWI
颅内动脉的直径小且走行迂曲,远端小动脉直径甚至可<1 mm,故需要较高的空间分辨率,以清晰显示毫米级别的微小病变[6]。HRMR-VWI以黑血成像序列为基础,通过施加预饱和脉冲抑制管腔内血流信号,使管腔中低信号的血液与等信号血管壁形成明显对比,从而能清晰描绘血管壁的形态学特征。MRI三维黑血序列不仅可以采用多平面重组(MPR)清晰显示远端走行迂曲的小动脉,其具有的高分辨率还可以显示<1 mm的微小病变(0.2~0.9 mm)[7]。此外,颅内动脉Willis环周围脑脊液对管腔外壁显示有所影响,在某些情况下也需要抑制颅内动脉周围的脑脊液信号[6]。同时抑制血液和脑脊液,可使动脉内外血管壁均可显示。
目前,临床上的血管壁成像技术多以黑血序列为基础,采用二维和三维成像技术。二维成像技术多采用快速自旋回波(FSE)序列获得与血管管腔垂直的薄层短轴影像。三维成像技术则多采用可变反转角度的FSE序列,与二维成像技术相比,三维成像扫描范围更广泛,可从多方位重建图像,临床应用价值更广泛。其中,3D可变聚焦翻转角(variable refocusing flip angle sequences,VRFA)序列,由于其黑血的效果、快速的成像速度及高质量的信噪比,近年来被广泛应用于各种动脉成像。
总体而言,不同公司所使用的技术在原理上并无差异,但在技术参数的应用上略有不同,命名也各不相同,如西门子公司命名的可变翻转角快速自旋回波(sampling perfection with application optimized contrast using different flip angle evolution,SPACE)序列,GE公司则称其为3D快速自旋回波CUBE(3D fast spin echo-cube)序列,而飞利浦公司称作容积采集各向同性快速自旋回波(volume isotropic turbo spin echo acquisition,VISTA)序列[6]。
2 HRMR-VWI在IAD病变中的应用
2.1 IAD病变概述 IAD病变常见于颈内动脉床突上段、大脑中动脉M1段、基底动脉及椎动脉颅内段[8]。IAD病变的临床症状常表现为枕部头痛或颈部疼痛,如果不进行治疗可能会导致严重的神经功能损害。形成夹层的病因包括自发性、医源性和创伤性损伤。IAD病变的病理学研究提示,该病的形成是一个动态的病理过程,血管内壁撕裂后,血液在动脉压的作用下进入内膜和中膜或外膜和中膜之间形成壁内血肿,内膜破裂会形成真假腔和内膜瓣[8-9]。当夹层累及内膜和中膜时,会造成动脉管腔狭窄或闭塞,常引起缺血性脑卒中;若累及外膜下时,动脉壁向外膨出,形成瘤样扩张,破裂后常引起蛛网膜下腔出血[2]。缺血性脑卒中的IAD病人死亡率为0~17%,而蛛网膜下腔出血的IAD病人的死亡率则高达31%~50%,且容易引起再次出血[5]。
2.2 IAD病变的典型影像征象 IAD病变的典型影像征象主要有:①内膜瓣;②双腔征;③壁内血肿;④动脉管腔改变。动脉夹层在HRMR-VWI上的典型征象表现见图1。其中,内膜瓣和双腔征是IAD的直接征象,而壁内血肿是IAD的典型征象[1]。影像学上发现内膜瓣或双腔征可作为IAD病变的诊断依据。多项研究[7,10]显示,HRMRI对 IAD 病变中的直接征象(内膜瓣、真假腔)有较高的检出率,可以评估传统成像方法无法确诊的疑似IAD病变的病人。IAD影像特征如图2所示。
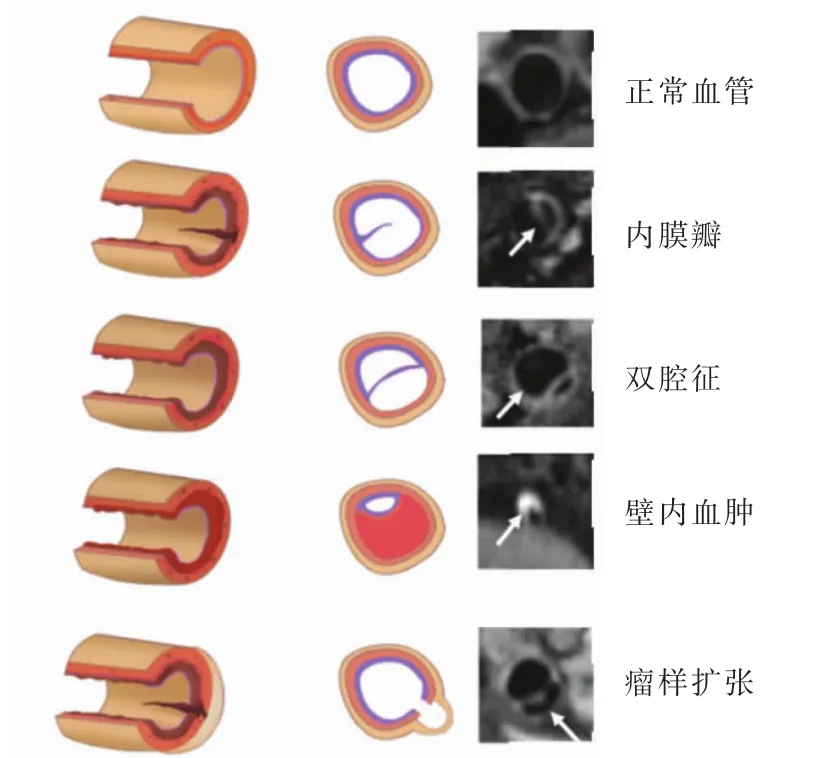
图1 动脉夹层在HRMR-VWI上的典型征象
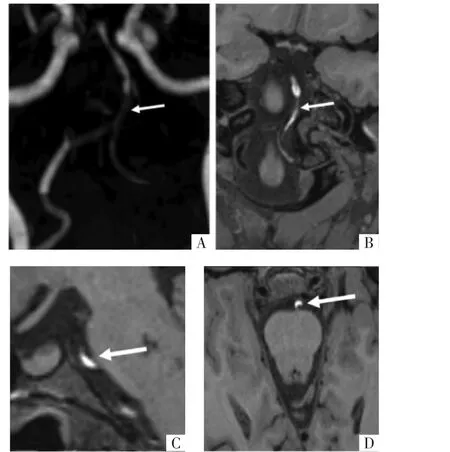
图2 IAD病人,男,43岁。A图为MIP影像,示左侧椎动脉及基底动脉重度狭窄。B、C图为冠状面及矢状面HRMRI T1WI,左侧椎动脉颅内段及基底动脉见新月形壁内血肿影。D图为横断面HRMRI T1WI,基底动脉见双腔征及高信号壁内血肿。
内膜瓣在T1WI黑血序列上呈等或高信号的瓣状结构影,常位于血管腔内,但内膜瓣厚薄及血流伪影均会影响内膜瓣成像,因此进一步优化HRMRI序列的空间分辨率可提高内膜瓣的检出率。Han等[10]在研究中发现增强T1WI上有91.4%病例可以检测到内膜瓣影,T2WI的检出率为68.6%。Uemura等[11]对内膜瓣的研究中应用了优化的非增强高分辨FSE序列,使用了较长的TR(6 000 s),从而增加了T2对比,使该序列对小病变的分辨力增强,与传统成像方法(MRI、CTA、DSA)对比,在高分辨 FSE 序列上可以清楚显示3例病人的内膜瓣和双腔征,而这3例病人在传统影像检查模式中仅有2例发现了双腔征。Woo等[12]的研究显示三维质子密度加权成像 (3D-proton-density weighted image,3D-PD)序列对内膜瓣的检出率为88.2%,高于三维改良运动敏感驱动平衡预脉冲时间(3D-improved motion-sensitized driven equilibrium-preparation,3D-iMSDE-T1)序列增强前后的检出率(29.4%和35.3%)。
双腔征是诊断IAD的关键征象,通常呈现为真假腔[13]。真腔一般较小,呈类圆形;而假腔则较宽,有时假腔扩张会压迫真腔,致真腔变窄或闭塞[14]。由于血流速度和血流形式不同,真假腔内血液信号各不相同。真腔血流速度较高,有流空效应,在黑血序列常呈低信号,亮血序列上呈高信号;假腔血流速度较慢,容易形成血液湍流与停滞,腔内常形成血肿或血栓,信号常表现为不均匀,黑血序列上多呈高信号,亮血序列信号较真腔低[15]。然而,并不是所有病人都有明显的内膜瓣及双腔征。有研究[16]显示16例IAD病人的影像征象根据出现频率依次为壁内血肿、管腔狭窄、瘤样扩张和内膜瓣,提示壁内血肿及管腔改变更常见。Han等[10]也提出了相同的观点。
壁内血肿是指假腔内血液凝结或积累的状态[17],于T1WI上通常表现为受累动脉壁增厚,增厚的管壁边缘可见新月形结构的异常信号影,且真腔受压移位。壁内血肿在不同时期会表现为不同信号特征,急性期(<3 d)血肿内含反磁性的氧合血红蛋白,表现为T1WI上呈等或低信号、T2WI上呈等或低信号;亚急性期(3 d~2个月)血肿含顺磁性的正铁血红蛋白,表现为T1WI上呈高信号、T2WI上呈高信号;慢性期(>2个月)血肿主要由含铁血黄素构成,表现为T1WI上呈等或低信号、T2WI上呈低信号。Han等[10]在对位于椎-基底动脉的IAD病变研究中发现,壁内血肿在T1WI和增强T1WI上最容易检出。Heldner等[18]对IAD病变病人的壁内血肿的动态变化进行研究,发现大部分病人在2周内血肿体积增加,在随后3个月的随访中,80%的病人中不再检测到壁内血肿,6个月后所有病人均没有检出壁内血肿。
瘤样扩张是夹层动脉瘤最常见的征象之一,指扩张血管外径为正常血管的1.5倍[19]。有研究者[7]在对IAD病变的定量分析中发现瘤样扩张在前后循环中存在显著差异,后循环中瘤样扩张程度高于前循环,且后循环中瘤样扩张更常见,推测可能与前后循环的不同撕裂机制有关,前循环趋向于内膜下撕裂,而后循环趋向于外膜下撕裂。多项研究[7,20]发现,IAD病变的受累血管在增强HRMRI中可见管壁强化,提示夹层的发生可能与血管炎有关。
2.3 鉴别诊断与漏误诊原因分析 IAD病变通常需要与动脉粥样硬化斑块及原发性血管炎相鉴别。动脉粥样硬化斑块内出血可在T1WI上表现为高信号,夹层中壁内血肿也可表现为T1WI高信号,但IAD的壁内血肿范围较斑块内出血范围广,且由于其真腔较小,壁内血肿面积常常更大,血管外径常可见扩张;而斑块内出血累及范围较小,其内除高信号的出血影外,还能看到脂质等其他斑块成分,且管腔扩张不明显,需要对管径进行测量计算其壁厚指数[22]。IAD病变多可引起血管壁强化[20],呈血管炎样改变,其强化程度多高于原发性血管炎,且多呈同心圆样强化[23-24];而原发性血管炎的强化更为均匀,可表现为向心样[24]。
León等[25]对101例缺血性脑卒中的病人进行分析,发现最常见的误诊病因是动脉夹层(65.2%)。当血管走行迂曲或先天发育不良时,血管内常形成血液湍流或滞留,黑血成像序列对血流信号抑制效果不佳,所产生的血流伪影会被误认为是内膜瓣,造成对IAD的误诊[21]。IAD中内膜瓣征象在多方位均显示清晰,且增强扫描可见强化;而血流伪影常仅在一个方位显示,且增强扫描无强化。此外,当IAD形成动脉瘤样扩张时,扩张的假腔压迫真腔,导致血管管腔完全闭塞,无法显示双腔征及内膜瓣影,导致对夹层的漏诊。脑脊液与亚急性期壁内血肿在T2WI上均可呈高信号,两者在T2WI上有时无法鉴别,易造成对夹层的误诊、漏诊。需结合T1WI的信号特点来鉴别两者,脑脊液在T1WI上呈低信号,亚急性期壁内血肿呈高信号。
对于可疑IAD的病人可以使用3D黑血成像技术,多方位重建观察病变血管管腔及管壁,确保病变可以在每个方位均清晰显示,结合多个序列观察各组织信号特点可减少漏误诊率,提高诊断率。Cho等[26]报道了2例由3D HRMR-VWI发现的小脑后下动脉夹层,经重建后病变管腔的内膜瓣清晰显示,提示多方位重建有助于减少远端小动脉夹层的漏诊与误诊。Choi等[27]对102例病人进行3D-iMSDE-T1扫描,重建横断面、冠状面和矢状面,将基于2DHRMRI的诊断与3D-iMSDE-T1诊断进行比较,发现3D-iMSDE-T1对IAD的诊断效能高于2DHRMRI。
2.4 临床意义 IAD的病理征象与临床表现及预后密切相关,而HRMR-VWI可以无创地发现血管壁内的微小变化,对IAD征象的检出率高于传统的血管成像技术[11,19],有助于提高该病诊断的准确率。
此外,HRMR-VWI有助于了解夹层的分期及转归。Heldner等[18]应用HRMRI对壁内血肿的动态变化进行监测,发现不同时期的血肿信号不同,提示其有助于对夹层病变进行临床分期。Saito等[28]通过HRMR-VWI对夹层管壁强化程度的定量分析,发现夹层管壁强化程度同样有助于夹层的分期。Park等[29]对未破裂的椎动脉夹层进行定量分析,发现从急性期阶段到慢性期阶段,病人的内膜瓣、双腔、瘤样扩张(最大外径、最大壁厚、壁厚指数和重塑指数)、壁内血肿信号强度和血管壁增强情况均有所改善。另一项研究[30]对312例缺血性脑卒中病人随访发现,单纯夹层病人的脑血管病复发率低于动脉粥样硬化病人,且单纯夹层病人血管狭窄改善比动脉粥样硬化病人更常见。
总之,HRMR-VWI不仅提高了IAD病变的检出率,对于已经确诊的病人,可以通过HRMR-VWI随访及动态观察颅内动脉夹层管壁、管腔变化规律,有助于全面了解疾病的病理生理及转归,为寻找病因、临床分期、个体化治疗及评价预后提供依据。
3 总结与展望
IAD病变是引起青中年人缺血性脑卒中和蛛网膜下腔出血的重要病因,需要临床尽早做出明确诊断。HRMR-VWI不仅能够在活体中无创性直接显示血管壁病变,也可通过随访及动态观察已确诊的病人的管壁病变转归,这在常规成像中是无法检测到的。在未来的研究工作中,还可以结合影像组学和人工智能等新技术,进一步深入研究IAD病变的特征性,结合临床特点及影像特征,提高诊断敏感度,更好地制定个体化治疗方案及评价预后,提高治疗效果。
