RESOLVE及其ADC值与宫颈癌临床分期、病理分化的相关性研究
2020-10-12赖炳佳黎继昕颜卓恒钟镜联
赖炳佳 黎继昕 颜卓恒 钟镜联
宫颈癌是我国女性最常见的恶性肿瘤之一[1]。
宫颈癌的精确病理分级与分期有助于制定合理、个体化的治疗方案,甚至预测病人的术后康复情况及淋巴结转移等情况。读出方向分段采样平面回波成像(readout segmentation of long variable echo-trains,RESOLVE)是一种较新的扩散加权成像 (DWI)技术,采用分段读出的独特K空间填充方式,具有影像变形小、分辨力高、解剖细节清晰等特点[2]。目前关于表观扩散系数(ADC)与宫颈癌临床分期相关性研究的报道较少,本文应用高分辨扩散RESOLVE-DWI序列生成ADC值,分析不同分期及不同分型宫颈癌的ADC值的差异及其相关性,旨在探讨高分辨扩散RESOLVE-DWI序列在宫颈癌中的应用价值。
1 资料与方法
1.1 研究对象 回顾性分析中山大学孙逸仙纪念医院2017年11月—2019年4月行RESOLVE序列及盆腔常规平扫加增强检查的宫颈癌病人86例,年龄 22~75 岁,平均(50.2±10.4)岁。 纳入标准:①MRI影像清晰无伪影;②术后病理证实为宫颈癌;③临床资料完善。排除标准:①病灶过小,无法勾画兴趣区(ROI);②有盆腔金属植入物,运动伪影明显;③高热病人;④曾接受过放化疗治疗。86例病人中包括腺癌11例,鳞癌72例 (低分化鳞癌29例、中-低分化鳞癌8例、中分化鳞癌35例),腺鳞癌3例。根据国际妇产科联盟(FIGO)分期标准(Ⅰ、Ⅱ、Ⅲ、Ⅳ期)[3]及不同分期的放化疗存活率[4]将病人分为3组:组1为ⅠA-ⅠB1期(31例),组2为ⅠB2-Ⅱ期(41例),组 3为Ⅲ-Ⅳ期(14例)。
1.2 设备与方法 采用Siemens Skyra 3.0 T MRI设备,选择8通道体部相控阵线圈。受试者仰卧,头先进,扫描范围自子宫顶部至阴道口。RESOLVE序列采集横断面影像,扫描参数:扫描时间约3 min 31 s,扫描基线垂直于病灶长轴,扫描参数为:TR 4 370 ms,TE 63 ms,体素 1.4 mm×1.4 mm ×4 mm,FOV 200 mm×200 mm,矩阵 144×144,层厚 4 mm,层间距 0.8 mm,b值取0、800 s/mm2。在Siemens Syngo后处理工作站中自动生成ADC图。
1.3 影像分析 由2名高年资影像诊断医师在不知晓病理结果的情况下分别进行阅片并确定病灶最大层面和范围。选取宫颈癌病灶实性成分最大的层面,在T2WI上手动勾画 ROI,随后在RESOLVE序列生成的ADC图上复制勾画相同ROI。ROI选取原则:①根据宫颈癌肿瘤形态确定ROI的形态;②ROI的大小应围绕病灶1周且大于总面积的2/3;③避开囊变坏死区。ROI显示的数值即为ADC值,2名医师分别勾画3次ROI并测量ADC值求平均值。
1.4 统计学方法 应用SPSS 19.0软件进行统计分析。符合正态分布的计量资料以均数±标准差()表示。2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,方差不齐时使用 Tamhane’s T2检验,P<0.05表示差异有统计学意义。采用组内相关系数(intraclass correlation coefficient,ICC)判断2名医师测量ADC值的一致性。采用Spearman相关分析宫颈癌ADC值与临床分期及病理分化程度之间的相关性,rs<0.3为弱相关。
2 结果
2.1 2名医师的一致性分析 2名医师测得的ADC 值较为一致(ICC 为 0.957,P<0.001)。
2.2 3组宫颈癌的ADC值比较 组1、2、3的ADC值 分 别 为 (1.05±0.36)×10-3、(0.91±0.13)×10-3、(1.00±0.25)×10-3mm2/s,差异有统计学意义(F=3.03,P<0.05)。其中,组 1 的 ADC 值高于组 2(P<0.05),其他组间差异均无统计学意义(均P>0.05)(图1)。
2.3 不同分型及不同分化程度的宫颈癌ADC值比较 腺癌与鳞癌的ADC值差异无统计学意义[分别为(1.10±0.35)×10-3mm2/s和(0.92±0.16)×10-3mm2/s),t=1.73,P=0.09]。 低分化、中-低分化、中分化鳞癌ADC 值分别为(0.92±0.16)×10-3、(0.96±0.13)×10-3和(0.99±0.29)×10-3mm2/s,腺癌与不同分化的鳞癌间差异无统计学意义(F=1.40,P=0.25)。腺鳞癌仅3例,未比较。
2.4 病理分期及分化程度与ADC值的相关性分析 ADC值与宫颈癌病理分期无相关性(rs=0.146,P=0.179),与鳞癌的分化程度(低分化、中-低分化、中分化)也无相关性(rs=0.089,P=0.455)。
3 讨论
宫颈癌治疗方案的选择和预后情况不仅与组织学类型及分化程度有关,也与肿瘤的临床病理分期(包括肿瘤大小、侵犯范围、淋巴结转移情况等)密切相关[5]。其中,DWI能够通过定量测量ADC值来评价宫颈癌肿瘤实性部分情况,扩散受限程度越高,ADC值越低。因此,DWI在诊断宫颈癌、临床病理分期、预测预后情况、评价治疗疗效及复发等情况具有很大的临床价值[6-9]。本研究采用的RESOLVE序列属于分段读出平面回波成像(readout-segmented EPI,RS-EPI),这种分段读出 RS-EPI序列具有变形小、分辨力高等优点,对生成的ADC值影响小,从而减少ADC值测量误差带来的对宫颈癌临床分期及病理类型、分化程度的评估造成影响[10-11]。因此,本研究采用RESOLVE序列生成ADC值来探究其与宫颈癌分期及病理类型分化程度之间的关系,2名医师的一致性检验ICC系数为0.957,说明利用RESOLVE生成的ADC值测量可重复性较高。
有研究[12]指出早期宫颈癌的平均ADC值低于晚期,而本研究对临床分期更细化,按照FIGO分期分为4期。有研究[4]表明ⅠB1期与ⅠB2期宫颈癌的放化疗治疗存活率存在差异,因此本研究尝试将ⅠB1与ⅠB2期分开,结果发现组 1(Ⅰ-ⅠB1期)与组2(ⅠB2-Ⅱ期)间的ADC值差异存在统计学意义,但ADC值与宫颈癌分期无相关性,可能由于宫颈癌的临床病理分期主要是根据肿瘤大小、侵犯范围及淋巴结转移情况来划分的,与宫颈癌的病理类型和分化程度无一定的相关性,而ADC值的决定因素与肿瘤组织细胞密度、病理类型及分化程度等有关。
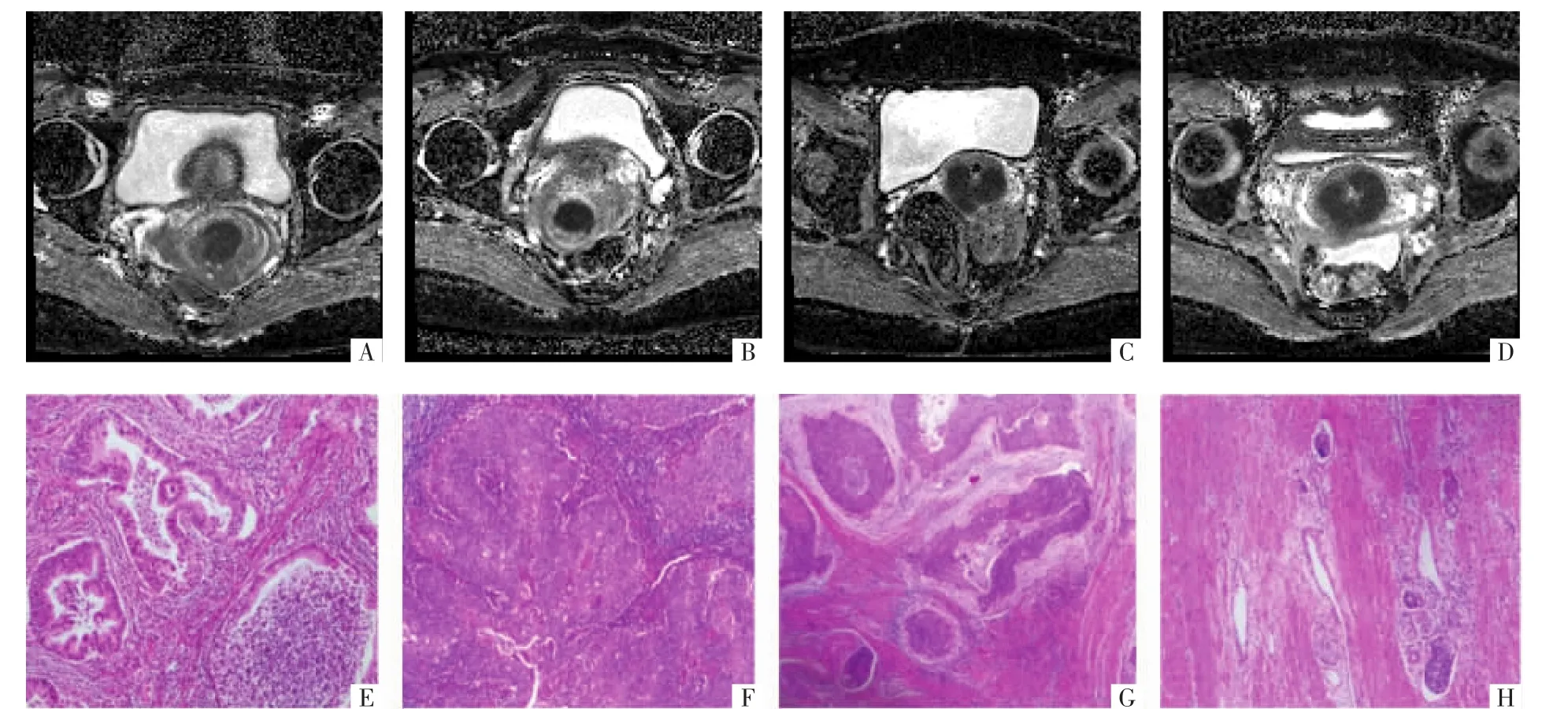
图2 采用RESOLVE序列获得的不同分化程度宫颈癌相应的ADC图(A-D)与术后病理图(HE,×100)(E-H)。A、E图为腺癌,ADC 值为 1.110×10-3mm2/s;B、F 图为低分化鳞癌,ADC 值为 0.702×10-3mm2/s;C、G 图为中-低分化鳞癌,ADC 值为0.933×10-3mm2/s;D、H 图为中分化鳞癌,ADC 值为 0.956×10-3mm2/s。

图1 不同T分期宫颈癌病人的ADC图。A-D图分别为ⅠB1、ⅠB2、Ⅱ、Ⅲ期病人的ADC图,ADC值分别为1.039×10-3、0.970×10-3、0.815×10-3、1.167×10-3mm2/s。
肿瘤实质部分的ADC值与细胞密度具有明显相关性。鳞癌组织结构致密,癌细胞紧密排列,水分子难以扩散,因此ADC值较低;分化程度越差的鳞癌越致密,细胞组织间联系更少,其ADC值表现更低。而腺癌结构松散,分泌液体,水分子容易扩散,因此腺癌ADC值较高。有研究[13]表明,鳞癌的ADC值低于腺癌,ADC值和肿瘤的病理分级呈负相关。本研究结果与该结论不符,这可能是因为本研究腺癌例数太少,无法发现其与鳞癌之间的ADC值差异。
有文献[14-15]报道,术后辅助化疗可改善低分化宫颈鳞癌的预后,将低分化鳞癌区分出来有一定的临床意义,因此本研究将鳞癌按分化程度再细分,并与腺癌的ADC值进行了比较。Winfield等[16]发现分化差的宫颈肿瘤表现出比良好/中度分化的肿瘤更低的扩散系数,但本研究中鳞癌各分级间并未发现统计学差异,这可能是因为本次测量的ADC值为平均值,而平均ADC值不能完全代表整个肿瘤的分级情况,因而在一定程度上弱化了不同类型及不同分化程度的宫颈癌之间的差异。
本研究存在一定的局限性。由于样本量不足,因此仅分析了由RESOLVE生成的ADC值与宫颈癌病理类型分级与临床分期的部分关系,下一步可继续扩大样本量进一步研究。另外,本研究选取的ADC平均值仅能反映肿瘤实性部分的平均信号,未能反映肿瘤的全部扩散情况,今后尝试采用ADC直方图等来反映肿瘤的扩散情况。
总之,利用RESOLVE技术生成的ADC值能部分反映宫颈癌的病理类型分级与临床分期情况,具有一定的临床价值。
