雷贝拉唑钠肠溶微丸研究
2020-10-12钟雪彬
钟雪彬,柏 峰,黄 洋,李 纬
(南京长澳医药科技有限公司,江苏 南京 210038)
雷贝拉唑(Rabeprazole sodium)为苯并咪唑类化合物,是继奥美拉唑、兰索拉唑、泮托拉唑后第四个上市的新一代质子泵抑制剂,本品是由日本卫材公司开发,于1997年首先在日本上市,1999年在美国上市,商品名:Pariet®,剂型为肠溶片[1-2]。2007年波利特肠溶片进入中国。
雷贝拉唑钠在胃酸中极其不稳定,目前其口服制剂多开发为肠溶片或者肠溶胶囊,但是该类剂型不适合吞咽有困难的特定病人群体,因此,本研究拟将雷贝拉唑钠开发为口崩片,极大的提高服用顺应性,同时以市售的雷贝拉唑钠肠溶片作为参比制剂,进行体外溶出曲线和体内生物等效性研究。
本研究拟先制备雷贝拉唑钠肠溶微丸,然后通过压片的方法制备雷贝拉唑钠口腔崩解片,因口腔崩解片要求在口腔内能够迅速崩解、无沙砾感、口感良好、容易吞咽,对口腔黏膜无刺激性[3]。因此,关键中间体肠溶微丸相较于普通的肠溶胶囊中的微丸粒径要求更细小,同时需要更有韧性才能经受压片过程而不被破坏。
1 仪器与试药
1.1 仪器
Mini Glatt5流化床(德国Glatt公司);BT100-2J 蠕动泵驱动器(保定兰格恒流泵有限公司);TD20002C电子天平(天津天马衡基仪器有限公司);AL204电子天平(梅特勒-托利多仪器有限公司);Agilent780+850DS自动溶出仪(安捷伦);U3000高效液相色谱仪(戴安);Milli-Q纯水仪(密理博);S220 pH计(梅特勒-托利多仪器有限公司);UV-2700紫外可见光光度计(岛津公司)。
1.2 药品与试剂
雷贝拉唑钠(常州康丽制药有限公司);雷贝拉唑钠肠溶片(日本卫材公司);苏丽芯TM250/355(上海卡乐康包衣技术有限公司);羟丙甲纤维素E3LV(陶氏化学公司);滑石粉(广西龙胜华美滑石开发有限公司);柠檬酸三乙酯(上海冒为医药辅料技术有限公司);二氧化钛(江苏宏远药业有限公司);甲基丙烯酸-丙烯酸乙酯共聚物水分散体L 30D-55(Evonik Rohm GmbH公司);氢氧化钠(湖南尔康制药有限公司);氧化镁(湖南新绿方药业有限公司);聚乙二醇6000(山东瑞升药用辅料有限公司);磷酸氢二钾(分析纯),氢氧化钾(分析纯),磷酸(色谱纯),甲醇(色谱纯),乙腈(色谱纯)。
2 方法与结果
2.1 测定方法
2.1.1 有关物质和含量测定方法
供试品溶液配制:精确称取适量肠溶微丸(约含雷贝拉唑钠10mg),加入100 mL棕色容量瓶中,加入0.01 mol/L氢氧化钠60 mL超声溶解,完全溶解用乙腈定容至刻度线,摇匀即得供试品溶液。
对照品溶液配制:取雷贝拉唑钠对照品10mg于100 mL棕色容量瓶中,加0.01 mol/L氢氧化钠60 mL超声溶解完全后用乙腈定容至刻度线,摇匀即得对照品溶液。
空白辅料溶液配制:按处方配比取空白辅料适量(相当于雷贝拉唑钠10mg)置于100 mL棕色容量瓶中,加0.01 mol/L氢氧化钠60 mL超声溶解完全溶解用乙腈定容至刻度线,摇匀即得空白辅料溶液。
有关物质、含量按以下色谱方法进行测定。参照《中国药典》2015版雷贝拉唑钠肠溶胶囊及肠溶片的有关物质标准,单个杂质峰面积不得大于对照溶液主峰面积1.0%,各杂质峰面积之和不得大于对照溶液主峰面积的2.0%。有关物质测定色谱条件采用梯度洗脱,洗脱方法见下表。

表1 有关物质、含量色谱条件

表2 有关物质液相洗脱梯度
2.1.2 耐酸力的测定[4]
耐酸力的测定按照《中国药典》2015版XC第二法,以0.1mol/L盐酸溶液500 ml 为溶出介质,转速为100 r/min,2 h后,弃去溶出介质,用水冲洗溶出杯内颗粒,照2.1.1中含量的测定方法测定取出的微丸含量,每个颗粒中雷贝拉唑钠含量应不低于标示量的90%。
2.1.3 溶出度测定[5]
pH值为1.0盐酸溶液:取自制微丸及市售原研片(批号:1706085),照释放度测定法(中国药典2015年版四部通则0931第一法方法1),采用溶出度测定法(中国药典2015年版二部通则0931第一法)的装置,以pH值为1.2盐酸、pH值为6.0磷酸盐缓冲液、pH值为6.8磷酸盐缓冲液溶液900mL为释放介质,转速为 50r/min,依法操作,分别于5,10,15,30,45,60,90、120min时,取溶液5mL,滤过,作为供试品溶液;另取雷贝拉唑钠对照品适量,用相应溶出介质配制0.01mg/mL的对照品溶液。照紫外-可见分光光度法(中国药典2015版四部通则0401)测定吸光度,pH值为1.2盐酸溶液在299nm测定;pH值为6.0磷酸盐缓冲液在295nm测定;pH值为6.8磷酸盐缓冲液在285nm测定。每批样品各测定6份。计算每份样品各时间点的释放量,绘制释放曲线。
2.2 处方筛选与优化
雷贝拉唑钠微丸设计为三层包衣,采用微丸(250~350μm)为内核,第一层包衣为含药层,第二层包衣为隔离层,第三层包衣为肠溶层,并且优化了各层的处方。以下处方筛选均以100g微丸为例。
2.2.1 含药层包衣
按照表3称取处方量羟丙甲纤维素慢慢分散至搅拌状态下的纯化水中,溶胀完全后,加入氧化镁和滑石粉,搅拌均匀后,加入雷贝拉唑钠使其溶解完全,过200目筛,按照表4中包衣参数进行包衣。

表3 含药层包衣处方

表4 含药层包衣工艺
含药层包衣过程,考察了不同粘合剂用量对上药率的影响,上药率通过包衣结束后检测药物含量计算得到。结果表明:随着HPMC浓度的提高,上药率逐步增加,当HPMC浓度为4.5g时在包衣过程中粘丸现象严重,故包衣处方选择粘合剂用量为3.0gHPMC,详细结果见表5。

表5 粘合剂用量对上药率的影响
2.2.2 隔离层包衣
按照表6取处方量羟丙甲纤维素慢慢分散至搅拌状态下的纯化水中,溶胀完全后,加入柠檬酸三乙酯、聚乙二醇6000和滑石粉,搅拌均匀后,过200目筛,按照表7中工艺参数进行包衣。

表6 隔离层包衣处方

表7 隔离层包衣工艺
隔离层主要起到增加稳定性的作用,因此,本研究考查了不同增重对雷贝拉唑钠肠溶微丸的稳定性[6],将隔离层微丸放置在60℃,RH75%条件下放置5天后进行观察并取样检测有关物质。结果表明:隔离层中羟丙甲基纤维素用量在12g以上有利于微丸的稳定,最终选择12g,此处方隔离层增重约为15%,详细结果见表8。
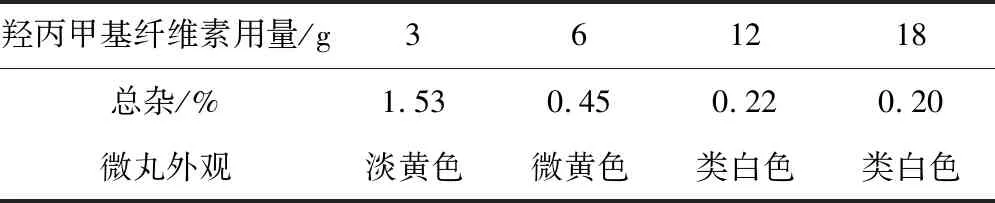
表8 隔离层对含药层的保护
2.2.3 肠溶层包衣
按照表9取处方量甲基丙烯酸-丙烯酸乙酯共聚物水分散体,在搅拌状态下慢慢加入氢氧化钠溶液,柠檬酸三乙酯,搅拌均匀,过300目筛;称取处方量的水,搅拌状态下,加入处方量滑石粉,二氧化钛,搅拌混合均匀后,过200目筛,备用;上述两溶液混合均匀,按照表10中工艺参数进行包衣。
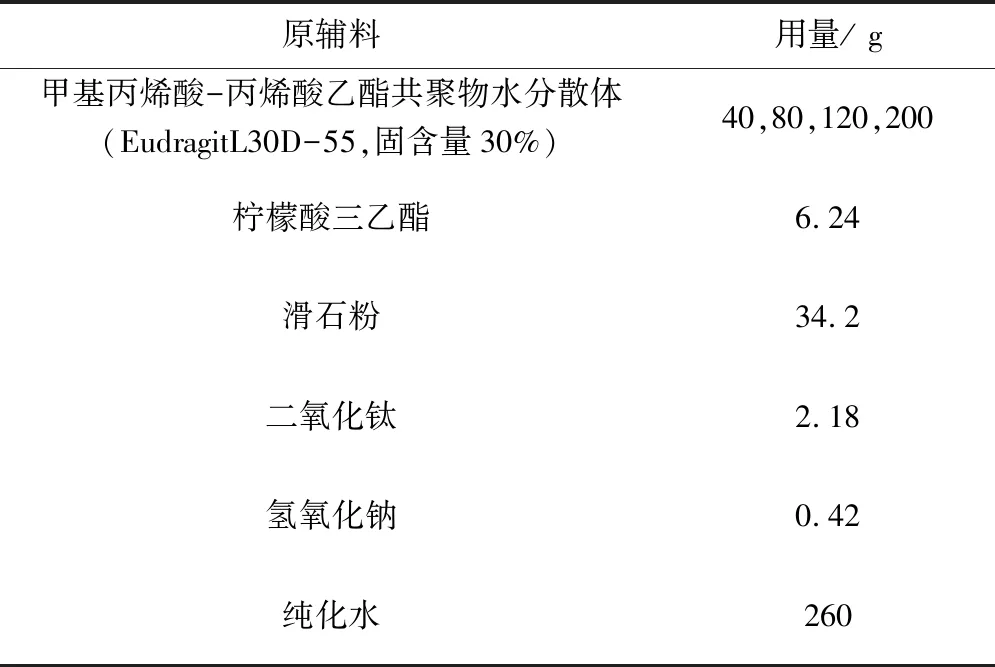
表9 肠溶层包衣处方

表10 肠溶层层包衣工艺
肠溶层包衣过程,考察甲基丙烯酸-丙烯酸乙酯共聚物水分散体用量对微丸耐酸力的影响,测定方法参考文献[7],结果表明(表11):随着甲基丙烯酸-丙烯酸乙酯共聚物水分散体用量提高微丸的耐酸能力增强,当其用量在120g以上具有较好的耐酸性能,且包衣效率较高,因此,最终选择用量为120g,此处方肠溶层增重约为50%。

表11 肠溶层微丸的耐酸力
2.3 自制雷贝拉唑钠肠溶微丸释放行为与市售品对比
按最佳处方工艺制备三批微丸,并且与日本卫材公司研制的雷贝拉唑钠肠溶片(商品名为波利特,规格10mg)进行溶出曲线比较,释放度实验采用2.1.3中所述溶出度测定方法,分别选择pH值为1.2盐酸溶液,pH值为6.0磷酸盐缓冲液,pH值为6.8磷酸盐缓冲液三种不同的介质进行,转速为50 r/min,结果表明:按照最佳处方工艺制备的三批微丸批间重复性高,在pH值为1.2盐酸条件下市售品和自制品的各时间点的平均释放量均小于10%,溶出行为相似。由表12可知,pH值为6.0磷酸盐和pH值为6.8磷酸盐介质中自制品和市售片释放曲线的f2均大于50,两者释放行为相似。详细结果见图1、图2、图3、表12。
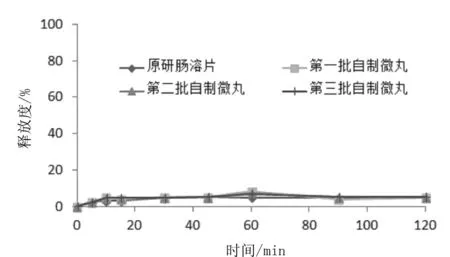
图1 pH值为1.2盐酸介质中的释放度曲线

图2 pH值为6.0磷酸盐介质中的释放度曲线

图3 pH值为6.8磷酸盐介质中的释放度曲线

表12 pH值为6.0和pH6.8值 为磷酸盐介质下的f2因子结果
3 讨论
在本研究中,采用流化床包衣工艺,设计并制备了可用于雷贝拉唑钠口腔崩解片的肠溶微丸,研究了不同处方工艺对制备雷贝拉唑钠肠溶微丸的影响并确定了最优处方工艺。
本实验微丸包衣过程中,由于微丸较小(粒径0.3 mm左右),比表面积较大,微丸静电现象严重。在处方中加入聚乙二醇6000后,静电现象得到改善;包衣过程中粘丸现象较明显,最终通过选择低粘度HPMC,控制增塑剂用量,合理控制包衣过程工艺参数,以保持良好的流化状态。
通过本实验筛选的最优处方工艺制备的雷贝拉唑钠肠溶微丸,批间重复性好,产品质量稳定,体外释放行为与市售品雷贝拉唑钠肠溶片相似,在后期研究中笔者拟采用该微丸进行雷贝拉唑钠口腔崩解片的处方和工艺的研究。
