雷公藤甲素负载外泌体抗小鼠前列腺癌作用分析
2020-10-12王可兵曹石金
曾 灿,王可兵,曹石金
(深圳市南山区蛇口人民医院泌尿外科,广东 深圳 518067)
前列腺癌发病隐匿,早期诊断困难,我国前列腺癌的发病率呈现明显上升态势[1-4]。 雷公藤甲素(triptolide, TPL)是传统中药雷公藤的主要药物成分,具有抗炎、抗肿瘤的功效, 但毒副作用限制其在临床上使用,需要对其进行减毒增效[5-10]。 外泌体(exosome)是具有纳米大小的脂小囊,生物依从性好,是未来纳米载药系统中最具前景的载体[11-16]。本研究釆用体外培养的NK 细胞分泌的外泌体作为雷公藤甲素的载体,制备负载TPL 的纳米粒exo-TPL,对exo-TPL 进行表征分析,并研究其对p53、NF-κB 信号途径的影响,以及对前列腺癌移植的小鼠模型的疗效。 通过研究比较exo-TPL 纳米粒对TPL 是否具有减毒增效的作用,是否对前列腺癌组织移植的小鼠模型的临床疗效优于TPL。 本研究为TPL 的临床应用拓展新领域,也为前列腺癌等肿瘤的治疗提供新的候选药物。
1 材料和方法
1.1 实验动物
每组各10 只2 ~4 周龄,体重15 ~20 g 的SPF雌性SCID 裸鼠,实验鼠由广东省医学实验动物中心提供并饲养[SCXK(粤)2016-0041] [SYXK(粤)2017-0119],动物实验研究的伦理经由深圳市南山区蛇口人民医院审批(20190801 - 02),做到了3R原则。
1.2 主要试剂
雷公藤甲素购自sigma 公司。 RM-1 小鼠前列腺癌细胞株购自中国科学院细胞库。
1.3 实验方法
1.3.1 Nk-exo 的制备和标志物鉴定
用小鼠骨细胞作为NK 的种子细胞,采用培养NK 细胞的方法大量培养NK 细胞,NK 经流式细胞仪鉴定符合其典型特征,如高表达CD16,不表达CD3。 分离纯化外泌体的方法采用超速离心的方法。 用BCA 方法检测外泌体的总蛋白量,用DLS 检测外泌体的粒径大小、zeta 电位,用透射电镜观察纯化的外泌体大小,用RT-PCR 分析NK 来源的外泌体中特异的MIRNAS,证明外泌体来自NK 细胞。
1.3.2 exo-TPL 纳米粒的制备
利用纯化和鉴定后的exosome,用PBS 重悬后,加入等量的TPL,采用电转法制备exo-TPL 复合纳米粒,电极条件为电压400 V,电容125 μF,4 mm 电转杯进行电转。 用倒置离心超滤膜过滤去除游离的和非特异性结合的雷公藤甲素。 应用反相高效液相色谱法,集合超速冷冻离心法测定exo-TPL 纳米粒的载药量和包封率。 HPLC 法测定exo-TPL 纳米粒的体外释药性能。
1.3.3 MTT 法
将细胞接种于96 孔板,每孔100 μL,细胞数约1×104,常规培养24 h。 除对照组加入生理盐水外,其他3 组分别给予exo-TPL 纳米粒、TPL 和空白纳米粒继续培养24 h、48 h。 弃上清,PBS 清洗细胞后加入MTT 20 μL 和无血清培养基80 μL,37℃孵育4 h。 离心弃上清,每孔加入DMSO 150 μL,放在摇床上低速振荡10 min,用酶标仪检测570 nm 处的吸光度值。 根据公式统计细胞存活率。 公式如下:活细胞率(%)= (实验组吸光度值/ 对照组吸光度值)×100%。
1.3.4 qPCR
按照RNA 提取试剂盒提取细胞的RNA,用紫外/ 可见分光光度计测定细胞的RNA 的浓度。 按照TaKaRa 反转录试剂盒PrimeScripttm RT reagent Kit with gDNA Eraser 说明书进行反转录,合成cDNA。以反转录得到的cDNA 为模板按照TaKaRa SYBR Premix Ex Taq Ⅱ说明书进行PCR。 琼脂糖凝胶电泳分析扩增产物条带。 数据分析所用方法为2-ΔΔCt法,其中Ct 值为基因进入指数增长期的循环数,而ΔCt 为处理组目的基因的Ct 值与对照组目的基因的Ct 值之差。 引物序列为:GAPDH(上游引物5’-ACCACAGTCCATGCCATCAC-3’; 下 游 引 物 5 ’-TCCACCACCCTGTTGCTGTA-3’); p53 ( 上 游 引 物5’-CAGCCAAGTCTGTGCTTGCAC-3’;下游引物5’-CTATGTCGAAAAGTGTTTCTGTCATC-3 ’); NF-kB(上游引物5’-AGTTGAGGGGACTTTCCCAGGC-3’;下游引物5’-GCCTGGGAAAGTCCCCTCAACT-3’)。
1.3.5 前列腺癌移植小鼠模型的构建
收集培养的RM-1 小鼠前列腺癌细胞,细胞计数后配成浓度为1×107/ mL 的细胞悬液,接种于小鼠右侧腋窝皮下。 每只小鼠200 μL,对照组小鼠接种等体积生理盐水。 模型小鼠尾静脉注射TPL 或exo-TPL 纳米粒,空白纳米粒为对照组,观察肿瘤体积大小和小鼠存活时间。
1.3.6 一般情况
观察各组小鼠在服药过程中的毛发色泽、饮食、饮水和活动状态等。
1.3.7 药动学、生物分布和药效学研究
在小鼠体内注射exo-TPL 纳米粒、TPL,在不同时间点取血样,用液质联用(LC-MS)分析血液中药物的含量,评价载药纳米粒的抗降解能力。 取小鼠各器官液氮冻存,在冷冻条件下碾磨组织,用LC-MS检测各器官组织的药物含量,来研究载药纳米粒在体内的组织分布。
1.4 统计学方法
2 结果
2.1 exo-TPL 纳米粒的制备
用小鼠骨细胞作为NK 的种子细胞,采用培养NK 细胞的方法大量培养NK 细胞,NK 经流式细胞仪鉴定符合其典型特征。 电镜结果表明外泌体呈圆形,大小较为均一,粒径大小约100 nm。 qPCR 实验发现NK 来源的外泌体中特异的MIRNAS 高表达,证明外泌体来自NK 细胞。 利用纯化和鉴定后的exosome,用PBS 重悬后,加入等量的TPL,采用电转法制备得到exo-TPL 复合纳米粒。 应用反相高效液相色谱法,集合超速冷冻离心法测定exo-TPL纳米粒的载药量和包封率。 其载药量可达2.01%,包封率为60.42%。 exo-TPL 纳米粒的释放率在4 h之后达到平衡,最大释药率约为65.00%。
2.2 细胞增殖抑制率的比较
用10 ng / mL、40 ng / mL 和80 ng / mL 的雷公藤甲素分别孵育RM-1 小鼠前列腺癌细胞24 h 和48 h,MTT 结果表明,TPL 组能明显抑制RM-1 小鼠前列腺癌细胞的增殖,且抑制作用随着药物浓度和作用时间的增加呈剂量和时间依赖性的增加。 exo-TPL 纳米粒组对RM-1 小鼠前列腺癌细胞的增殖抑制率明显高于TPL 组。 见表1。
2.3 NF-κB 和p53 表达水平比较
qPCR 结果显示,80 ng / mL 雷公藤甲素孵育RM-1 小鼠前列腺癌细胞48 h,与对照组相比,TPL组和exo-TPL 纳米粒组,RM-1 小鼠前列腺癌细胞的NF-κB mRNA 表达水平均显著降低。 与TPL 组相比,exo-TPL 纳米粒组NF-κB mRNA 表达水平显著降低。 与对照组相比,TPL 组和exo-TPL 纳米粒组,RM-1 小鼠前列腺癌细胞的p53 mRNA 表达水平均显著升高。 与TPL 组相比, exo-TPL 纳米粒组p53 mRNA 表达水平显著升高。 见表2。
免疫印记结果显示,80 ng / mL 雷公藤甲素孵育RM-1 小鼠前列腺癌细胞48 h,与对照组相比,TPL组和exo-TPL 纳米粒组,RM-1 小鼠前列腺癌细胞的NF-κB mRNA 表达水平均显著降低。 与TPL 组相比,exo-TPL 纳米粒组NF-κB mRNA 表达水平显著降低。 与对照组相比,TPL 组和exo-TPL 纳米粒组,RM-1 小鼠前列腺癌细胞的p53 mRNA 表达水平均显著升高。 与TPL 组相比,exo-TPL 纳米粒组p53 mRNA 表达水平显著升高。 见图1。
2.4 荷瘤小鼠一般形态学改变
将1×107/ mL 浓度的RM-1 小鼠前列腺癌细胞200 μL 接种于小鼠右侧腋窝皮下,制备前列腺癌小鼠模型。 从接种第8 天开始,分别尾静脉注射TPL或exo-TPL 纳米粒,给药剂量为0.7 mg / kg, 对照组尾静脉注射等量空白纳米粒,每周第1 ~2 天给药,共给药2 周。 对照组小鼠精神不佳、活动减少。 与对照组相比,TPL 组和exo-TPL 纳米粒组小鼠精神食欲佳。
2.5 不同组荷瘤小鼠肿瘤大小对比
给药2 周后,剥离肿瘤后测量其体积和质量。与对照组相比,TPL 组和exo-TPL 纳米粒组肿瘤体积和质量均明显减小。 exo-TPL 纳米粒组肿瘤体积和质量明显小于TPL 组。 见表3。
2.6 不同组荷瘤小鼠生存时间对比
对照组小鼠的平均荷瘤生存期为(16.6±2.1)d,与对照组相比,TPL 组和exo-TPL 纳米粒组小鼠的平均荷瘤生存期延长,分别为(23.8±2.3) d 和(27.4±2.2) d。 exo-TPL 纳米粒组平均荷瘤生存期长于TPL 组。 见表4。
2.7 血液中药物浓度
在小鼠体内注射exo-TPL 纳米粒、TPL,给药后第7 天、14 天取血样,用液质联用(LC-MS) 分析血液中雷公藤甲素的含量,评价载药纳米粒的抗降解能力。 见表5。
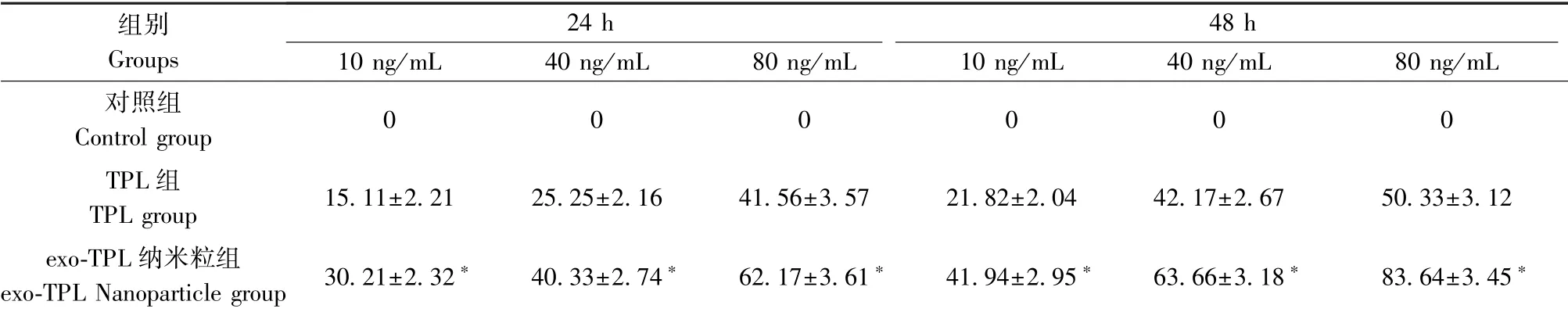
表1 细胞增殖抑制率比较Table 1 Comparison of cell proliferation inhibition rate
2.8 雷公藤甲素组织分布情况
给药2 周后,取小鼠各器官液氮冻存,在冷冻条件下碾磨组织,用LC-MS 检测各器官组织的雷公藤甲素含量,来研究载药纳米粒在体内的组织分布。小鼠各组织雷公藤甲素含量测定结果见表6。
3 讨论
前列腺癌发病隐匿,早期诊断困难,约有75%的患者确诊时已是进展期或晚期,并且最终都将丧失对雄激素的依赖性,转变为去势抵抗性前列腺癌。 我国前列腺癌的发病率呈现明显上升态势。世界各国每年投入巨额经费进行前列腺癌基础研究和临床治疗,但至今尚未获突破性进展[1-2]。 近年来前列腺癌的免疫治疗取得较大进展,如前列腺癌的树突状细胞疫苗已上市、PROSTVAC 进入临床III 期试验[17]。 前期研究中,我们构建表达前列腺特异性膜抗原的腺病毒感染体外培养的树突状细胞疫苗和靶向体内树突状细胞亚群的负载前列腺特异性膜抗原的纳米疫苗进行体内外实验,结果均表明这些疫苗对前列腺癌细胞有一定的特异杀伤作用[18],但现有免疫治疗的效果仍不理想,因此探索新的药物和治疗方法非常迫切。

表2 NF-κB 和p53 表达水平比较Table 2 Comparison of NF-κB and p53 expression levels
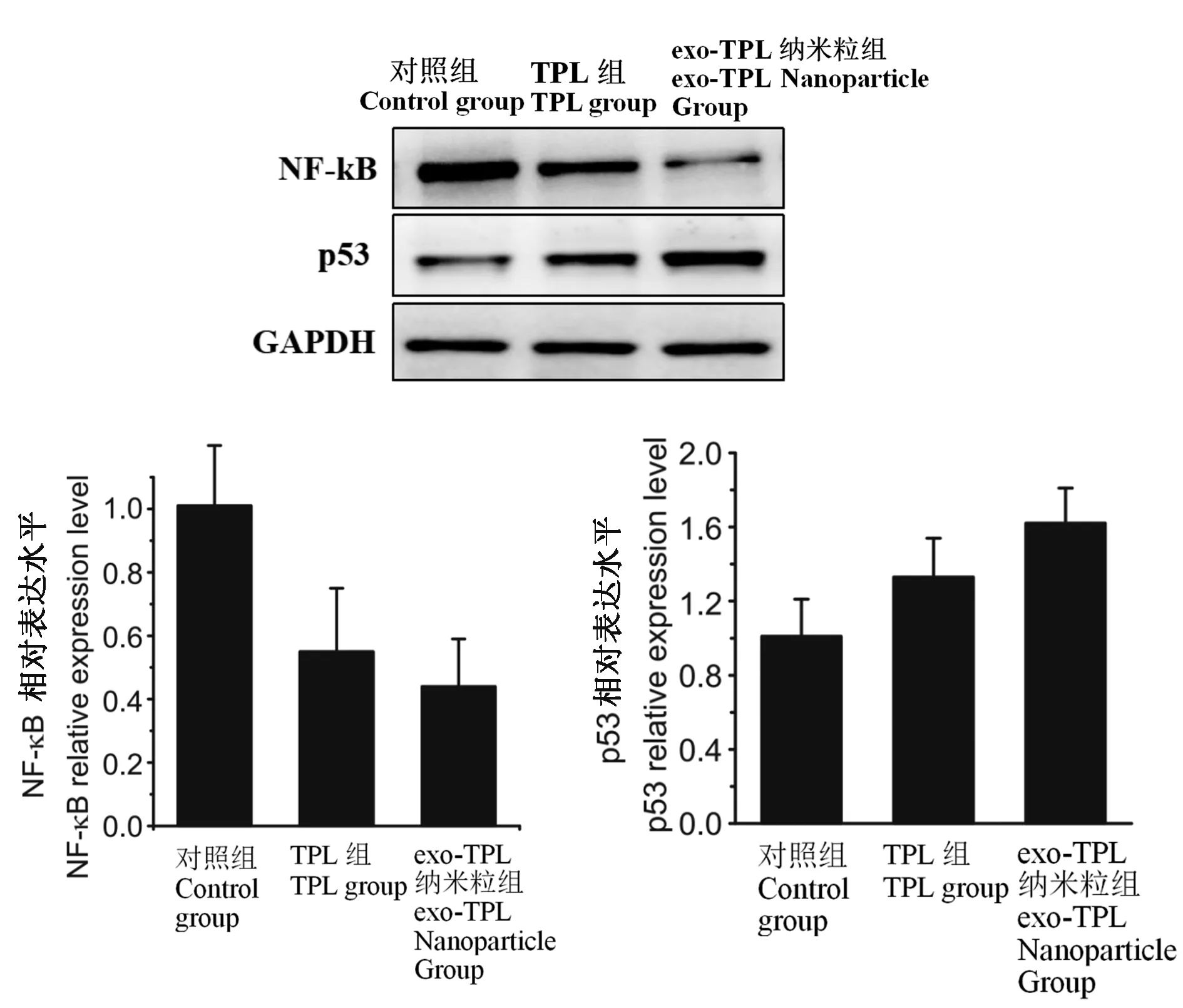
图1 NF-κB 和p53 蛋白表达水平比较Figure 1 Comparison of NF-κB and p53 protein expression levels
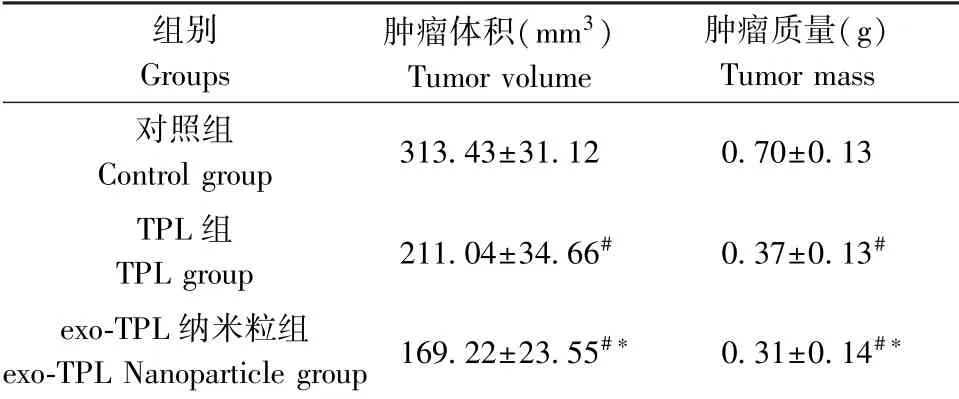
表3 小鼠肿瘤体积和质量Table 3 Mouse tumor volume and mass

表4 小鼠生存时间Table 4 Survival time of mice
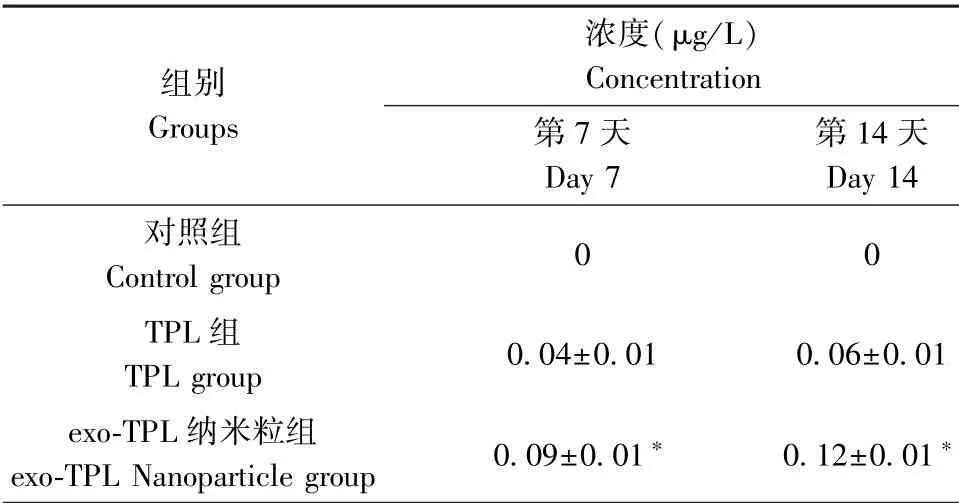
表5 血液中药物浓度Table 5 drug concentration in blood
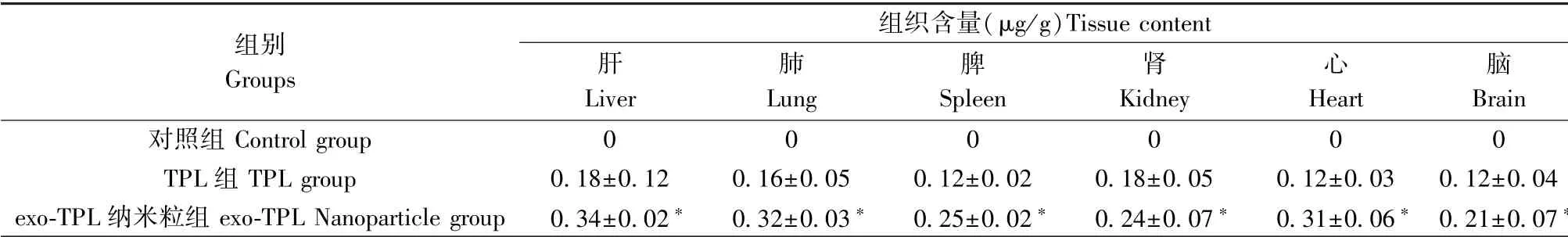
表6 雷公藤甲素组织分布情况Table 6 Tissue distribution of triptolide
雷公藤甲素(triptolide, TPL) 是传统中药雷公藤的主要药物成分,具有抗炎、抗肿瘤的功效,但毒副作用限制其在临床上使用,需要对其进行减毒增效[5-10]。 外泌体(exosome) 是具有纳米大小的脂小囊,生物依从性好,是未来纳米载药系统中最具前景的载体[11-16]。 本研究采用体外培养的自然杀伤细胞(NK)分泌的外泌体作为TPL 的载体,制备新型TPL 纳米粒(命名为exo-TPL),对exo-TPL 进行表征,并研究其对p53、NF-κB 信号途径的影响,以及对前列腺癌组织异物移植的小鼠模型的疗效。本研究为TPL 的临床应用拓展新领域,也为前列腺癌等肿瘤的治疗提供新的候选药物。
本研究结果显示,exo-TPL 纳米粒组对RM-1 小鼠前列腺癌细胞的增殖抑制作用随浓度的增加和作用时间的延长而增强。 exo-TPL 纳米粒组的TPL可持续释放,持续作用于RM-1 小鼠前列腺癌细胞,与TPL 组相比,可以产生更强的抑制肿瘤细胞增殖的作用。 NF-κB 具有转录激活功能,广泛参与机体的应激和炎症反应并参与肿瘤的发生和发展[19]。实验发现,与TPL 组相比,exo-TPL 纳米粒组NF-κB mRNA 表达水平显著降低。 p53 作为一种重要的抑癌基因,与肿瘤发生发展密切相关[20]。 与TPL 组相比,exo-TPL 纳米粒组p53 mRNA 表达水平显著升高。 给药2 周后,剥离肿瘤后测量其体积和质量,exo-TPL 纳米粒组肿瘤体积和质量明显小于TPL组,提示与TPL 组比较,exo-TPL 纳米粒组可以更好的抑制前列腺癌皮下瘤的增长,并且可以明显延长荷瘤小鼠的生存时间。 组织分布结果表明,TPL 在肝、肺、脾、肾、心、脑主要组织器官中均有分布,并呈现不同程度的差异分布。 与TPL 组相比,exo-TPL 纳米粒组可在血液和组织中保持更高的浓度,可以更好的发挥药效。
综上所述,本研究在前列腺癌小鼠皮下瘤模型中证明,与TPL 组相比,exo-TPL 纳米粒组可以产生更强的抑制肿瘤的作用。 本研究为TPL 的临床应用拓展新领域,也为前列腺癌等肿瘤的治疗提供新的候选药物。
