基于microRNA表达量及判别分析的外周血与月经血鉴别
2020-10-12
(1.山西医科大学法医学院,山西 太原 030001;2.公安部物证鉴定中心 现场物证溯源技术国家工程实验室 法医遗传学公安部重点实验室,北京 100038;3.中国疾病预防控制中心传染病预防控制所 传染病预防控制国家重点实验室,北京 102206;4.枣庄学院数学与统计学院,山东 枣庄 277160)
体液组织属性来源鉴别即鉴别未知斑迹或体液属于何种体液组织,进而推断案发现场可能发生过的犯罪活动,可以为案发现场的重建提供线索,并为案件侦破提供有力的证据支持[1-2]。血液作为法医学最常见的体液检材,其准确定性意义重大,而对确定为血液的样本进一步鉴别其是外周血还是月经血,可为案件定性提供重要的指向性线索。当前,外周血与月经血两种法医学常见体液的鉴别依然是法医学体液组织来源鉴别的难点。
目前法医学实践中使用的传统体液鉴别方法如化学试验、光谱方法和显微镜检查等,缺乏特异性及灵敏性,每次只能检测一种体液。随着分子生物学技术的发展,一些新型的体液鉴别方法有望取代传统体液识别方法,如RNA分析、DNA甲基化以及微生物法等,其中RNA分析[包括信使RNA(mRNA)、微RNA(microRNA,miRNA)等]技术最为成熟,有望解决法医学常见的几种体液(精液、外周血、唾液、阴道分泌液及月经血等)的鉴别分析问题[3]。
miRNA是真核生物中一类长度约为22个碱基的不编码蛋白质的单链微小RNA,通过对mRNA的降解和翻译抑制,发挥其基因表达调控作用[4]。miRNA因具有稳定性高、组织特异性好等特性成为国内外法医学者进行体液组织来源推断研究的热点[5-22]。然而,利用miRNA进行法医学外周血与月经血体液鉴别的研究仍存在不少问题及难点。2014年,HANSON等[8]采用logistic回归分析法建立了月经血鉴别模型,可准确地将月经血从外周血、精液、唾液、阴道分泌液4种体液中鉴别出来,但是缺乏外周血的鉴别方案。2016年,SAUER等[6]通过构建两个判别函数,分别实现了唾液与阴道分泌液、月经血与外周血的鉴别,但未实现月经血、外周血两种血液类样本与非血液类样本的鉴别。相关研究[6,8-9]证实了数学模型法适用于基于miRNA的法医学体液鉴别的研究,但所构建的模型鉴别范围小,均未形成完善的法医学外周血和月经血的体液鉴别方案,亟须补充研究。
本研究从大量已发表的研究成果[6-8,11-22]中筛选出 6种 miRNA(miR-451a、miR-144-3p、miR-144-5p、miR-214-3p、miR-203-3p和miR-205-5p),同时选用RNU6b作为内参基因,使用荧光定量PCR技术检测目标miRNA在不同体液中的相对表达量,并根据表达量数据构建可同时区分血液与非血液类样本以及区分外周血与月经血样本的判别分析模型,为法医学外周血和月经血的鉴别提供可行方案。
1 材料与方法
1.1 样本收集
样本来源:采集来自中国北方地区年龄在25~35岁的250名无关志愿者个体的体液类样本,包括外周血、月经血、唾液、精液和阴道分泌液各50份。所有志愿者均已签署知情同意书。
采集方法:采用静脉穿刺将外周血收集于入乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝采血管内,利用无菌塑料管采集唾液(样本收集前禁食1 h),利用无菌广口塑料杯收集精液(志愿者于样本收集前禁欲2 d),以上液体样本收集后直接置于-80℃冰箱储存备用。月经血(月经周期前4d)和阴道分泌液均通过收集卫生棉条获取,经室温晾干1d后置于-80℃冰箱储存备用。
1.2 候选miRNA分子标记的选择
根据已报道的多篇研究[6-8,11-22]挑选出6种miRNA(miR-451a、miR-144-3p、miR-144-5p、miR-214-3p、miR-203-3p和miR-205-5p)进行研究,其中miRNA-451a和miR-144-3p为外周血特异性标记,miR-203-3p、miR-205-5p为唾液特异性标记,miR-144-5p、miR-214-3p为月经血特异性标记,使用RNU6b作为内参基因[7,14-15],各miRNA及内参基因的信息见表1。
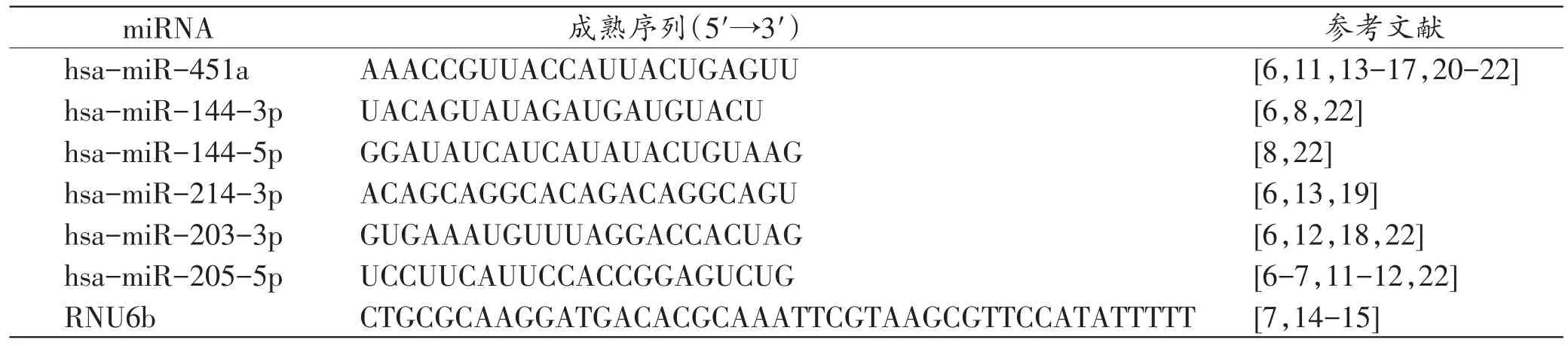
表1 各miRNA及内参基因的信息Tab.1 Information of each miRNA and the internal reference gene
1.3 RNA提取和定量
采用miRNeasy Mini试剂盒(德国Qiagen公司),按照操作说明书进行总RNA的提取。利用NanoDrop 2000c分光光度计(美国Thermo Fisher Scientific公司)进行总RNA浓度和纯度的测定[18]。
1.4 cDNA合成
本研究采用茎环反转录法,选用M-MLV Reverse Transcriptase反转录试剂盒(美国Invitrogen公司)进行反转录[18]。单个反转录体系共20μL:100ng总RNA,1μL特异茎环反转录引物,4μL 5×First-Strand Buffer(美国Invitrogen公司),2 μL 0.1 mol/L二硫苏糖醇(dithiothreitol,DTT,美国Invitrogen公司),0.5μL dNTP混合物(日本TaKaRa公司),1 μL反转录酶M-MLV(美国Invitrogen公司),0.2 μL Recombinant RNasin®RNase Inhibitor(美国Promega公司),加无核酸酶水(日本TaKaRa公司)至体系为20 μL。反转录程序:16℃ 30min,37℃ 30min,65℃ 5min,4℃保温。设置反转录阴性对照(用无核酸酶水取代反转录酶)。
1.5 实时荧光定量PCR
采用SYBR Green实时荧光定量PCR技术,其反应体系共10μL:Power SYBR® Green PCR Master Mix(2×)5μL,通用正向扩增引物(10μmol/L)0.25μL,特异性反向扩增引物(10μmol/L)0.25μL,无核酸酶水4 μL,cDNA产物0.5 μL。实时荧光定量PCR扩增程序:95℃ 10min;95℃ 15s,60℃ 1min,共40个循环;95℃ 15 s;60℃ 1 min条件下进行熔解曲线分析。在QuantStudioTM7 Flex Real-Time PCR System(美国Applied Biosystems公司)上进行实时荧光定量PCR反应。采用HID Real-Time PCR Analysis Software v1.3 收集数据[18]。将Ct>35视作未检测到[6,23]。每份样本检测3次,取平均值。设置qPCR阴性对照(用无核酸酶水替换样本作为模板)。
1.6 统计分析
计算每个miRNA的相对表达量(ΔCt=CtmiRNACtRNU6b)。RNU6b作为内参基因用于数据归一化。随机选取200份样本(每种体液各40份)的相对表达量作为训练集样本用于数据分析,以6种miRNA的相对表达量为自变量(x)、3类体液类型(外周血、月经血及非血液类体液)为因变量(y)构建模型。其中:y指代体液类型,y1~y3分别为外周血、月经血和非血液类体液;x指代特定 miRNA 的 ΔCt值,x1~x6分别对应miR-451a、miR-144-3p、miR-144-5p、miR-214-3p、miR-203-3p、miR-205-5p。
另外选取50份样本(每种体液10份)的相对表达量作为测试集对模型进行准确性验证。
采用SPSS 22.0软件对训练集样本数据进行正态分布检验、差异性分析、Fisher判别分析模型的构建以及模型的交叉验证和自身验证。对于服从正态分布和方差齐性的数据采用单因素方差分析,不服从正态分布或方差齐性的数据采用非参数检验法(Kruskal-WallisH检验)进行差异性分析。检验水准α=0.05。
2 结 果
2.1 6种miRNA在5种体液中的表达
使用荧光定量PCR检测6种miRNA在200份训练集样本中的相对表达量,同时进行正态分布检验,结果显示,6种miRNA均不服从正态分布(P<0.05)。
将所有样本分为3类体液[外周血、月经血及非血液类体液样本(唾液、精液、阴道分泌液)],进行Kruskal-WallisH检验,结果显示:miR-451a、miR-144-3p及miR-205-5p在3类体液样本间的表达差异均有统计学意义(P<0.05);miR-144-5p在外周血与非血液类样本、月经血与非血液类样本间的表达差异有统计学意义(P<0.05),在外周血与月经血间的表达差异无统计学意义(P>0.05);miR-203-3p和miR-214-3p在外周血与月经血、外周血与非血液类样本间的表达差异均有统计学意义(P<0.05),在月经血与非血液类样本间的表达差异无统计学意义(P>0.05)。详见表2。
表2 6种miRNA在3类体液中的表达Tab.2 Expression of 6 miRNAs in 3 kinds of body fluids (±s)

表2 6种miRNA在3类体液中的表达Tab.2 Expression of 6 miRNAs in 3 kinds of body fluids (±s)
注:1)与外周血中同种miRNA比较,P<0.05;2)与月经血中同种miRNA比较,P<0.05。
样本类型外周血月经血非血液类体液n 40 40 120 miR-451a-9.44±1.16-5.27±2.241)5.50±2.201)2)miR-144-3p 3.16±2.09 7.30±2.661)11.25±2.211)2)miR-205-5p 14.77±1.33 3.06±2.421)0.37±2.381)2)miR-214-3p 10.87±1.19 4.32±2.091)5.26±2.251)miR-144-5p 2.27±1.41 3.94±2.29 13.53±2.051)2)miR-203-3p 14.45±1.58 2.11±2.481)0.92±3.741)
2.2 Fisher判别分析模型的建立
基于200份训练集样本的6种miRNA的相对表达量构建判别函数,建立3个Fisher判别函数,用于鉴别3类体液,方程如下:
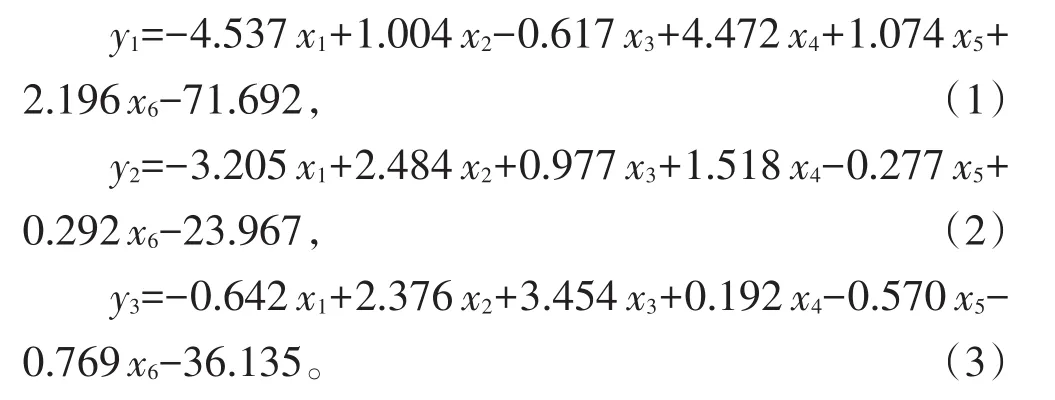
鉴别未知样本是何种体液,需使用荧光定量PCR技术检测6种miRNA及内参基因获取目标miRNA的ΔCt值,代入上述3个函数方程,y值最大的函数对应的体液类型即为未知样本的体液类型。
2.3 Fisher判别分析模型准确性的验证
为检测所建立判别分析模型的准确性,SPSS软件自动对所构建的判别分析模型进行自身验证和交叉验证,另外采用测试集样本进一步检验模型的准确性。模型自身验证准确率达99.5%,交叉验证准确率达99.5%,测试集样本鉴别体液类型的准确率可达100%,说明模型准确性良好,可以满足实际需要,见图1。
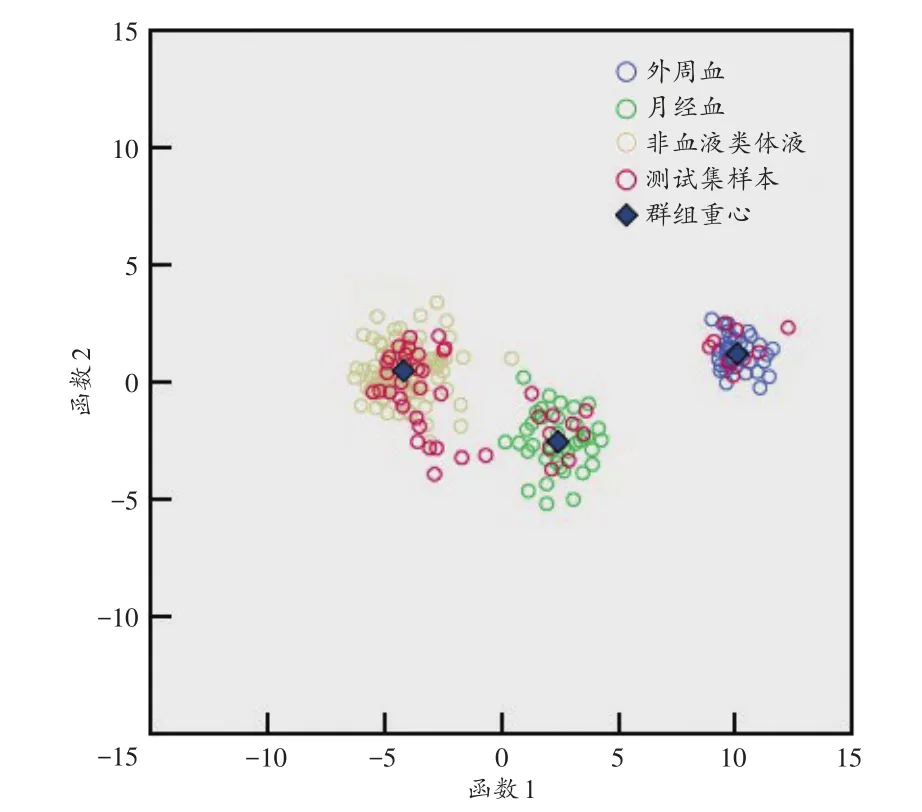
图1 3类体液样本的判别分析模型分类结果Fig.1 Classification results of discriminant analysis model for 3 kinds of body fluid samples
3 讨 论
近年来,miRNA因具有稳定性高、组织特异性好等生物学特性,被国内外法医学者广泛用于法医学体液组织来源推断的研究中,但作为细胞内调节分子,参与基因表达的调控,其表达水平受内外环境影响,具有个体差异[2],进行大量样本检测后,miRNA检测数据总体常呈非正态分布。本研究所用Fisher判别分析方法的原理是利用已知分类的大量样本数据构建判别分析模型,以判别未知样本的所属类型,该方法区别于其他判别分析方法的特点是其对数据总体的分布不作任何要求,适用范围更广,对基于miRNA的体液组织来源鉴别方法的构建具有独特的优势。
由于miRNA在体液组织中含量相对较低,以及不同实验室所采用的试剂及技术平台等不同,导致不同实验室的结果并不完全一致[7,19]。本实验室前期研究[18]结果显示,miRNA在不同体液中的表达并非完全特异,但表达量却存在差异,同时分析了多种miRNA在不同体液中的表达量差异情况,有望实现不同体液样本的区分。本研究将miR-451a、miR-144-3p、miR-144-5p、miR-214-3p、miR-203-3p和miR-205-5p这6种miRNA作为候选分子标志物,获取其在不同体液样本中的表达量数据后,采用非参数检验,分析6种miRNA在外周血、月经血及非血液类体液中的鉴别潜力,数据结果证实了6种miRNA具有鉴别特定体液的能力。miR-203-3p、miR-205-5p常被用作唾液特异性标记,本研究发现,这两种标记不仅在唾液中高表达,还在月经血中高表达,可用于鉴别外周血及月经血。为更好地发挥每种miRNA的鉴别能力,本研究采用判别分析法,同时分析6种miRNA在多种体液中的表达情况并建立判别分析模型,结果显示miR-451a、miR-144-3p、miR-144-5p、miR-214-3p、miR-203-3p和miR-205-5p这6种miRNA联合使用可达到准确鉴别月经血、外周血及非血液性样本的效果。
大量相关研究[5-19]在进行体液miRNA筛选时,均选择特定体液的特异性miRNA分子,以达到通过检测特定miRNA的存在与否判定样本体液类型的目的。然而实际上,绝大多数miRNA的特异性并不能满足直接判定的要求,如miR-205-5p在多种体液中都能检测到其表达[6,12]。本研究通过对大量miRNA表达量数据的获得和分析,确立了联合使用多个miRNA判别不同体液样本的方法,不用考虑某种或某几种miRNA在特定体液中的特异性问题,直接根据表达量数值和数学公式进行结果判定,可规避主观误差或错误,结果更为科学、准确。但本研究的判别分析模型是基于单一体液来源样本构建的,暂未涉及混合样本,此外,对于统计学方法而言,样本数量是保证模型准确性的重要前提,后期研究将进一步增加样本数量并继续筛选特异性标志物,以进一步验证和提高模型的准确性。
本研究通过对5种法医学现场常见的体液类型共200份样本的6种miRNA进行相对定量检测,建立了鉴别外周血、月经血及非血液类体液3组样本的Fisher判别分析模型。模型自身验证及交叉验证准确率均达99.5%,未知样本组织来源的识别准确率达100%,具有高度的特异性、准确性,为解决法医学体液鉴别难点提供了可行的鉴别策略,有望应用于法医学体液组织来源鉴别的实践中。
