合成生物学在含氟化合物生产中的应用
2020-10-10王高丽金雪芮罗云孜
王高丽,金雪芮,罗云孜,2
(1天津大学化工学院,系统生物工程教育部重点实验室,合成生物学前沿科学中心,天津300072;2天津大学化学化工协同创新中心,天津300072)
含卤素有机化合物的种类丰富,在医药、化工以及材料等领域都有广泛的应用[1]。氟元素在地壳中的含量位于第13位,是含量最高的卤素。但由于氟元素电负性极强,极易失去电子形成氟负离子,从而难以形成有机化合物,因此天然含氟化合物的含量很少。1986年从非洲一种二瓣草属植物的次级代谢产物中发现了含氟产物,为具有毒性的单取代氟乙酸,这是已报道的最早发现的天然氟化物[2]。由于氟原子极强的电负性,C—F键高度极化不易断裂,通过在一些药物分子上引入氟原子,能够改善其药物化学性质,实现其药物构型的改变,提高其药物代谢稳定性以及与目标蛋白的亲和力等[3],故有机氟化物在医药方面有重要的应用潜力。例如天然灰黄霉素是一种真菌代谢物,具有抗真菌的作用,利用亲氟试剂引入氟原子,不同的氟取代产物展现出了不同的活性,甚至有部分取代物展现出抗癌活性。依泽替米贝是一种含氟降血脂药,能够抑制胆固醇的吸收。药物分子上两个氟原子的取代分别阻断了两个代谢不稳定位点,防止苯环氧化成苯酚以及甲氧基脱烷,提高了药物的代谢稳定性[4]。目前常用的有机氟化物的合成方法为化学法,以重金属及重金属氧化物为催化剂,在无水极性介质中进行氟化反应,反应条件较为苛刻,能耗高,且重金属催化剂对环境有一定的危害[5],同时由于氟原子极强的电负性,反应的选择性往往难以控制,产物的收率也往往较低。因此发展有高选择性的绿色生物氟化反应具有重要意义。
合成生物学是依照化学、生物、物理学家等所阐述的规则,对生物系统进行定向设计,从而构建出符合人们要求的生物合成系统[6]。合成生物学技术涵盖了基因组学、蛋白质工程、代谢工程、系统生物学、生物信息学等一系列学科的研究方法。随着合成工具、分析工具、模型构建工具的发展,合成生物学在重要化合物生物合成系统的构建和优化等方面有了很大的进展[7-12],主要体现如下。①利用蛋白质工程技术通过理性设计与定向进化对酶进行设计和改造,使其高效催化指定的反应[13-15]。例如P450单氧化酶能够催化1,8-桉树酚羟基化转化为2-β-羟基-1,8-桉树酚,通过定向进化对P450单氧化酶进行改造,产生的突变体的酶活提高到原来的3.8倍[16];又如Baker等[17]通过计算机算法设计蛋白,实现了对超大分子量双组分的二十面体蛋白的精确设计和组装;通过分析宏基因组数据,实现了对蛋白相互作用的预测,为人工定向设计改造蛋白提供了新思路[18-20]。②通过设计优化天然产物生物合成途径,实现目标产物的高效合成[21-23]。例如通过改变细胞内初级代谢积累的三酰甘油的碳流向,提高了链霉菌中多种聚酮化合物的产量[24]。③利用合成生物学策略,挖掘并激活沉默基因簇[25-27]。例如通过“即插即用”的合成生物学策略,激活了链霉菌中能够合成一种大环内酰胺的基因簇,并得到了具有不同结构的新型大环内酰胺化合物[28]。
天然含氟化合物的含量很少,目前仅在几种微生物中发现了一类能够催化形成C—F键的氟化酶[29-32]。这些酶具有高度相似性。氟化酶的发现推动了合成生物学在生物合成氟化物方面的研究。目前已有相关研究将合成生物学策略应用到氟化物的生物合成中,并取得了一定的成效。例如通过对基因组进行分析,挖掘出微生物基因组中潜在的氟化酶合成基因[29],再利用蛋白质工程对现有氟化酶进行改造,提高了氟化酶的催化效率和稳定性[30]。利用合成生物学模块化的思维,构建含氟模块并将其引入到链霉菌中聚酮类天然产物的生物合成途径中,能够实现复杂有机氟化物的合成[31]。另外,通过改变宿主菌代谢途径中的碳流向来提高氟化物的生物合成产量,也是未来合成生物学应用于含氟化合物生产的研究方向之一。本文围绕氟化酶讨论了对天然氟化酶的改造措施以及改造后的酶在含氟化合物合成中的应用,也介绍了通过引入含氟模块实现含氟化合物生物合成系统构建的策略(图1)。
1 氟化酶的研究与应用
目前天然氟化酶的来源很少,且存在稳定性低、催化效率不高等问题。下面对目前已知的不同来源的氟化酶进行了总结,并介绍了一些能够有效提高氟化酶的稳定性和催化效率的优化策略。

图1 氟化酶及生物合成系统在生产含氟化合物中的应用Fig.1 Applications of fluorinase and biosynthesis systems in the production of fluorinated compounds
1.1 从微生物中挖掘天然氟化酶
微生物是生物合成重要化合物的“细胞工厂”。多种酶促反应组成的复杂代谢通路网络作为“细胞工厂”的“生产线”,实现目标化合物的合成。酶在生物合成中起着关键作用。随着分子生物学、基因组学和蛋白质工程等学科的发展,人们对于酶的本质和功能有了更深入的了解。天然氟化物在自然界中的含量很少,目前仅在几种放线菌中发现了天然氟化物的存在,进一步研究表明这几种放线菌中均含有相似度极高的一类氟化酶,能够催化无机氟离子与S-腺苷-L-甲硫氨酸(SAM)反应,生成5'-氟-5'-脱氧腺苷(5'-FDA)(图2)。下面对目前研究已发现的氟化酶及其催化机理进行简单的归纳。

图2 天然氟化酶催化的氟化反应[31,33]Fig.2 Fluorination reaction catalyzed by natural fluorinase[31,33]
Streptomyces cattleya最初用于生物合成抗生素沙纳霉素。发酵过程中,当反应底物中含有氟(无机氟或有机氟)时,则生成了一种新的含氟化合物,为沙纳霉素的类似物,后被鉴定为4-氟苏氨酸(4-FT)的立体异构体。在同样的培养条件下,从该菌株的发酵液中又发现了氟乙酸[33],体现出其合成含氟天然产物的潜力,这也是第一次发现能够合成天然氟化物的微生物。2012年,O'Hagan等[34-36]在S.cattleyaDSM46488中确定了氟乙酸和4-氟苏氨酸的体内生物解析,鉴定了生成这两种氟化物每一步代谢反应所需的酶。氟化物生物合成途径第一步是通过氟化酶(FlA)引入氟原子,这一步在整个合成途径中起关键作用。在这一步反应中,氟化酶催化氟离子对SAM发生亲核进攻,生成5'-FDA。继而腺苷磷酸化酶(PNP)催化亲核磷酸进攻,脱去5'-FDA的腺苷碱基,生成5-氟-5-脱氧-D-核糖-1-磷酸(5-FDRA),下一步酶催化开环异构反应将5-FDRA转化为5-氟-5-脱氧-核酮糖-1-磷酸(5-FDRulP),再经酶催化醛缩反应的逆反应转化为氟乙醛。合成氟乙酸和4-FT的生物途径中都具有以上4步酶促反应,从第5步酶促反应开始出现分支。氟乙醛在乙醛脱氢酶的作用下生成氟乙酸,在乙醛转醛酶作用下转化为4-FT(图3)。研究同时在体外将氟化酶与氟离子和SAM混合,并在反应体系中检测到5'-FDA的生成,验证了氟化酶催化C—F键形成的能力[35]。
通过全基因组分析,从链霉菌Streptomycessp.MA37[36]、诺卡菌Nocardia brasiliensis[29]、放线菌Actinoplanessp.N902-109[37-38]、海洋微生物Streptomyces xinghaiensisNRRL B24674[38-39]以及最新发现的嗜盐放线菌Actinopolyspora mzabensis[40-41]的基因组中分别发现了与flA基因高度相似的氟化酶基因,相似度分别为87%、81%、80%、84%以及79%,分别编码氟化酶FlA1、FlA2、FlA3、FlA4以及Am-FlA。这几种氟化酶的氨基酸序列表明,它们都含有一个由21个氨基酸组成的特征残基环[42]。将这几种氟化酶分离纯化,在体外与氟离子和SAM混合反应后,结果表明这几种氟化酶都具有催化氟离子与SAM结合生成5'-FDA的能力,但反应速率与反应进程有所不同(表1),表明这几种酶的活性具有差异性[36-41]。结果表明,来自链霉菌Streptomycessp.MA37的氟化酶FlA1的活性最高。
1.2 天然氟化酶的优化改造
目前已从微生物中发现了6个具有高度相似性天然氟化酶,均能催化SAM和氟离子转化为5'-FDA。但由于天然氟化酶活性较低且底物专一性强,还未得到广泛应用。近年来研究人员采取了酶工程的策略对氟化酶进行优化,通过定向进化与理性设计提高了氟化酶的稳定性和活性,并扩大了氟化酶的底物范围,使其可应用于非天然底物。

图3 S.cattleya中从5'-FDA到氟乙酸和4-氟苏氨酸的生物合成途径[30,36]Fig.3 Biosynthetic pathways for the production of fluoroacetate and 4-fluorthreonine from 5'-FDA in S.cattleya[30,36]

表1 不同来源的氟化酶动力学参数汇总Tab.1 The summary for the kinetic parameters of fluorinase from different sources
1.2.1 定向进化
定向进化是一种酶工程的常用策略,涉及到基因突变、表达和筛选等过程。实际实验过程中,需要对该过程不断地循环操作,才能得到优化的结果[43]。在这几种氟化酶中,来自Streptomycessp.MA37的氟化酶FlA1对SAM的催化效率最高。因此将FlA1作为研究的对象。研究表明,在一定条件下,氟化酶可以催化SAM的类似物发生反应。在L-甲硫氨酸存在的条件下,5'-ClDA可以在氟化酶的作用下,脱去氯离子,生成SAM,SAM再与氟离子作用生成5'-FDA(图4)。5'-ClDA易于合成且化学性质稳定,因此被选为研究氟化酶定向进化的底物。通过构建饱和突变库,从文库中进行高通量筛选,获得突变体fah2081和fah2114,可明显提高5'-FDA的产量。在L-甲硫氨酸的存在下,两种突变体催化得到的5'-FDA的产量分别比FlA1催化得到的5'-FDA产量高2.4倍和2.7倍,动力学研究表明,突变体主要通过提高第一步反应的kcat值来提高5'-FDA的产量。进一步探究其他实验条件对反应的影响,实验结果表明,对于所有氟化酶,在用L-硒代甲硫氨酸代替L-甲硫氨酸之后,5'-FDA的产量会提高2倍左右[30]。
为了将氟化酶应用于更多的底物中,研究者们还探究了氟化酶FlA1对底物特异性的分子决定因素。以5'-ClDA类似物作为反应底物,对FlA1的活性位点进行突变。用不同的取代基在5'-ClDA的C-2与C-6位置处发生取代,可得到一系列5'-ClDA的类似物,氟化酶对这些类似物的催化效果不同。例如以在C-2位置上发生氨基取代的类似物作为底物,氟化物产率可以提高。氟化酶FlA1在F213和A279残基上的修饰,可以提高对于几种不同底物的催化活性[44]。
1.2.2 底物特异性优化
之前的研究已经确定氟化酶在L-甲硫氨酸和氟离子的存在下,可以催化5'-氯-5'-脱氧腺苷(5'-ClDA)经中间产物SAM生成5'-FDA,因此研究者们考虑是否其他卤代脱氧腺苷类似物也可以作为氟化酶催化的底物。研究发现5'-ClDA、5'-溴-5'-脱氧腺苷(5'-BrDA)和5'-碘-5'-脱氧腺苷(5'-IDA)都可以作为氟化酶的作用底物,而且存在两种生成5'-FDA的方式:当只有氟离子存在而无L-甲硫氨酸时,卤代脱氧腺苷直接一步反应生成5'-FDA;当氟离子和L-甲硫氨酸都存在时,经中间体SAM生成5'-FDA。如果只存在L-甲硫氨酸而无氟离子时,卤代脱氧腺苷会脱去卤离子生成SAM,不会进行第二步反应[45]。比较两种情况下不同卤代物的反应速率和转化率:直接转化时,5'-BrDA的反应速率远大于5'-ClDA和5'-IDA,转化率为35%,而后两者的转化率仅为5%和8%。当L-甲硫氨酸和氟离子共同存在时,5'-ClDA的转化效率最高,5'-BrDA的初始反应速率略微加快,而5'-IDA的转化率和反应速率没有发生变化。进一步验证,当只有L-甲硫氨酸存在而无氟离子时,比较三者转化为SAM的效率,氯化合物最优,溴化合物其次,碘化合物几乎不转化[46]。以上结果表明两步反应可以有效提高5'-ClDA的转化效率,略微提高5'-BrDA的转化效率,对5'-IDA的转化效率几乎无影响。

图4 氟化酶催化5'-ClDA转化为5'-FDA的两步反应Fig.4 The two-step reaction from 5'-ClDA to 5'-FDA catalyzed by fluorinase
通过酶工程与潜在底物挖掘等方法可扩大氟化酶的底物范围。Sergeev等[47]研究了在标准反应条件下,氟化酶催化与SAM类似的非天然底物生成氟化物的反应,这些非天然底物C-5带有不同的离去基团,其中甲硫氨酸样离去基团可以扩大酶的底物特异性,相对更容易合成氟化物并对其进行化学修饰。虽然使用新底物放射性合成[18F]FDA的产量依然低于天然SAM底物,但对设计更适合用作氟化酶催化的底物提供了指导。Zhao等[48]证实氟化酶催化非天然底物5'-氯-5'-脱氧腺苷(5'-ClDA)生成5'-氟-5'-脱氧腺苷(5'-FDA)的限速步骤在于5'-ClDA到SAM的转化,从而通过引入氯化酶ClA1和ClA2提高该步反应的催化效率。由此开发了一种氯-氟联用酶系统,可实现5'-ClDA的高效转化,为氟化酶催化非天然底物提供了新思路。
1.2.3 添加自组装肽标记
可溶性酶溶解在水溶液中能够对水溶液体系中的反应起到有效的催化作用,但这样的酶稳定性不足,不易保存。为了解决这个问题,一些研究将设计好的多肽标签与酶蛋白融合,增强其稳定性,使其不溶于水,易于保存[49]。从微生物中发现的天然氟化酶稳定性不足是限制其应用的一个因素,因此对氟化酶添加自组装肽(SAP)标记可改善其性能。自组装肽是一种有特定序列的多聚肽的集合,可以自发地组装形成有序的纳米结构。将不同的SAP标记添加到FlA的C端,构建出三种SAP标记的氟化酶聚集体(FLA-ELK16、FLA-L6KD和FLA-18A),三者均不溶于水。标记后的三种氟化酶均能催化SAM生成5'-FDA。其中FLA-ELK16对反应的催化效率比FLA低,而FLAL6KD和FLA-18A的催化活性相比于FLA有了明显的提高。三种SAP标记的氟化酶能够自发地在水溶液中形成不同大小的纳米颗粒,酶热稳定性以及可再生性均有了一定的提高[50]。
1.3 氟化酶的应用
1.3.1 氟化酶催化合成含氟活性物质
有机氟化物在现代医药市场及生物活性物质的开发中具有重要的意义[51]。2011年至2016年1月31日,美国FDA共批准新药188个,其中含氟药物42个,占比达到了22.34%。含氟药物的治疗领域主要为抗肿瘤、抗感染、心血管系统疾病以及呼吸、神经系统疾病等,具有十分广阔的市场前景[52]。目前上市的含氟药物生产方式主要为化学合成,其中氟原子一般是以单个氟原子取代、二氟甲基取代或三氟甲基取代的形式存在[53]。采取有机化学方法合成含氟药物的主要瓶颈在于难以实现氟原子或三氟甲基基团的选择性引入,产品的收率、纯度一般不高,产品分离纯化困难,且目前许多含氟试剂较贵,生产成本高[54]。例如辉瑞公司研发的新分子实体药物克唑替尼(商品名Xalkori),是首个对间变性淋巴瘤进行靶向治疗的药物,其作用于间变性淋巴瘤激酶(ALK),其合成难点主要在于手性中间体(S)-1-(2,6-二氯-3-氟苯基)乙醇的不对称合成[55];还有适用于晚期非小细胞肺癌(NSCLC)患者一线治疗药物马来酸阿法替尼,其合成条件一般较为极端,且分离纯化困难[56]。氟化酶的发现为含氟化合物的合成提供了新的思路,氟化酶催化氟化物合成的方法可作为传统化学合成有机氟化物方法的重要补充,研究潜力深远。
当前已知的含氟天然产物较为稀少,大多由链霉菌产生。4-氟-L-苏氨酸是可对抗多种细菌的抗生素剂,是迄今为止发现的唯一一种天然的含氟氨基酸,其与氟乙酸都是链霉菌Streptomyces cattleya生物合成途径中产生的含氟天然产物[57-58]。核杀菌素是一种强效的含氟抗生素,是土壤链霉菌Streptomyces calvus产生的含氟天然产物,但其生物合成途径一直未被阐明。直到2015年,Zechel等[59]首次报告了一种与S.calvusATCC13382互补的bldA编码的Leu-tRNAUUA分子,可恢复S.calvus中核杀菌素的生成。核杀菌素生物合成基因的鉴定,有助于相关氟化酶的功能研究。
1.3.2 氟化酶催化形成18F—C键在正电子成像技术的应用
正电子发射计算机断层扫描(positron emission computed tomography,PET)技术,是核医学领域比较先进的临床检查影像技术。该技术通过用半衰期短的放射性核素18F等标记代谢必需的糖类、蛋白质、脂肪酸等物质来反映生命体的代谢活动,从而实现临床诊断[60]。18F对放射性药物(小分子有机化合物、肽、配体和蛋白质等)的标记具有最理想的半衰期,将18F引入药物分子可使其具有独特且多样的化学特性[61]。利用氟化酶催化18F—C键形成,实现对有机底物的放射性标记,是氟化酶应用较为广泛的一个方面。
氟化酶催化形成18F—C键可用于放射性标记肽的研究。O'Hagan等[62]设计了一种与癌症相关的单体环肽(cRGD)的两步放射标记方案:首先,氟化酶催化转卤反应生成[18F]-5'-fluoro-5'-deoxy-2-ethynyladenosine([18F]FDEA);随后,[18F]FDEA与cRGD肽发生反应,形成有效的放射性标记[63]。相同的转卤反应原理还被用于生成另一种[18F]RGD肽,该类肽与癌细胞相关的αvβ3整合素具有很高的亲和力。他们还通过底物适应性研究等扩大了氟化酶介导的转卤反应的底物范围,对该策略进行了扩展[64]。
氟化酶催化形成18F—C键可用于开发新的PET成像工具。O'Hagan等[65]利用一种催化转卤反应的氟化酶(5'-氟-5'-脱氧腺苷合成酶)放射性合成18F标记的类似物,产生了新的A2A腺苷受体激动剂,得到了一个有价值的、用于分析和诊断各种心肌和神经退行性疾病的PET成像工具。通过放射性合成[18F]FDA-PEG-biotin,开发了两种氟化酶介导的抗体预靶向工具[66];通过放射性合成[18F]FDA-PEG-GUL,将其与表达癌细胞的前列腺特异性膜抗原(PSMA)特异性结合,开发了新的PSMA诊断工具[67]。
1.3.3 氟化酶的异源表达
自然界中天然氟化物的量远少于其他天然卤化物,目前已经有许多生物化学的方法应用于天然氯化物、溴化物和碘化物的生物合成。但目前发现的氟化酶仅能催化一种反应,即将SAM和氟离子转化为5'-FDA。若想实现多种复杂氟化物的生成,在现有其他丰富卤化物的基础上,通过引入氟化酶基因,将产物中其他卤素原子替换为氟原子,从而实现多种氟化物的生成。
Salinispora tropica是一种海洋微生物,能够合成具有抗癌活性的salinosporamide A。合成该抗生素的过程中涉及到一步氯化反应。将S.cattleya中的氟化酶基因flA利用同源重组的方式替换掉S.tropica基因组中的氯化酶基因salL。在海水配制的培养基上进行突变菌株的培养,反应底物中的无机氟离子由氟化钾(KF)提供,生长对数期过后再添加KF,经一段时间发酵培养后,检测到有明显的fluorosalinosporamide A的生成[68]。这种策略通过对已存在的非氟卤化物的生物合成途径进行基因工程改造,将化合物中的卤原子替换为氟原子,扩大了生物合成氟化物种类的范围。虽然目前利用这种策略来合成氟化物的报道不多,但这种策略是以成熟且丰富的卤化物生物合成途径为基础,具有广阔的研究前景。
2 氟化物生物合成系统的构建
基因、启动子和终止子等生物元件是合成生物学中的“模块”[69]。将含氟模块引入生物合成途径是将合成生物学的思路引入有机氟化物的合成中,是含氟化合物生产的新思路。利用这种思路,可将氟原子的特性转移到具有复杂结构的天然产物中(如聚酮类、异戊二烯类、固醇类、生物碱类、类花生酸类物质、白细胞三烯类等),从而改善这些天然产物的功能[31]。
2.1 氟化聚酮类化合物生物合成系统的构建
聚酮合成酶(PKS)是在细菌体内构建复杂天然产物的组装线,在PKS多酶系统中,一个独立折叠的结构域可行使一个酶的活性,这些结构域再被分成不同的工作单元,即模块,每个模块为组装链引入一个结构单元,然后按顺序将被修饰的中间体交给下一个模块[70]。将含氟模块引入聚酮合成酶系统,可将氟原子引入天然产物的支架中,生成氟化聚酮,是复杂有机氟化物合成的重要补充策略。
研究人员以小分子的氟乙酸为原料构建含氟模块,再将此含氟模块纳入聚酮生物合成系统中,成功将氟原子引入到聚酮骨架中[71]。研究人员分别以氟乙酸、氟丙二酸为原料,用两步法和一步法在体外成功合成了含氟延伸模块——氟化丙二酰辅酶A,然后将氟化丙二酰辅酶A单体用于聚酮链延伸反应[图5(a)][72]。其中,两步法分别为复合乙酸激酶(AckA)-磷酸乙酰酶(Pta)和乙酰辅酶A羧化酶(ACCase)催化,一步法为丙二酰-CoA合成酶(MatB)催化。随后,他们构建了体外氟化聚酮合成系统[图5(b)]。在前期,他们将NphT7与PhaB两种酶耦合,以乙酰辅酶A作为起始单元、氟化丙二酰辅酶A作为延伸单元,构建了简单PKS系统,与丙二酰辅酶A作为延伸单元的不含氟系统相比,催化效率降低了5倍。之后,他们将这种策略应用于更复杂的合成红霉素前体的6-脱氧尿苷酸B合成酶(DEBS)PKS系统。以DEBS系统的第6个模块DEBSMod6+TE为研究对象,以天然N-乙酰半胱胺硫酯(NDK-SNAC)为底物,形成2-氟-2-去甲基三酮内酯(F-TKL)。研究者们进一步研究该系统合成含氟化合物的选择性,他们用一个由DEBSMod2和DEBSMod3+TE组成的微型PKS系统研究了氟原子的位点选择性引入,设计了从底物NDK-SNAC开始的的两个链延伸反应,通过对DEBS中的酰基转移酶结构域进行失活突变,证实了含氟延伸单体掺入的区域选择性。最后,他们在E.coliBAP1体内过表达DEBSMod6+TE和MatB,在氟丙二酸、CoA、ATP存在下,以NDK-SNAC为底物,氟化丙二酰CoA为延伸模块,合成了产物F-TKL,成功实现了在活细胞内的聚酮骨架中选择性地引入氟[31][图5(c)]。
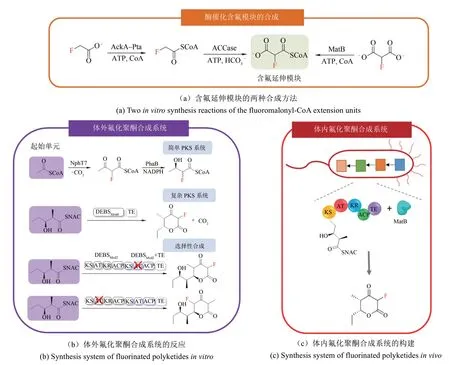
图5 氟化聚酮类化合物生物合成系统的构建Fig.5 Construction of fluorinated polyketide biosynthesis systems
Chang等[73]为深入了解酶的活性位点和代谢途径可如何被进一步改造以选择性生成含氟化合物,研究了能够生物合成有机氟化物的土壤链霉菌Streptomyces cattleya,并构建了用于生产含氟聚酮的酶系统和细胞途径。这项研究为设计工程化的有机氟化酶、通路和宿主提供了模板。他们还设计了一种用于有机氟代谢的微生物宿主,使其能够生产氟化二酮基2-氟-3-羟基丁酸盐,该产物的收率可达到理论收率的约50%。这种小分子氟化物可以作为一种单体,利用聚合酶在体内生产氟代聚羟基烷酸酯(PHA)生物塑料,引入的含氟单体量高达15%[74]。
除此之外,Chang等[75]还发现AT结构域的失活可消除对氟化聚酮类化合物生物合成系统中含氟扩展单元的选择性,并启动独立于ACP的C—C键形成模式。基于此他们对DEBS模块的反式AT互补进行了详细的研究,与天然甲基丙二酸单酰辅酶A扩展单元相比,以含氟单体为扩展单元形成C—C键的产率为43%。他们进一步构建了一种双模块mini-PKS系统,用两个顺序的AT0模块与DszAT互补,以插入两个含氟扩展单元,证明单氟和双氟产物可以由双模块系统以1:1的DEBS模块比例合成,DszAT互补使产量增加了约93倍。该研究通过将一个氟化单体与酶共价结合来完成一个标准的反应周期,在工程聚酮合成酶系统中选择性地引入氟,通过提高氟化扩增单元的产量生产多氟化聚酮,提出了利用化学酶法合成和靶向生产复杂含氟结构的新策略。
2.2 其他含氟生物合成系统
除了利用含氟模块将氟引入聚酮合成酶系统中得到含氟化合物的方法,研究人员也在开发其他新颖的方法得到有价值的含氟有机物。Oberlies等[76]利用木霉Trichoderma arundinaceum的生物合成机制,采用前体导向的生物合成方法,将氟原子选择性插入肽类天然产物骨架中。他们选择Pheol20作为前体,将菌株MSX70741在含有邻氟苯丙氨酸和间氟苯丙氨酸的培养基中发酵,在野生型菌株体内合成了两种新的含氟阿来米星F50衍生物。Chang等[77]研究发现Ⅱ型HpcH醛缩酶家族可有效地催化氟丙酮酸引入不同的具有高度立体选择性的醛中,经过一系列立体化学和理论计算分析,他们将醛缩酶用于具有高立体纯度的新型氟酸(酯)衍生物的化学-酶合成方法中。通过掺入氟丙酮酸模块所获得的化合物可以作为多功能底物,利用酶和化学手段进行下游加工,从而得到一系列新化合物,成为合成糖类、氨基酸及其他有价值的手性氟化类似物的前体。Arnold等[78]使用定向进化的方法设计了细胞色素P450酶,使其能够高效、高对映选择性地催化C—H氟烷基化反应。通过对含α-氨基C(sp3)—H键底物的直接氟烷基化,在底物结构中不对称地引入了三氟乙基或五氟丙基。该反应总催化转化活性高达4070TTN,对映体过量(ee)高达99%。
3 结语与展望
氟在药物设计及生物活性物质的开发中具有重要的意义,将氟引入化合物分子可以有效地影响化合物的分子构象、pKA、内在效力、膜通透性、代谢途径和药代动力学特性等[79]。通过化学手段合成含氟化合物的条件通常较为苛刻,且合成复杂结构困难,难以实现选择性氟化,因此,利用合成生物学手段合成含氟化合物是含氟化合物生产的新方向。
含氟化合物生物合成策略主要有两种:一是利用氟化酶催化C—F键形成得到含氟有机物;二是利用含氟构建模块将氟引入复杂天然产物的骨架中。至今,野生型氟化酶发现的种类极少,因此发掘新型氟化酶以及通过定向进化、理性设计的方法对现有天然氟化酶进行改造,是氟化酶研究的重要方向;在构建含氟系统方面,将含氟构建块创造性引入复杂天然产物生物合成路径(如聚酮、长链肽类等),并控制其插入的特异性及可能产生的毒性,是将氟引入有价值天然产物值得关注的手段。
