肿瘤倍增时间在非小细胞肺癌患者预后评价中的作用
2020-10-09赵方超王增颖林韬
赵方超,王增颖,林韬
(1.华北理工大学附属唐山市人民医院 胸外科,河北 唐山 063001;2.华北理工大学临床医学院,河北 唐山 063015)
肿瘤倍增时间(tumor doubling time,TDT)指肿瘤细胞体积增加一倍所需的时间,是反映肿瘤生长特征的重要指标[1]。在世界范围内,肺癌是最致命的恶性肿瘤之一。有国内外文献报道关注肺癌的TDT,认为TDT 是肺癌患者一个独立且重要的预后因素[2-3]。这些研究使用CT 扫描发现,TDT 与肺癌预后之间存在关联,较长的TDT 通常有较好的预后。此外,有研究结果证实[4],使用TDT 检测肺癌具有高敏感性和特异性。因此,使用TDT 作为肺癌的预后指标已逐渐被临床医生接受。本研究旨在确定TDT 是否与接受手术切除的非小细胞肺癌(non-small cell lung carcinoma,NSCLC)患者的预后有关,并分析TDT 与NSCLC 患者预后的关系,探究其在患者预后评价中的作用。
1 资料与方法
1.1 一般资料
选取2012年1月—2014年5月华北理工大学附属唐山市人民医院行手术治疗的NSCLC 患者569 例作为研究对象。其中排除行楔形切除术129 例,术前行化疗和/或放疗10 例,术前2 个月内胸部薄层CT扫描<2 次49 例,肿瘤大小因肿瘤与周围脏器界限不清,肿瘤周围的炎症改变或阻塞性肺炎而无法评估的患者74 例,病例资料及随访结果不完整37 例,非肿瘤原因引起死亡23 例,对剩余的247 例患者进行回顾,并通过胸部薄层CT 扫描计算肿瘤的TDT。纳入的患者中,148 例TDT<400 d(TDT<400 d 组),99 例(包括无限TDT 患者)TDT ≥400 d(TDT ≥400 d 组)。收集临床病理学资料,包括年龄、性别、吸烟史、血清癌胚抗原(carcinoembryonic antigen,CEA)、肿瘤部位、组织学类型、分化程度及肿瘤密度。
1.2 测量和计算
所有CT 扫描通过本院影像科薄层CT(1.25 mm厚切片)进行。使用具体设置(WL:-700 HU 和WW:1 500 HU)的肺野窗口中的软件程序的卡尺工具测量所有肿瘤。所有肿瘤直径由2 位5年以上经验的胸外科医生测量,取平均测量值。如果数据差异超过2 cm,则再次检查和测量图像。测量最大肿瘤直径和最大垂直肿瘤直径(见图1)。使用Schwartz 公式计算肿瘤的TDT[5]。
肿瘤体积(V)=π/6×ab2
肿瘤倍增时间(TDT)=(t×log2)/log(Vt/V0)

图1 最大肿瘤直径和最大垂直肿瘤直径测量示意图
其中,a=最大肿瘤直径;b=最大垂直肿瘤直径;t=2 次测量的间隔时间;Vt=最近扫描的肿瘤体积;V0=初始扫描的肿瘤体积。
根据先前的研究[4],TDT 截止值设定为400 d,其中TDT<400 d 为快速生长,TDT ≥400 d 为缓慢生长。如果TDT 计算值为无穷大,则意味着尺寸在2 个月内无变化,该类患者被划分到TDT ≥400 d 组。
1.3 随访
所有患者在手术后5年内每6 个月就诊1 次,评估包括CEA 在内的肿瘤标志物,并进行胸部CT 检查。脑磁共振成像(magnetic resonance imaging,MRI)每年进行1 次。截至2019年5月,所有患者完全随访。总生存期(overall survival,OS)定义为从手术到死亡或最近随访日期,无复发生存期(recurrence free survival,RFS)定义为从手术到复发或非肺癌相关死亡的时间。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用独立样本t检验;计数资料以例(%)表示,比较采用χ2检验;使用Kaplan-Meier 方法绘制生存曲线,采用Log-rank χ2检验进行比较。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者的临床病理特征比较
TDT<400 d 组患者的肿瘤直径、分化程度和肿瘤密度与TDT ≥400d 组比较,差异有统计学意义(P<0.05),TDT<400d 组肿瘤直径>3cm、低分化和实性密度肿瘤患者比例高于TDT ≥400d 组。TDT ≥400d 组患者的性别构成比、吸烟史和组织学类型与TDT<400d 组比较,差异有统计学意义(P<0.05),TDT ≥400d 组无吸烟史和腺癌患者的比例高于TDT<400d 组。两组的年龄、血清CEA、肿瘤部位比较,差异无统计学意义(P>0.05)。见表1。
2.2 TDT 与OS 之间的关系
通过Kaplan-Meier 方法绘制的生存曲线发现,TDT ≥400d 组的OS 优于TDT<400d 组(χ2=9.515,P=0.000)。见图2。
2.3 TDT 与RFS 之间的关系
通过Kaplan-Meier 方法绘制的生存曲线发现,TDT ≥400d 组的RFS 优于TDT<400d 组(χ2=1.509,P=0.000)。见图3。
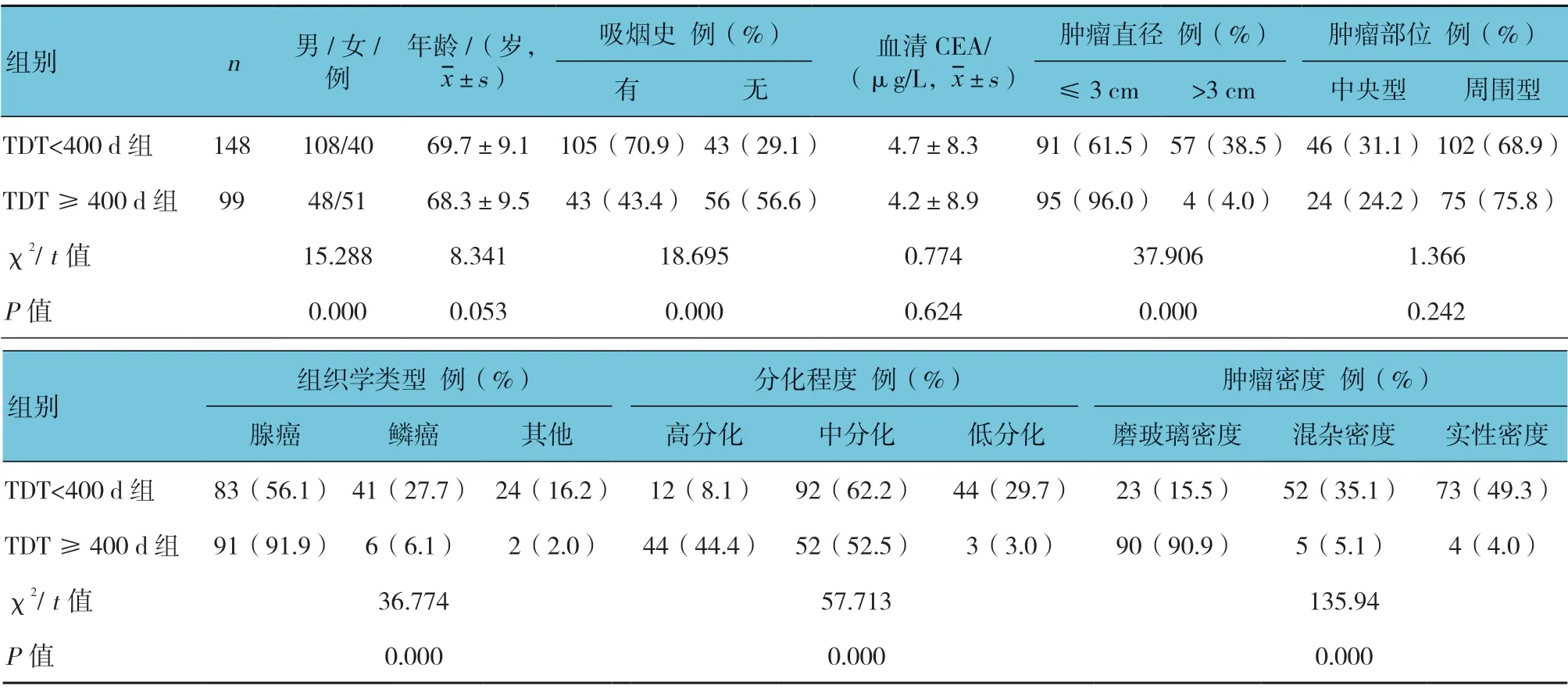
表1 两组患者的临床病理特征比较
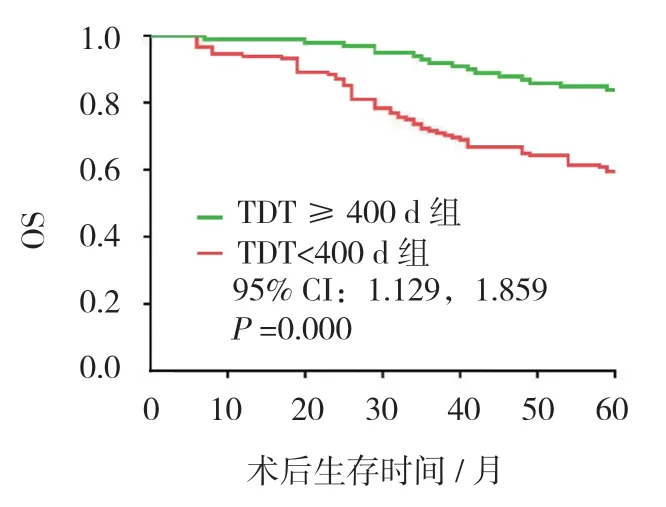
图2 TDT 与OS 关系曲线
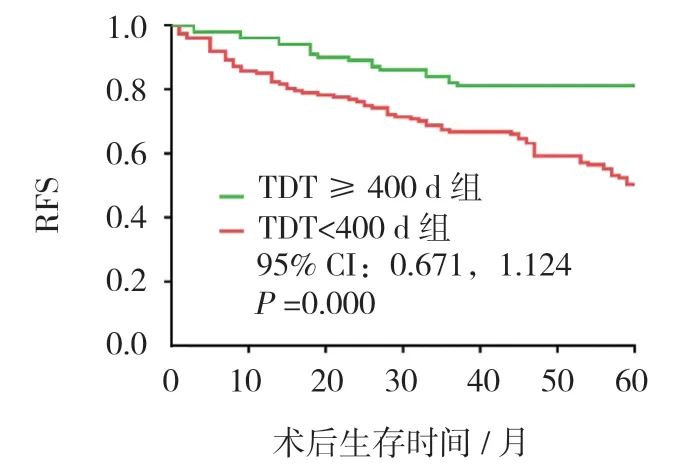
图3 TDT 与RFS 关系曲线
3 讨论
肺TDT 的长短与其病理生长特点、组织学类型、分化程度等因素直接相关[6-7]。MIURA 等[8]发现,肺腺癌较鳞癌、小细胞肺癌等组织类型的TDT 较长;分化好的肺癌的TDT 较分化差或未分化的肺癌的长;肿瘤呈实体性生长的TDT 较伏壁式生长的短。本研究结果显示,TDT<400d 组中肿瘤直径>3cm、低分化和实性密度肿瘤患者的比例高于TDT ≥400d组。TDT ≥400d 组无吸烟史和腺癌患者的比例高于TDT<400d 组。表明吸烟、肿瘤直径>3cm、鳞癌、低分化及实性密度肿瘤患者TDT 更短。
研究表明,较短的TDT 与肿瘤恶性和预后不良有关[9]。例如,据JEONG 等[10]报道,胸腺上皮肿瘤较短的TDT 与侵袭性组织学表型呈负相关。KIM 等[11]报道,肝细胞肿瘤体积的TDT 与肝功能、生存率下降及复发率上升有关,肝细胞肿瘤体积的TDT 可以作为肝细胞癌患者的动态预后标志物。KOIZUMI 等[12]研究表明,较高风险等级的平滑肌瘤和神经鞘瘤较低风险等级的TDT 更短,预后更差。文献报道[13],TDT 为400d 是区分惰性和恶性病变的最佳临界值,TDT 可能是区分侵袭性和慢性癌症的关键参数。本研究结果显示,TDT ≥400d 组的OS 和RFS 均优于TDT<400d 组。以上结果提示,长TDT(≥400d)的患者比短TDT(<400d)的患者具有更长的RFS 和OS,总体预后更好。表明TDT 值能作为评估NSCLC预后的独立风险因素。
这项研究有几个局限性。首先,排除在手术前未进行2 次薄层CT 扫描的患者49 例。此外,排除因肿瘤或肺腔周围的炎症改变或阻塞性肺炎而无法评估的患者74 例。这些无法测量的患者往往患有晚期疾病,对其的排除可能会影响结果。因此,存在引入选择偏差的可能性。其次,本研究的样本量相对较少。最后,2 位胸外科医生进行放射学评估,虽然是在放射科医师的指导下进行,但可能存在轻微的测量误差。
