马铃薯卷叶病毒RT-LAMP检测方法的建立
2020-10-09高彦萍吕和平王国祥吴雁斌梁宏杰
高彦萍 吕和平 张 武 王国祥 吴雁斌 梁宏杰
(1甘肃省农业科学院马铃薯研究所,甘肃 兰州 730070;2甘肃省农业科学院中药材研究所,甘肃 兰州 730070;3甘肃省马铃薯脱毒种薯(种苗)病毒检测及安全评价工程技术研究中心,甘肃 兰州 730070)
中国是全世界马铃薯(Solanum tuberosum)种植面积最大的国家,占全球种植面积的20%以上,但平均单产只有13.99 t·hm-2,比世界平均水平(16.07 t·hm-2) 低12.94%,病毒病是引起我国马铃薯低产的主要原因。马铃薯卷叶病毒(potato leafroll virus,PLRV)是目前严重影响马铃薯产量与品质的主要病毒之一[1-4]。病毒检测是马铃薯病毒病害诊断、测报、防治和脱毒种薯(苗)培育等过程中的一个重要环节。目前,PLRV 检测方法主要有酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)[5-6]、普通反转录酶-聚合酶链锁反应(reverse transcriptionpolymerase chain reaction,RT-PCR)[7-8]、多重 RTPCR[9-10]、实时逆转录PCR(real-time RT-PCR)[11-12]以及基因芯片的DNA 微点阵等。ELISA 法虽然高通量,但程序不简便、灵敏度较低,存在假阳性;而RTPCR、多重RT-PCR 和real-time RT-PCR 核酸检测技术虽然具有灵敏度和特异性高以及多同步性等优点,但仪器昂贵、成本高、耗时长,且存在技术难度问题,仅局限于实验室检测,难于在生产实际中推广应用。Notomi 等[13]建立的环介导等温核酸扩增(loopmediated isothermal amplification,LAMP)技术,是一种针对靶基因的6 个特定区域设计4 对特异性引物,利用DNA 链置换聚合酶,在恒温(60~65℃左右)条件下快速对靶基因进行扩增的新型分子检测技术,具有特异性强、灵敏度高、操作简单、快速且适合于多种检测环境等优点,已被广泛应用于许多领域的基因检测[14-17]。RT-LAMP 技术在植物病毒检测方面的应用亦有报道,表现出简便、快捷、准确的特点[18-19]。关于PLRV 的RT-LAMP 检测方法已有研究报道,如采用浊度测定方法判读扩增结果[20],但未进行特异性、灵敏性和田间样品验证等[21-22]深入研究,导致在生产中鲜见应用RT-LAMP 检测PLRV。因此,本研究建立PLRV 的RT-LAMP 检测方法,优化并验证检测体系,以期为该病害的快速诊断、检疫和制定防治措施等提供更好的技术支持。
1 材料与方法
1.1 材料
1.1.1 生物材料 本试验所用PLRV、马铃薯X 病毒(potato virus X,PVX)、马铃薯Y 病毒(potato virus Y,PVY)、马铃薯S 病毒(potato virus S,PVS)、马铃薯A病毒(potato virus A,PVA)和马铃薯M 病毒(potato virus M,PVM)等的阳性样品、阴性对照是甘肃省马铃薯脱毒种薯(种苗)病毒检测及安全评价工程技术研究中心实验室保存的离体组培苗;田间马铃薯样本为采自甘肃省马铃薯主产区的表观健康和具有花叶、卷叶症状的植株叶片。
1.1.2 主要试剂 植物总 RNA 提取试剂盒(RNAprep Pure Plant Kit,DP432)购自天根生化科技(北京)有限公司;RNA 酶抑制剂(RNasin Ribonuclease inhibitor)、M- MLV反转录酶(M-MLV Reverse Transcriptase)、重组Taq DNA聚合酶(rTaq DNA polymerase)、UNG 酶(uracil-N-glycosylase,UNG)、MgSO4、dNTP Mix 等购自日本TaKaRa 公司;Bst 3.0 DNA Polymerase 购自美国New England Biolabs 公司;甜菜碱(Betaine)、SYBR Green Ι 等购自北京索莱宝科技有限公司;焦炭酸二乙酯(diethypyrocarbonate,DEPC)购自美国Vetec 公司;GeneFinder TM 购自厦门致善生物科技股份有限公司; 硝基四氮唑蓝(nitrotetrazolium blue chloride,NBT)、琼脂糖等购自美国Promega 公司;DAS-ELISA 试剂盒购自美国Agdia公司。
1.1.3 主要仪器与设备 VORTEX-GENIE2/2T 漩涡混匀仪,美国Spectral Instruments 公司;iCEN-24 台式高速离心机,杭州奥盛仪器有限公司;君意-JY600C 电泳仪,北京君意东方电泳设备有限公司;Tanon-3500R琼脂凝胶成像系统,上海天能科技有限公司;Nano Drop 2000 Spectrophotometer,美国 Thermo Fisher Scientific 公司;T100TmThermal Cycler,美国Bio-Rad 公司;WHJ1 512d 智能控温电热水壶,美的集团有限公司;SHA-C 型数显水浴恒温器,常州蒙特环境科技有限公司;11SC-1 笔式紫外灯,美国Spectronics 公司。
1.2 试验方法
1.2.1 病毒RNA 提取 1)参照植物总RNA 提取试剂盒的步骤提取病毒RNA。测定抽提的病毒RNA 总浓度后于-80℃保存备用。2)病毒粒子直接吸附法(virion-direct absorbent,VDA)提取病毒RNA,参考杜志游[23]的方法进行即时提取。
1.2.2 引物设计和合成 根据GenBank 公布的PLRVCP基因序列(AY307123.1),选择保守区域ORF3 为靶标基因,利用Primer Explorer 4.0 软件(http:/ /primerexplorer.jp/elamp 4.0)在其6 个位点设计了多组RT-LAMP 引物;并结合Ju[20]和Ahmadi等[21]采用的2 组引物,经多次试验筛选出扩增效率最高的Pb 组引物(表1),用于RT-LAMP 检测。RTPCR 检测方法引用SN/T 2627-2010[24]中的引物序列(表2)。所有引物均由生工生物工程(上海)股份有限公司合成。

表1 PLRV RT-LAMP 检测引物Table1 Primers for PLRV detection by RT-LAMP
1.2.3 RT-LAMP 反应体系 根据已报道的RTLAMP 反应条件[25-26]确立初步反应体系,然后采取单因素试验,筛选引物组、引物比例与浓度、反应温度、反应时间,以及Mg2+、Betaine、Bst 3.0 DNA 聚合酶、dNTPs、UNG、SYBR Green Ι 浓度的多因素水平,最终反应体系参考文献[27]。
1.2.4 特异性验证 PLRV、PVX、PVY、PVS、PVM 和PVA 是马铃薯生产田中发生率较高、危害较严重的6 种主要病毒[1-2],国家马铃薯种薯标准[5]规定必须检测这6 种病毒。利用优化的RT-LAMP 反应体系对复合感染上述6 种马铃薯主要病毒的阳性样品进行检测,反应结束后,取RT-LAMP 扩增产物5 μL 用2%琼脂糖凝胶电泳分析;同时,另取扩增产物加入1 μL 1 000× SYBR GreenⅠ,振荡混匀,直接目视观察结果,或加入1 μL 50× SYBR GreenⅠ,振荡混匀,紫外线下观察结果。采用RT-PCR 检测方法进行平行比对验证,RT-PCR 检测按照标准SN/T 2627-2010[24]的改进方法进行。RT-PCR 扩增产物采用琼脂糖凝胶电泳分析。

表2 PLRV RT-PCR 检测引物Table2 Primers for PLRV detection by RT-PCR
1.2.5 RT-LAMP 灵敏度检测 用无RNA 酶的水对阳性样品RNA 模板进行10 倍梯度稀释,制成100~108倍的9 个稀释梯度,对不同稀释梯度RNA 模板分别进行RT-LAMP 和RT-PCR 检测,比对二者的检测灵敏度。RT-LAMP 和RT-PCR 检测方法同1.2.4。
1.2.6 田间样品检测验证 为检验该技术在生产中应用的可行性,田间采集表观健康和具有花叶、卷叶症状的疑似病毒病的马铃薯植株叶片样本90 个,应用ELISA、RT-PCR 和RT-LAMP 3 种方法进行检测。每种方法设置阳性对照和阴性对照。待检测样本RNA采用VDA 法提取[23]。利用数显水浴恒温器和智能控温电热水壶提供反应所需的62℃恒温条件。ELISA按照GB 18133-2000[5]进行,RT-PCR 和RT-LAMP 检测方法同1.2.4。
2 结果与分析
2.1 RT-LAMP 体系的建立
应用本研究建立的RT-LAMP 反应体系扩增PLRV,能产生LAMP 产物特殊的阶梯状条带,而空白对照和阴性对照不产生条带,RT-LAMP 检测结果与RT-PCR 一致(图1-A、B)。RT-LAMP 反应产物中加入高浓度(1 000×)SYBR Green Ι 后,阳性样品颜色变为绿色,阴性对照颜色为褐色(图1-C),加入低浓度(50×)SYBR Green Ι 后,紫外线下(笔式紫外灯)阳性样品发出强荧光,阴性对照不发荧光(图1-D)。因此,RT-LAMP 检测可通过肉眼观察直接判断结果,较RT-PCR 简单容易。

图1 PLRV RT-LAMP 检测体系Fig.1 Detection system for PLRV by RT-LAMP
2.2 特异性验证
PLRV 阳性对照和已知感染PLRV 的复合感染样品(2~6 泳道)经RT-LAMP 检测均显示阳性,阴性对照和未感染PLRV 但复合感染其他种类病毒的样品(7和8 泳道)均显示阴性,表明该方法与其他5 种马铃薯主要病毒(PVX、PVY、PVS、PVA 和PVM)不发生交叉反应,只特异性扩增PLRV。可视化判读,PLRV 阳性样本反应液颜色变为绿色,显示为阳性,而阴性和未感染PLRV 的样本反应液颜色为褐色,显示为阴性;紫外线下有着相同的判读结果(图2)。可见,建立的RTLAMP 体系对PLRV 检测具有特异性。

图2 RT-LAMP 特异性检测Fig.2 Specificity of detection system for PLRV by RT-LAMP
2.3 灵敏度检测
灵敏度检测结果显示,RT-LAMP 可检测到104倍的稀释PLRV 阳性RNA 模板(2~6 泳道),而常规RTPCR 只能检测到102倍的PLRV 阳性RNA 稀释模板(2~4 泳道),表明RT-LAMP 灵敏度是RT-PCR 的102倍(图3)。经计算RT-LAMP 技术可检测的最小RNA浓度为5×10-3ng·μL-1。RT-LAMP 产物中添加SYBR GreenⅠ染料后,阴性对照为褐色,阳性样品呈绿色,且随着PLRV 阳性样品RNA 稀释倍数的增加颜色变得不易区分,但在紫外线下很容易辨别(图3-C、D)。因此,可利用紫外照射提高可视化判读的可靠性。

图3 RT-LAMP 和RT-PCR 检测PLRV 灵敏度对比结果Fig.3 Comparison of sensitivity of RT-LAMP and RT-PCR for the detection of PLRV
2.4 田间样品检测验证
应用ELISA、RT-PCR 和RT-LAMP 3 种检测方法对田间采集的90 个样本进行检测。结果表明,ELISA检测出30 个PLRV 阳性样品(图4),RT-LAMP 和RTPCR 均检测出28 个PLRV 阳性样品(包含在ELISA检出的30 个阳性样品中),二者检测方法结果一致,符合率为100%(图5-A、B,结果未全部显示)。采用上述3 种检测方法对ELISA 多检出的2 个阳性样品进行复检,结果3 种检测方法一致判定为阴性,可见,ELISA 检测有时存在个别的假阳性误判。样品2、10、11 和17 在RT-PCR 检测中电泳条带比较弱,而在RTLAMP 检测中电泳条带明显,说明RT-LAMP 方法较RT-PCR 具有较高的灵敏度。可视化颜色变化结果与电泳检测结果对应一致(图5-C)。此外,利用数显水浴恒温器和智能控温电热水壶替代PCR 仪控温,能够达到该技术对恒温的要求。因此,本研究建立的RTLAMP 技术可应用于田间样品快速、准确的检测与诊断。
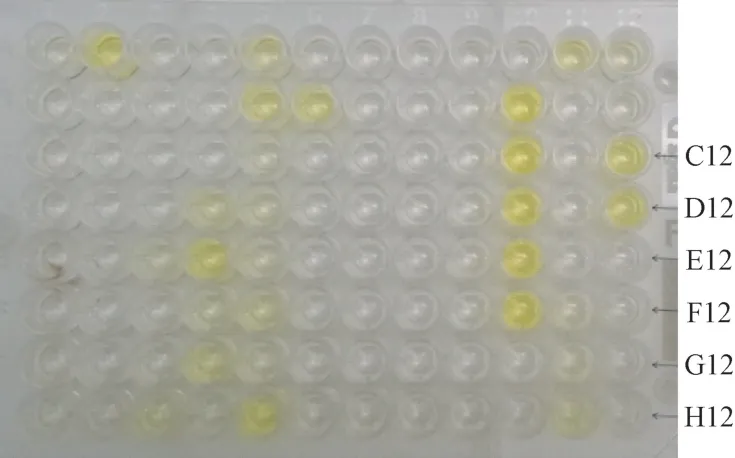
图4 90 个田间样品PLRV 的ELISA 检测结果Fig.4 The result of PLRV detection of ninty field samples by ELISA

图5 田间样品PLRV 的RT-PCR 和RT-LAMP 检测结果Fig.5 PLRV detection of field samples by RT-PCR and RT-LAMP
3 讨论
设计引物和筛选合适的引物是建立稳定RTLAMP 反应体系的关键。前期研究引用文献引物2套[20-21],结果发现这2 套引物扩增不稳定,可能是引物的识别、匹配和定位限制因素以及反应体系的稳定性造成的[13],也可能是因为缺少环引物加速,扩增效率相对较低。为了获得快速、高效、准确、稳定的检测PLRV 的RT-LAMP 反应体系,选择PLRVCP基因保守序列ORF3,针对6 个不同区域片段设计6 条引物,共设计了8 组引物,经多次反复试验,筛选新设计的Pb 组引物,该组引物扩增效率高特异性强,在62℃恒温下扩增50 min,扩增结束后可视化判读样品是否感染PLRV。
可通过比较检测目的病毒特异性扩增,而非目的病毒不扩增的方法进行RT-LAMP 检测技术的特异性验证。王永江等[25]利用常见的柑橘碎叶病毒、柑橘裂皮病毒、柑橘黄龙病毒和柑橘溃疡病毒的阳性样品,对建立的柑橘衰退病毒(citrus tristeza virus,CTV) RTLAMP 检测方法的特异性进行验证,结果证实该方法对CTV 检测具有特异性;张永江等[26]以同样侵染葡萄的沙地葡萄茎痘病毒、葡萄卷叶病毒、葡萄斑点病毒对葡萄A 病毒(grapevine virusa,GVA) RT-LAMP 方法的特异性进行验证,得出所建立的GVA RT-LAMP方法对CTV 检测具有特异性。本研究采用PLRV 与PVX、PVY、PVS、PVA 和PVM 等5 种主要马铃薯病毒交叉复合感染的阳性样品进行检测,结果表明,建立的PLRV RT-LAMP 检测方法,不与PVX、PVY、PVS、PVM和PVA 等病毒核酸发生交叉反应,具有很好的特异性。可视化结果判读,SYBR Green Ι 阴性与阳性颜色对比明显,特异性效果显著。
关于RT-LAMP 的灵敏度研究发现,LAMP 能从极低微量的拷贝中扩增出目的基因,较传统PCR 至少高出一个数量级[18]。本研究RT-LAMP 技术灵敏度是RT-PCR 技术灵敏度的100 倍,这与前人利用RTLAMP 技术检测柑橘衰退病毒[25]和草莓轻型黄边病毒[28]的研究结果相同。Le 等[29]和张永江[26]等利用该技术分别检测水稻条纹病毒RSV、葡萄A 病毒,其灵敏度均比RT-PCR 高10 倍。而周彤等[30]建立的水稻黑条矮缩病毒RT-LAMP 快速检测方法,可检测稀释104病毒样本RNA,灵敏度与RT-PCR 基本一致。RT-LAMP 技术的灵敏度在不同试验中差别较大,可能是由扩增效率造成。扩增效率与所用引物的质量和特性有关,如引物的长度、退火温度、GC 含量等都会影响引物的结合率和反应的扩增效率,还可能与反应体系中酶活性、化学组分及其浓度等有关[25]。
本研究基于LAMP 技术简便省时、特异性强、灵敏度高、设备简单、成本低廉以及结果可视化判读等优点,进一步简化了RT-LAMP 检测技术,使其应用更加简便。第一,病毒核酸提取技术简化。利用试剂盒提取病毒RNA,需要专业的操作技术。本研究尝试利用一种技术要求低、简单快速、可在基层简陋实验室完成操作的抽提马铃薯病毒RNA 的方法,即VAD 法,成功用于RT-PCR 和RT-LAMP 扩增检测和结果可视化判读。第二,使用便携式恒温控制设备。RT-LAMP 检测反应在恒温62℃左右进行,可用水浴锅或保温杯代替PCR 仪进行控温。本研究中田间样本RT-LAMP 检测试验,利用数显水浴恒温器和智能控温电热水壶控温,RT-LAMP 结果均与RT-PCR 对应一致,实现了简单电热设备替代PCR 仪满足该技术对恒温的要求。第三,在扩增产物可视化判读研究中,SYBE Green Ι 能结合到双链DNA 的小沟部位,引起明显的颜色变化,但肉眼判读须使用较高浓度SYBE Green Ι。本研究为降低成本,使用低浓度SYBR Green Ι,利用便携式笔式紫外灯照射,根据荧光强度变化进行结果判读。
4 结论
本研究建立的可视化PLRV RT-LAMP 检测方法,在62℃恒温下扩增50 min,扩增产物中加入SYBR Green Ι,阳性样品颜色变为绿色,阴性样品颜色仍为褐色,可直接目测判断待检测样品是否感染PLRV。该方法可检测到104倍的稀释PLRV 阳性RNA 模板,灵敏度是RT-PCR 的102倍。利用VAD 法提取PLRV RNA,成功实现PLRV RT-LAMP 扩增;利用数显水浴恒温器或智能控温电热水壶替代PCR 仪,完全满足RT-LAMP 恒温扩增的控温要求;利用便携式笔式紫外灯照射加强了可视化的结果判读,降低了SYBR Green Ι 用量,节约了成本。简便化的RT-LAMP 检测技术该方法,具有便捷、灵敏、特异、快速、成本低和技术要求低等优点,在实际检测中展示出良好的应用前景,可满足科研、基层单位对该病毒快速诊断和检测的需要。
