双季板栗休眠期至花期芽体或花序内源激素的变化
2020-09-30,
,
(广西大学 林学院,广西 南宁 530004)
板栗Castanea mollissima为壳斗科Fagaceae栗属Castanea植物[1],共有300 多个品种[2]。板栗经济价值较高,在我国栽培历史悠久[3],是我国重要的经济林树种之一。板栗果实营养丰富,可加工制作成多种食品[4],有“木本粮食”之称[5],是我国优良的坚果类树种之一[6]。
板栗雌雄异花同株,雌花少,雌雄花比例失衡严重影响板栗丰产[7-8]。板栗混合花序一般只着生于结果枝前端1 ~3 个芽,雌花着生于混合花序基部[6]。结果枝中部为纯雄花序,基部为叶芽。在一定条件下,板栗芽体可进行转化[9-10]。植物花芽分化时,受树体自身遗传特性、树龄、矿质营养元素、蛋白质、氨基酸、植物激素以及成花相关基因等内部因子,水、光照、温度等外界因子的共同影响[11]。
目前,已有较多关于板栗花芽形态解剖学[12-14]、营养学[15-17]、基因组学[18-19]、内源激素[20-24]等方面的研究报道,关于板栗花芽分化与内源激素相关性的研究鲜见报道。本文中研究了板栗休眠至花期间不同阶段结果母枝顶芽和结果枝基部叶芽、纯雄花序、混合花序内源激素含量的变化,旨在为人工调控板栗花芽分化和促进雌花形成提供理论参考。
1 材料与方法
1.1 试验地概况
试验林地位于广西壮族自治区南宁市隆安县古潭乡定军村(107°21′—108°6′E,22°51′—23°21′N)。该地区属于南亚热带季风气候,年平均气温21.7 ℃,年均降雨量1 310.1 mm,年均蒸发量1 652.5 mm,无霜期357 d[25];丘陵地貌,海拔90 ~100 m,土壤为赤红壤,土层厚度100 cm 以上,pH4.7。试验林地面积2.33 hm2,为当地主栽品种双季板栗,林龄17 a,郁闭度0.8,树高7 ~8 m,平均冠幅5 m×6 m,2月施肥管理。
1.2 试验方法
1.2.1 物候期调查
在阳光充沛地段选择5 株生长正常且树势基本一致的植株,每株分别选取东、西、南、北不同方位结果母枝及其抽生的结果枝各5 个,标记挂牌。实地观察物候变化,记录物候期。休眠期每隔30 d 观察1 次,休眠末期至萌动期每隔15 d观察1 次,萌动期至花期每隔3 ~5 d 观察1 次。
1.2.2 样品采集
2018年11月—2019年4月,选择生长正常且树势基本一致的植株作为采样植株,在选定植株树冠中上部、外围枝条上采集内源激素分析用样品。休眠期采集结果母枝顶部芽体(混合花芽),芽体萌动后采集结果枝芽体(分别采结果枝上部芽、中部芽和叶芽)或花序(在出现雄花序后,分别采集结果枝混合花序、纯雄花序和叶芽)。3 次重复采样,每次各取芽体(或花序)30 个,混合样品。采样时间及其间隔为:11月—翌年2月,每隔30 d 采1 次;2—3月(芽萌动前),每隔15 d采1 次;3—4月(芽开始萌动—结果枝停止生长),每隔3 ~5 d 采1 次。采集后,将样品擦拭干净,立即放入冰盒中带回实验室,分类置入液氮中速冻,然后置于-80 ℃超低温冰箱中保存。
1.2.3 内源激素含量测定
采用酶联免疫法测定内源激素ZR、IAA、GA3和ABA 的含量[26],分别以C(ZR)、C(IAA)、C(GA3)和C(ABA)表示。
2 结果与分析
2.1 双季板栗的物候期
在观察期内,双季板栗物候期分为休眠期、芽萌动期、展叶期、现雄期、现雌期。2018年11月20日—2019年3月10日为休眠期。2019年3月10日为临界点,芽开始萌动,变绿,略蓬松。2019年3月10—20日为芽萌动期。3月20日为临界点,开始抽梢,展新叶。3月20—25日为展叶期。3月25日为临界点,出现纯雄花序。3月25日—4月15日为现雄期。4月15日为临界点,出现雌花序。4月15日之后为现雌期。
2.2 休眠期双季板栗芽体内源激素的变化
2.2.1 内源激素含量的变化
休眠期双季板栗芽体内源激素的含量见表1。由表1可知,休眠期至芽体开始萌动,双季板栗芽体IAA 含量逐渐增加,在3月10日芽开始萌动时增至最大值,其含量为36.770 ng/g。在休眠期,双季板栗芽体GA3含量前期变幅较小,但3月10日显著上升。整个休眠期内,双季板栗芽体ABA含量显著高于其他激素含量,总体呈下降趋势,与ZR 含量均呈“降-升-降”的变化趋势。3月10日芽开始萌动时,双季板栗芽体IAA 含量极显著高于未萌动前,ABA 含量极显著低于未萌动前。2月25日双季板栗芽体IAA、ZR 和ABA 含量与12月25日相比均显著增加。
2.2.2 内源激素含量比值的变化
休眠期双季板栗芽体内源激素含量的比值见表2。由表2可知,休眠期至芽开始萌动,双季板栗芽体C(GA3)/C(IAA)值有规律下降;C(IAA)/C(ABA)值呈上升趋势,至3月10日芽萌动时,极显著上升。C(ZR)/C(IAA)值呈下降趋势,但无规律性。C(ZR)/C(ABA)和C(GA3)/C(ABA)值呈上升趋势,但无规律性。C(GA3)/C(ZR)值变化无规律性。
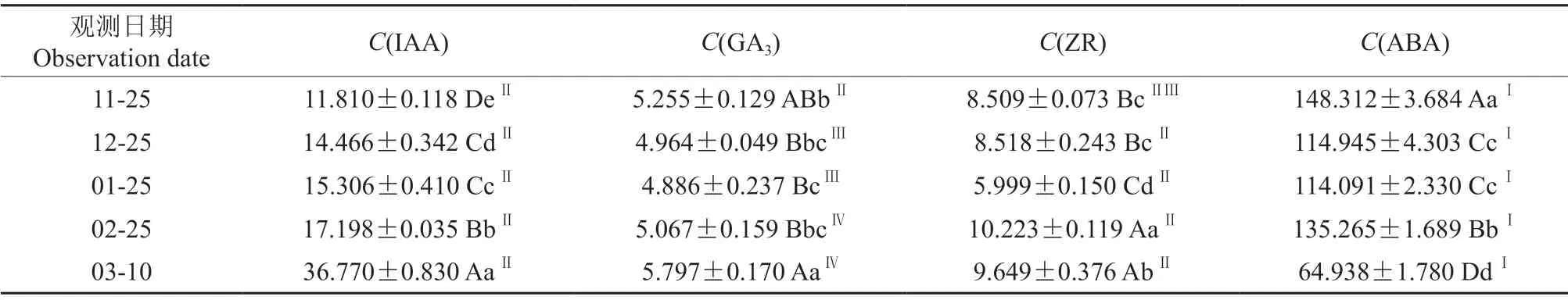
表1 休眠期双季板栗芽体内源激素的含量†Table1 Content of endogenous hormones in Shuangji chestnut bud during dormancy ng/g
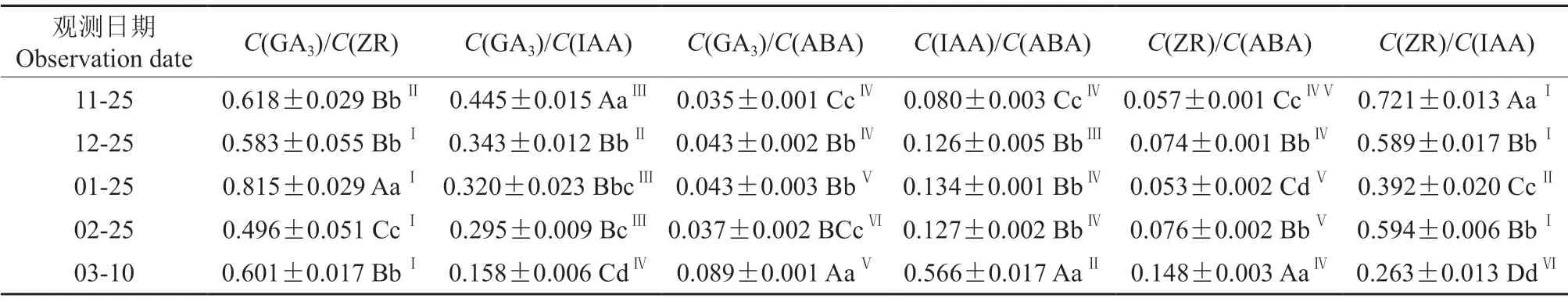
表2 休眠期双季板栗芽体内源激素含量的比值†Table2 Ratio of endogenous hormones in Shuangji chestnut bud during dormancy
2.3 萌动至花期双季板栗芽体或花序内源激素的变化
2.3.1 内源激素含量的变化
此时期主要以混合花芽萌动为起点,研究结果枝基部叶芽和花序各发育阶段内源激素含量的变化。双季板栗结果枝基部往上1 ~3 个芽为叶芽,第4 ~13 个芽发育为纯雄花序,第14 ~17 个芽发育为混合花序。3月10日为混合花芽刚萌动准备抽生结果枝时期,因此,混合花序、纯雄花序和结果枝基部叶芽均以刚萌动时的混合花芽各项指标为起点。各观测日期双季板栗混合花序、纯雄花序和结果枝基部叶芽内源激素含量见表3。
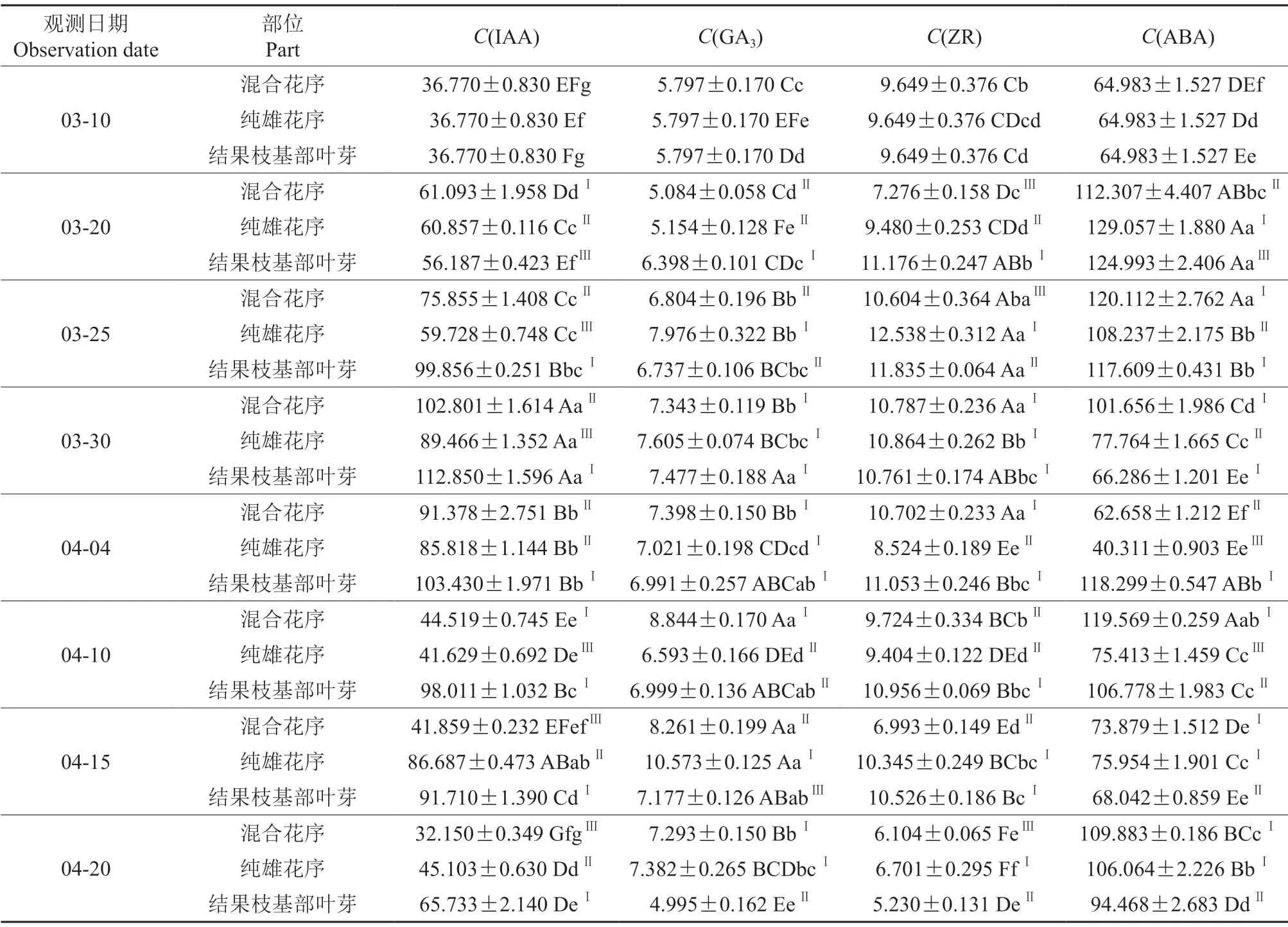
表3 萌动至花期双季板栗芽体或花序内源激素的含量†Table3 Content of endogenous hormones in bud or inflorescence of Shuangji chestnut during germination to flowering ng/g
2.3.1.1 混合花序内源激素含量的变化
由表3可知,混合花序IAA 含量先升、后降,呈抛物线变化。3月10—30日IAA 含量持续极显著上升,在3月30日升至最大值(102.801 ng/g);3月30日—4月10日IAA 含量极显著下降,然后开始缓慢下降,在4月20日降至最小值(32.150 ng/g)。
混合花序GA3含量5.084 ~8.884 ng/g。GA3含量变化无规律性,3月10—20日显著下降,降至研究期内最低点。随后开始上升,至3月25日极显著升高,3月25日—4月4日其含量无显著差异,4月4—10日又极显著上升,4月4—15日其含量无显著差异性,4月20日极显著下降。
混合花序ZR 含量5.230 ~10.787 ng/g。3月10日—4月4日ZR 含量变化与GA3含量变化相似,4月4日后其含量极显著下降。
混合花序ABA 含量62.658 ~120.112 ng/g,呈“升—降—升—降—升”波浪形变化。3月10—25日其含量持续上升,3月25日—4月4日急速下降,4月4—10日急速上升,4月10—15日急速下降,4月15—20日又急速上升。
2.3.1.2 纯雄花序内源激素含量的变化
由表3可知,纯雄花序IAA 含量先升、后降、再升、又降。其中,3月10—30日其含量持续上升,4月4—10日含量急剧下降,4月10—15日急剧上升,4月15—20日急剧下降。3月30日,IAA含量最高(89.466 ng/g),3月10日IAA 含量最低(36.770 ng/g)。
3月20—25日和4月10—15日,纯雄花序GA3含量极显著上升,4月15—20日急速下降,3月25日—4月10日缓慢下降。4月15日GA3含量达最大值(10.573 ng/g),3月20日其含量为最小值(5.154 ng/g)。
纯雄花序ZR 含量变化规律与GA3基本一致。3月20—25日和4月4—15日其含量显著上升,3月25日—4月4日和4月15—20日其含量极显著下降。3月25日ZR 含量达最大值(12.538 ng/g),4月20日ZR 含量为最小值(6.701 ng/g)。
纯雄花序ABA 含量呈“升—降—升”的趋势变化。3月10—20日其含量急速上升,3月20日—4月4日持续大幅下降,4月4—20日持续上升。3月20日ABA 含量达到最大值(9.057 ng/g),4月4日ABA 含量为最低(40.311 ng/g)。
2.3.1.3 结果枝基部叶芽内源激素含量的变化
由表3可知,结果枝基部叶芽IAA 含量先升、后降。3月10—30日其含量极显著上升,3月30日—4月20日显著下降,其含量最大值为112.850 ng/g,最小值为36.770 ng/g。
3月10—30日,结果枝基部叶芽GA3含量持续上升,3月30日—4月15日其含量趋于平缓,无显著差异,4月15—20日极显著下降。GA3含量最大值为7.477 ng/g,最小值为4.995 ng/g。
结果枝基部叶芽ZR 含量与GA3含量变化趋势一致。3月10—25日其含量显著上升,3月25—30日显著下降,后直至4月15日趋于平缓,无显著差异,4月15—20日其含量极显著下降。ZR 含量最大值为11.835 ng/g,最小值为5.230 ng/g。
结果枝基部叶芽ABA 含量呈“升—降—升—降—升”波浪形变化。3月10—20日、3月30日—4月4日和4月15—20日其含量极显著上升,3月20—30日和4月4—15日极显著下降。ABA含量最大值为124.993 ng/g,最小值为66.286 ng/g。
2.3.1.4 相同日期不同部位内源激素含量的比较
由表3可知,整个研究期内,混合花序、纯雄花序和结果枝基部叶芽的IAA 和ABA 含量均高于GA3和ZR 含量,在相同观测日期混合花序、纯雄花序和结果枝基部叶芽的IAA、GA3、ZR 和ABA 含量变化无规律性。
3月20日混合花序和纯雄花序IAA 含量与4月4日时的含量无显著差异。3月20日—4月4日混合花序IAA 含量高于纯雄花序,4月10—20日其含量低于纯雄花序。除3月20日外,叶芽IAA 含量显著高于其他部位,且整体变幅小于其他部位。各部位IAA 含量与休眠期相比大幅增加。
3月20日、3月30日、4月4日和4月10日,混合花序和纯雄花序GA3含量无显著差异。4月4—10日混合花序GA3含量高于纯雄花序,3月25—30日和4月15—20日其含量低于纯雄花序。
3月30日、4月10日混合花序和纯雄花序ZR 含量无显著差异。4月4日混合花序ZR 含量显著高于纯雄花序,其他日期其含量显著低于纯雄花序。纯雄花序和叶芽ZR 含量均比休眠期高。
4月15—20日混合花序和纯雄花序ABA 含量无显著差异。3月25日—4月15日混合花序ABA含量高于纯雄花序,3月20日反之。
2.3.2 内源激素含量比值的变化
各观测日期双季板栗混合花序、纯雄花序和结果枝基部叶芽内源激素含量的比值见表4。
由表4可知,双季板栗C(GA3)/C(ZR)值呈现阶段性变化的特点。混合花序C(GA3)/C(ZR)值前期变幅小,在0.6 ~0.8 区间变动,4月4—20日大幅上升,4月20日升至峰值1.969。其变化幅度大于纯雄花序,4月10—20日远高于其他部位比值。纯雄花序C(GA3)/C(ZR)值与混合花序变化趋势基本一致,总体呈上升趋势,4月20日达最大值1.102。基部叶芽C(GA3)/C(ZR)值整体变化幅度较小,趋于平缓。3 个部位C(GA3)/C(ZR)值在3月30日基本交叉重叠。
混合花序C(GA3)/C(IAA)值呈先降、后升的变化趋势。3月10—20日C(GA3)/C(IAA)值大幅下降,3月20日—4月4日变化相对平缓,4月4—10日急剧上升,而后波动上升。纯雄花序C(GA3)/C(IAA)值呈“降—升—降—升—降—升”变化趋势,最大值为0.164,最小值为0.082。基部叶芽C(GA3)/C(IAA)值至3月25日急剧下降后,整体变化幅度较小。混合花序和纯雄花序C(GA3)/C(IAA)值在3月25日—4月20日高于叶芽。纯雄花序C(GA3)/C(IAA)值在3月20日—4月4日大于混合花序(3月20日和4月4日比值无显著差异),4月10—20日反之。
混合花序、纯雄花序和基部叶芽C(GA3)/C(ABA)值在3月30日前均先降、后升。3月30日—4月4日,混合花序和纯雄花序C(GA3)/C(ABA)值持续上升,而基部叶芽该比值下降。4月10—20日各部位该比值呈先升、后降的变化趋势。纯雄花序C(GA3)/C(ABA)值变化幅度大于其他部位,除3月20日外,其他时期纯雄花序C(GA3)/C(ABA)值高于混合花序。
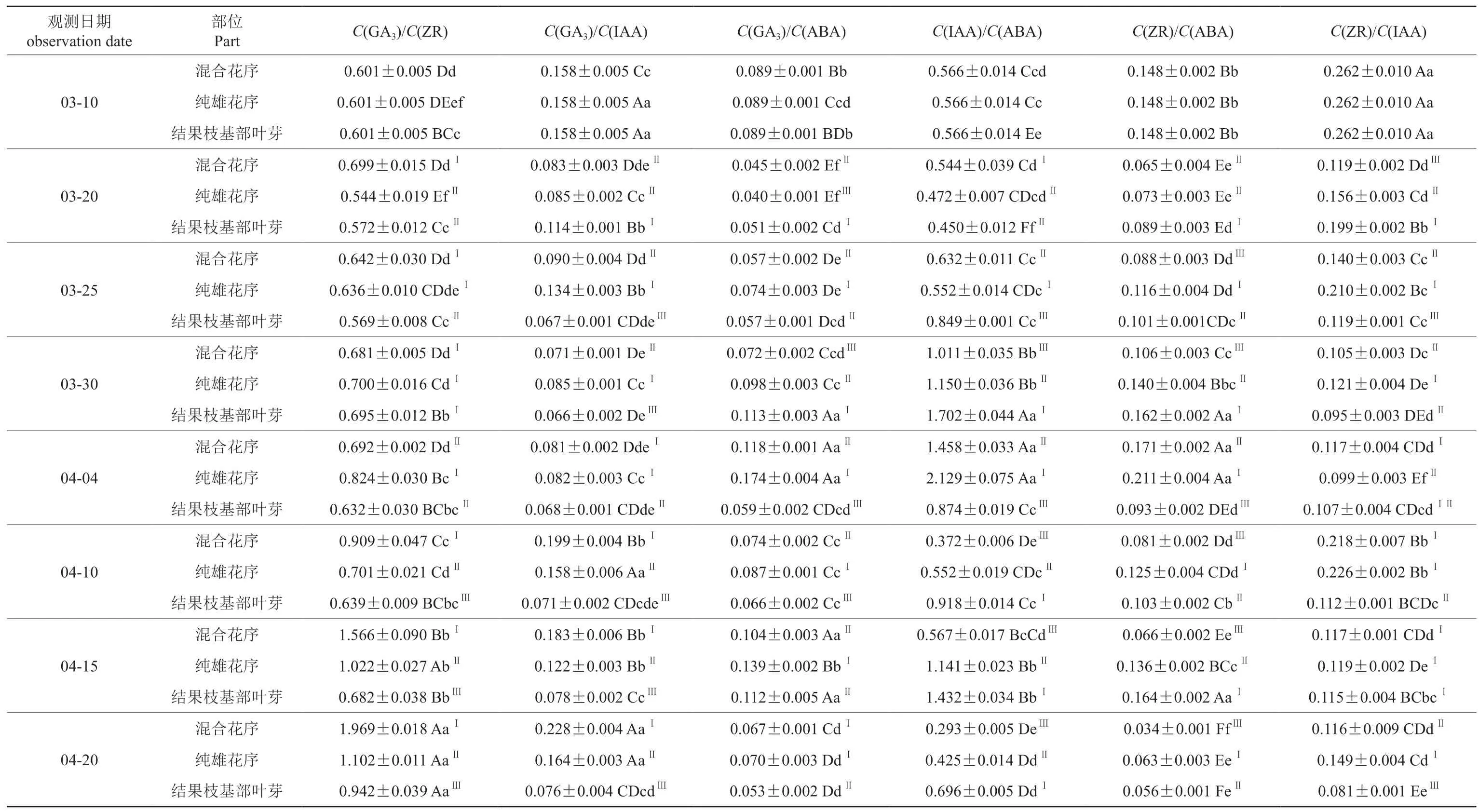
表4 萌动至花期双季板栗芽体或花序内源激素含量的比值†Table4 Ratio of endogenous hormone in bud or infolrescence of Shuangji chestnut during germination to folwering
各部位C(IAA)/C(ABA)值与纯雄花序C(GA3)/C(ABA)值变化趋势基本一致,呈不规则“M”型曲线,混合花序和纯雄花序C(IAA)/C(ABA)值于4月4日达到最高值,基部叶芽C(IAA)/C(ABA)值于3月30日达到最高值。
各部位C(ZR)/C(IAA)值总体呈下降趋势。混合花序和纯雄花序呈现较有规律的“降—升—降—升—降—升”的变化趋势,均在4月4—10日急速上升,在4月10—15日急剧下降。基部叶芽C(ZR)/C(IAA)值3月10—30日持续下降,而后趋于平缓,4月15日迅速下降。纯雄花序和混合花序C(ZR)/C(IAA)值在4月4—15日期间无显著差异,且除4月4日外,纯雄花序C(ZR)/C(IAA)值高于混合花序。
混合花序、纯雄花序和叶芽C(ZR)/C(ABA)值的变化趋势与C(GA3)/C(ABA)值和C(IAA)/C(ABA)值的变化趋势一致。4月4日混合花序和纯雄花序C(ZR)/C(ABA)值达最大值,分别为0.171和0.221;4月20日该值达最小值,分别为0.034和0.063。整个时期(除3月20日外),纯雄花序C(ZR)/C(ABA)值高于混合花序。
3 结论与讨论
本研究中着重探究双季板栗休眠期至花期(出现雌花序时)芽体或花序内源激素的变化,故采样时间至4月20日止。本研究结果表明,芽体萌动至花期,4 种内源激素(GA3、ZR、IAA、ABA)中,就单种激素而言均无特别的规律或结果显示其影响花性变化,而是内源激素种类及其比值共同作用影响板栗开花。各时期IAA 和ABA 含量均高于ZR 和GA3含量,C(GA3)/C(ZR)和C(IAA)/C(ABA)值均高于C(GA3)/C(IAA)、C(GA3)/C(ABA)、C(ZR)/C(ABA)和C(ZR)/C(IAA)值。混合花序和结果枝基部叶芽IAA 含量呈抛物线变化,纯雄花序IAA 含量呈不规则抛物线变化,混合花序IAA含量在现雄期至现雌期先升、后降,纯雄花序和结果枝基部叶芽IAA 含量呈无规律波动变化,各部位IAA 含量均于3月30日达到峰值,其中叶芽IAA 含量高于其他部位含量。高水平IAA 是否抑制叶芽生长,还应进行后期试验探究。各部位GA3含量和ZR 含量变化趋势相似,整体无明显变化规律,表现为无规律波动,ABA 含量整体呈波浪形趋势变化。混合花序各激素含量在现雄期至现雌期时而低于纯雄花序,时而高于纯雄花序。混合花序和纯雄花序的C(GA3)/C(ZR)和C(GA3)/C(IAA)值整体呈上升趋势,在现雄期至现雌期大幅上升,并表现为混合花序的C(GA3)/C(ZR)和C(GA3)/C(IAA)值高于纯雄花序;C(IAA)/C(ABA)和C(ZR)/C(ABA)值反之。结果枝基部叶芽、纯雄花序和混合花序的C(GA3)/C(ABA)、C(IAA)/C(ABA)和C(ZR)/C(ABA)值的变化规律非常相似,在开始出现纯雄花序后,纯雄花序的C(GA3)/C(ABA)、C(ZR)/C(ABA) 和C(IAA)/C(ABA) 值均高于混合花序;C(ZR)/C(IAA)值变化与其他指标值有不同规律。C(GA3)/C(ZR)、C(GA3)/C(ABA)、C(ZR)/C(ABA)和C(IAA)/C(ABA)值可能影响板栗的花性,高C(GA3)/C(ZR)值、低C(GA3)/C(ABA)值、低C(ZR)/C(ABA)值和低C(IAA)/C(ABA)值有利于雌花形成。
有研究报道表明,高ZR 含量可能对板栗冬前芽的花芽分化具有促进作用[24];高水平IAA 和GA3含量有助于板栗打破冬前芽休眠,促进花芽分化[21,24,27];板栗结果母枝顶芽在萌动前IAA 含量大幅上升,ABA 含量大幅下降[20-21]。程华等[24]经研究认为,较高水平C(ZR)/C(IAA)、C(GA3)/C(IAA)及C(ABA)/C(IAA)值有利于板栗冬前梢打破休眠期进入花芽分化时期。而本研究结果表明,在板栗休眠至萌动期,IAA 和ABA 含量均高 于ZR 和GA3含量,C(GA3)/C(ZR) 和C(IAA)/C(ABA)值均显著高于C(GA3)/C(IAA)、C(GA3)/C(ABA)、C(ZR)/C(ABA)和C(ZR)/C(IAA)值。混合花芽IAA 含量有上升趋势,ABA 含量有下降趋势。在芽萌动前,IAA 含量极显著上升,ABA 含量极显著下降,低ABA 含量和高IAA 含量可能有利于芽萌动。整个休眠至芽体萌动期,混合花芽C(IAA)/C(ABA)值上升最显著,C(ZR)/C(IAA)和C(GA3)/C(IAA)值显著下降,高C(IAA)/C(ABA)值、低C(ZR)/C(IAA)值和低C(GA3)/C(IAA)值共同作用,在促进芽萌动中可能起重要作用。
关于内源激素与成花的关系,有研究报道单个激素水平对板栗花芽分化有显著影响。其中,陈昉[28]和季志平等[20]经研究认为,高含量ZR 对板栗雌花形成有促进作用。陈澍燕等[23]经研究发现,IAA 在板栗雌花发育中起重要作用。季志平等[20]和雷新涛等[22]经研究指出,易形成雌花部位保持较低IAA 和ABA 水平,不易形成雌花部位则反之,且易形成雌花部位GA3含量显著高于其他部位。也有研究报道,激素比值对板栗花芽分化有显著影响。程华等[24]和吴聪华[27]认为,板栗由花序原基进入花簇原基分化需要较低的C(ZR)/C(IAA)、C(GA3)/C(IAA) 和C(ABA)/C(IAA) 值。也有研究报道,在植物花芽分化过程中,内源激素的平衡起重要作用[29-30]。
板栗花芽分化具有特殊性,其雌雄花芽分化时间不一致;混合花芽形成具有不确定性,而一旦形成混合花芽,性别分化已经完成[18]。决定板栗产量重要因素的性别分化是一个较复杂的过程,受多种因素影响,有较多问题有待进一步深入系统研究。内源激素在板栗花芽性别分化中起重要作用,可通过施用外源植物生长调节剂来促进雌花形成。本研究中仅分析了激素含量及其比值与板栗花性变化的关系,尚不明确促进板栗雌花形成的激素和调节剂适宜用量,此外,激素、其他影响因素及其交互效应对板栗性别分化的综合作用也尚不明确。因此,有必要开展相关田间试验,研究板栗芽体性别分化过程中各环节各因素的相互作用,从而精确控制板栗在不同水平的性别分化,建立多维调控模型,以便于进一步研究和调控生产,实现板栗栽培的高产高效。
