纤维板霉变微生物的分离鉴定及生长抑制方法
2020-09-29樊壬水何贤蓉叶伟蔡政良胡松青
樊壬水,何贤蓉,叶伟,蔡政良,胡松青
(华南理工大学食品科学与工程学院,广州 510640)
随着我国人造板工业的不断发展,人造纤维板在家具和装修市场上的应用日益频繁,根据《中国人造板产业报告(2018)》[1]数据显示,2017年全国纤维板产品消费量约6 370万m3。由于现有纤维板制造工艺以及我国南方梅雨天气温湿度的影响,导致南方地区纤维板较易发生霉变。霉变后的纤维板不仅影响产品外观,并且严重危害到使用者的健康。在纤维板制作和使用过程中利用防霉抗菌剂进行防护处理,可以达到防霉的效果,提高纤维板的应用价值[2]。刘媛等[3]利用化学复配防霉剂浸泡处理中密度纤维板,发现防霉效果良好。
自然界中存在许多能够降解木质纤维素的微生物,目前已分离出200余种[4]。真菌是降解木质纤维素的主要微生物,已报道的真菌包括曲霉(Aspergillussp.)[5]、木霉(Trichodermasp.)[6]和瘤胃真菌(Neocallimastixfrontalis)[7]等,这些真菌都有可能导致纤维板发生霉变。国家建材行业标准JC/T 2039—2010《抗菌防霉木质装饰板》中规定以黑曲霉(A.niger)、土曲霉(A.terreus)、宛氏拟青霉(Paecilomycesvarioti)、绳状青霉(P.funicolosum)、出芽短梗霉(A.pullulans)和球毛壳(Chaetoomiumglobsum)等7个菌种作为木质装饰板霉变检测菌种。有针对性的菌种选择是进行木材防霉剂研制的关键,黄晓东等[8]研究淀粉酶处理对竹材防霉性能的影响时,选用黑曲霉、桔青霉(P.citrinum)和绿色木霉(T.viride)作为供试菌种;许士玉等[9]研究制备抗菌防霉腐纤维板时,以白腐菌(Phlebia)、黑曲霉和褐腐菌(Monilinia)作为供试菌种。然而迄今为止,关于纤维板霉变微生物分离鉴定的研究则相对较少,宋贤冲等[10]研究发现广西南宁纤维板霉变微生物主要是木霉属和脉孢霉属(Neurosporasp.)真菌,其中木霉属真菌为优势种群。进一步分离鉴定致纤维板霉变微生物,发现更多的致霉变菌株,对提升纤维板的科学防霉水平具有重要意义。
笔者利用传统真菌形态学观察、核糖体DNA-内转录间隔区(rDNA-ITS)序列分析和同源性比较相结合的方法,对南方婴幼儿床具纤维板霉变微生物进行了分离鉴定,并分析了霉变微生物的基本生理特性,探究了碘丙炔醇丁基氨甲酸酯(IPBC)和紫外线辐照处理对霉菌生长的抑制作用,旨在为纤维板霉变的防治工作提供理论依据和建议,提高纤维板产品质量,减少产业经济损失。
1 材料与方法
1.1 试验材料与试剂
表面霉变纤维板:广东省某企业婴幼儿床上用具产品中所使用的中密度纤维板(木质纤维质量分数80%~85%、胶黏剂质量分数10%~15%、石蜡质量分数0.5%~2.0%、水分质量分数3.5%~7.0%),质量符合中密度纤维板国家标准(GB/T 11718—2009《中密度纤维板标准》)。PfuMax HiFi PCR ProMix购自广州英赞生物科技有限公司;微生物直接PCR用裂解液购自天根生化科技(北京)有限公司;IPBC试剂(质量分数为1.5%)购自广州艾浩尔防霉抗菌科技有限公司。
马铃薯固体培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L。高盐察式固体培养基:硝酸钠2 g、磷酸二氢钾1 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、氯化钠60 g、蔗糖30 g、琼脂20 g、蒸馏水1 L。上述培养基于121 ℃条件下灭菌20 min,用于分离鉴定霉菌微生物。
1.2 主要仪器与设备
Cx31-32CO2型生物显微镜,日本OLYMPUS有限公司;HJ-1406型紫外灯,广东雪莱特光电科技股份有限公司;EDC-80型PCR基因扩增仪,东胜创新生物科技有限公司;LRH-250-HS型恒温恒湿培养箱,广东省医疗器械厂。
1.3 试验方法
1.3.1 微生物样本采集
用浸有灭菌生理盐水的无菌棉签在霉变纤维板表面反复涂抹多次,剪去与手接触部分的棉棒,将棉签放入含10 mL灭菌生理盐水的采样管内,立即用于后续的分离纯化培养,在不同霉变部位共采集样本30份。
1.3.2 纤维板霉变微生物分离纯化和保存
利用稀释平板法进行菌株的分离培养,将采集的样品用灭菌水进行梯度稀释,取适量稀释液分别涂布于PDA固体培养基和高盐察式固体培养基的平板表面,于28 ℃恒温恒湿培养箱中培养3~7 d;利用三区划线法进行菌株的纯化培养,挑取单个优势菌落的菌丝,重悬于灭菌水中,取适量重悬液进行三区划线,于28 ℃恒温恒湿培养箱中培养3~7 d;用斜面法进行分离菌株的保存。
1.3.3 纤维板霉变微生物的形态学分析
对分离纯化得到的单菌落,参考《真菌鉴定手册》[11]进行菌落特征分析,对菌落的大小、颜色、形状等性状进行观察。在无菌操作台内挑取少量菌丝制成玻片,于光学显微镜下进行个体形态特征分析,根据文献[12]和食品微生物学检验国家标准(GB 4789.16—2016《食品微生物学检验常见产毒霉菌的形态学鉴定》)做出初步鉴定。
1.3.4 纤维板霉变微生物rDNA-ITS序列分析和同源性比对
1)待测菌的裂解和rDNA-ITS序列的PCR扩增。参考Vioti等[13]的实验方法,设计PCR扩增ITS序列的实验,具体步骤如下:收集培养3~5 d的新鲜菌丝,置于微生物直接PCR用裂解液中80 ℃裂解菌丝30 min,离心取上清于-20 ℃保存。采用真菌ITS通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′- T ̄C ̄C ̄T ̄C ̄C ̄G ̄C ̄T ̄T ̄A ̄T ̄T ̄G ̄A ̄T ̄A ̄T ̄G ̄C-3′)[13]进行PCR扩增反应,引物由广州艾基生物有限公司合成。反应体系为:2×Pfu Max HiFi PCR ProMix 25 μL,引物对各1 μL,DNA模板50~500 ng,补灭菌超纯水至50 μL。PCR反应条件为:98 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,68 ℃延伸1 min,共30个循环,最后68 ℃延伸5 min。反应液经过琼脂糖凝胶电泳,切胶使用胶回收试剂盒纯化回收扩增片段,回收得到的PCR扩增产物送至广州艾基生物有限公司进行测序分析。
2)rDNA-ITS序列同源性比对和系统进化树的构建。将测序结果输入美国国立生物技术信息中心(NCBI)核酸序列数据库中,使用基本的局部比对搜索工具(BLAST)进行分析,依据比对结果判断菌株所属种,当待测序列与数据库中参照序列的同源性大于或等于99%时,则可视为同一种属。查找每种菌种相关的代表菌种的rDNA-ITS基因序列,使用MEGAX软件构建系统进化树[14]。系统进化树采用邻接法进行构建,运算1 000次,计算进化距离,通过Bootstrap软件对运算结果进行评价。
1.3.5 IPBC和紫外线处理对霉菌生长的影响
IPBC试剂用灭菌超纯水分别稀释至质量分数为0.10%,0.15%和0.30%,无菌条件下取10种霉菌适量的菌丝悬浮液40 μL分别和不同稀释浓度的IPBC试剂或灭菌水20 μL混合,再将60 μL混合液涂布于PDA固体培养基或高盐察式固体培养基平板表面。由于固体培养基上存在凝结水,因此,IPBC实际工作浓度会远小于处理浓度,不会超过IPBC的安全使用质量分数(0.10%)[15]。在28 ℃ 下倒置培养5 d,对照组涂布菌液不添加IPBC试剂。
紫外线辐照处理试验方法:无菌条件下取10种霉菌适量的菌丝悬浮液,涂布于PDA固体培养基或高盐察式固体培养基平板表面,于紫外灯(功率38 W,波长253.7 nm)下分别照射10,15和30 min后,在28 ℃下倒置培养5 d,对照组不经紫外灯照射处理。
2 结果与分析
2.1 纤维板霉变微生物形态学分析
经稀释平板法和三区划线法多次分离纯化,培养得到10株形态不同的霉变菌株(标记为菌1~10),对10株霉变菌株的菌落形态和个体形态描述及初步鉴定结果如表1所示,其菌落形态如图1a所示,显微镜个体形态如图1b所示。通过菌落形态和个体形态的分析,初步鉴定10株霉变菌株中,菌1、菌4、菌5、菌6、菌7和菌8为曲霉属霉菌,菌3为青霉属霉菌,菌9和菌10为短梗霉属霉菌[16],菌2无法确定。

表1 霉变菌株菌落形态和个体形态描述Table 1 Morphology and microscopic description of moldy microbial strains

表1(续)
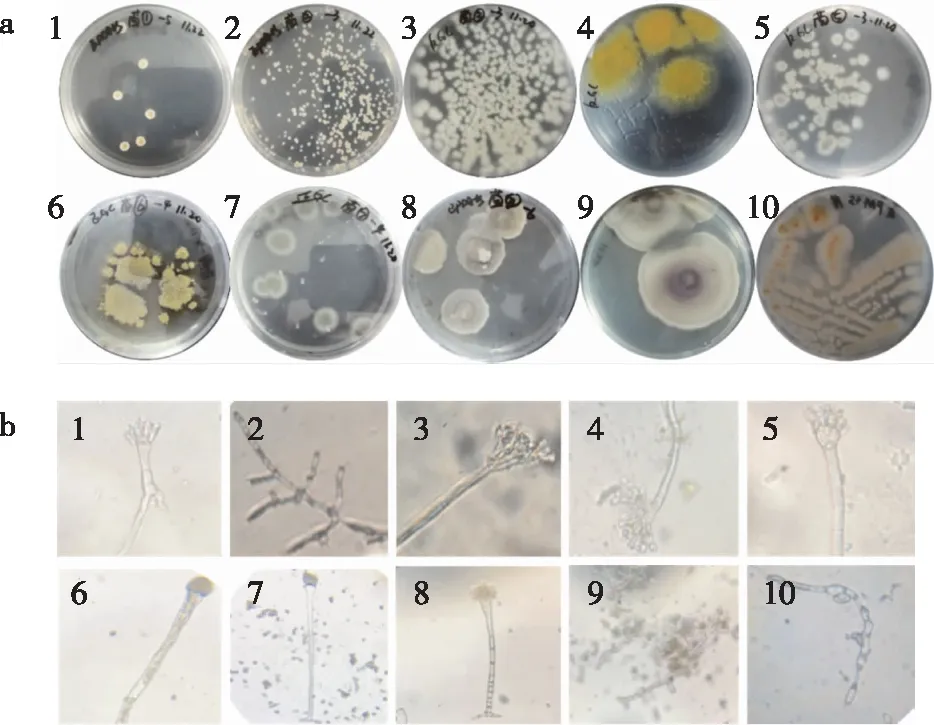
a. 菌落形态; b. 个体形态(×400)。图1 霉变菌株菌落形态和个体形态特征Fig. 1 Colony morphological and microscopic characteristics of moldy microbial strains
2.2 纤维板霉变微生物rDNA-ITS序列分析鉴定
ITS序列包括ITS1和ITS2两个部分,由于其进化相对迅速且具有多态性,因而常被用于真菌的分子生物学鉴定[17]。用于真菌鉴定的ITS序列通常包括ITS1、5.8 S和ITS2,真菌ITS区域长度一般在500~750 bp。实验共鉴定了10株菌株,ITS区域经过PCR扩增后片段均在500~700 bp,结果符合预期。将测序结果进行BLAST分析比对,然后选取同源性最高的序列构建系统发育进化树[因版面限制,具体参见开放科学计划(OSID)附图1]。根据BLAST分析以及进化树分支鉴定菌株,结果如表2所示。10株菌株中曲霉属共6株,占总数的60%,其中1号、5号、7号菌株,虽都属于帚状曲霉,但它们的ITS序列不完全一致;菌株3属于青霉属的简青霉;菌株4为假灰绿曲霉;菌株6为谢瓦氏曲霉;菌株8为阿姆斯特丹曲霉;菌株9与菌株10号均为短梗霉属的产黑色素短梗霉;比较特殊的是菌株2经分子鉴定为爪甲团囊菌目的Sigleriacarmichaelii,2015年国外学者Hirooka首次在家居灰尘中发现[18],目前国内暂未对Sigleriacarmichaelii进行具体的种属分类和中文名命名,后续可以对其进行下一步研究,以期完善爪甲团囊菌目的真菌分类。rDNA-ITS序列测定结果和形态学分析结果相一致,综上可知,引起南方婴幼儿床具纤维板霉变的微生物主要为曲霉属的霉菌,且本研究中鉴定出的产黑色素短梗霉和Sigleriacarmichaelii是新发现的致纤维板霉变的微生物。
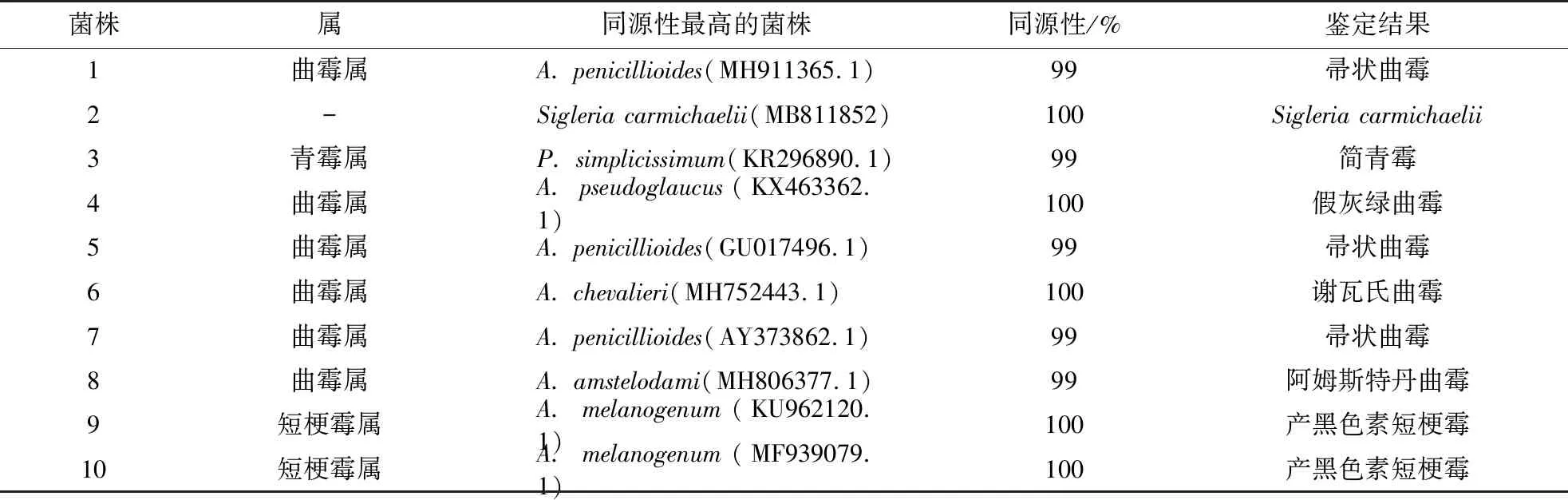
表2 霉变微生物的rDNA-ITS序列分析结果Table 2 rDNA-ITS sequence analysis results of moldy microorganisms
在美国菌种保藏中心(ATCC)查找上述7种不同种属霉菌的基本生理特性,汇总于表3。由表3可知,7株不同霉菌均为耐旱型的干性霉菌,适宜生长温度均为25 ℃左右,这和纤维板表面相对干燥的环境是相符的。干性霉菌可在物品水分活度为0.65以上的环境中生长,为了更好地防止纤维板在使用过程中因吸水而发生霉变,可以使用塑封膜将其进行塑封,同时尽可能降低纤维板制品储存时的仓库空气湿度,保持通风干燥的仓储环境。
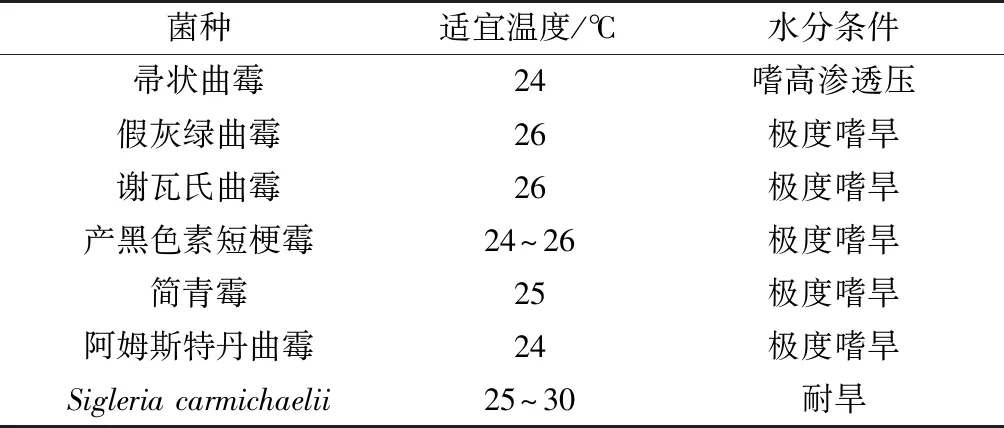
表3 霉变微生物的基本生理特性Table 3 Basic physiological characteristics of moldy microorganisms
2.3 IPBC和紫外线辐照处理对霉菌生长的抑制作用
IPBC是市售常用广谱性真菌生长抑制剂的主要成分,具有低毒性和极低的过敏性[19]。不同质量浓度的IPBC对霉菌生长的抑制作用如图2所示,对照组霉菌生长旺盛,IPBC处理组均没有霉菌的生长(即使是质量分数为0.10%的IPBC处理组),由此说明IPBC对纤维板霉变微生物的生长具有非常好的抑制作用。因此,在安全剂量范围内,合理利用IPBC处理操作台面、原料或制品本身可达到防止纤维板霉变的目的。

a. 对照组; b、c、d. 分别为添加0.10%,0.15%和 0.30%的IPBC处理组。图2 不同稀释浓度的IPBC试剂对霉菌生长的抑制作用Fig. 2 Inhibitory effects of mold growth by different concentrations of IPBC reagent
为了避免IPBC等化学物质的使用,笔者进一步探讨了紫外辐照对致纤维板霉变微生物的影响。紫外线辐照是常用的灭菌技术,对细菌和真菌的生长均具有抑制作用,具有广谱性和操作简便等优点。紫外线辐照不同时间对霉菌生长的抑制作用如图3所示,当辐照时间为10 min时,霉菌有少量成长;延长至15 min时,只有个别霉菌的生长;当辐照时间为30 min时,则无霉菌生长,由此说明紫外线辐照对纤维板霉变微生物的生长具有良好的抑制作用。因此,在使用纤维板制品时,可以合理地选择紫外线辐照定期对生产环境和制品表面进行杀菌处理,从而更好地防止纤维板制品发生霉变。

a. 对照组; b、c、d.分别为紫外线辐照10, 15和30 min的处理组图3 紫外线辐照不同时间对霉菌生长的抑制作用Fig. 3 Inhibitory effects of mold growth by ultraviolet radiation at different time durations
3 结 论
笔者利用稀释平板法和三区划线法,从南方婴幼儿床具霉变纤维板中分离纯化得到了10株霉菌,利用传统真菌形态学观察和rDNA-ITS序列分析相结合的方法,对其加以鉴定,结论如下:
1)将分离所得的10株霉菌共确定为7个种,分别为帚状曲霉、简青霉、假灰绿曲霉、谢瓦氏曲霉、阿姆斯特丹曲霉、产黑色素短梗霉和爪甲团囊菌目的Sigleriacarmichaelii,其中曲霉属真菌为霉变优势种群,且产黑色素短梗霉和Sigleriacarmichaelii是新发现的致纤维板霉变的微生物。鉴定结果和宋贤冲等[10]在广西南宁霉变纤维板中鉴定发现的霉变微生物有所不同,可见不同地区和不同仓储环境下的纤维板,霉变微生物的种类存在较大的差异。
2)抑菌试验发现IPBC和紫外线辐照处理对纤维板霉变微生物生长有良好的抑制作用。研究结果不但丰富了纤维板霉变微生物的种类,还可为纤维板产品霉变防控和防霉剂研发等提供参考依据。
