陶瓷管表面NaHCO3粉体干法脱硫研究
2020-09-29刘海弟李伟曼陈运法钱均新邹永平张晖冯家迪
刘海弟,李伟曼,陈运法 ,钱均新,邹永平,张晖,冯家迪
(1.中国科学院过程工程研究所多相复杂系统国家重点实验室,北京 100190;2.江苏省宜兴非金属化工机械厂有限公司,江苏 宜兴 214221)
随着我国工业界和政府的环保意识不断提高,工业尾气的脱硫脱硝和除尘成为环保事业的重中之重[1]。烟气脱硫作为一个成熟的工业过程已经有许多种技术方案可供选择,其中绝大多数的脱硫技术采用气液两相(湿法脱硫)和气固液三相(半干法脱硫)的反应形式实现烟气SO2的反应性脱除,纯粹使用干式脱硫剂的操作常常作为辅助手段仅用于降低烟气中SO2浓度(例如炉内喷钙)[2]。其根本原因在于常用的Ca系脱硫剂为Ca(OH)2,在没有液态水存在的条件下Ca(OH)2和SO2几乎不发生反应[3-4]。然而,最常用的湿法和半干法脱硫不可避免地导致烟气温度降低和烟气湿度提高,这恰恰是造成目前烟气低温脱硝操作失败的主要原因。目前低温SCR脱硝催化剂的起活温度在200 ℃左右或更高[5],烟气中水分含量增大将对低温SCR脱硝效果产生不利影响;换言之,如果将脱硫操作安置于脱硝催化剂之前将导致烟气温度太低、湿度太高,必须对烟气进行再次加热以满足低温SCR脱硝催化剂的起活温度要求;如果将脱硫操作安置于脱硝催化剂之后,虽然烟气的温度更容易满足低温SCR脱硝催化剂,但烟气中的SO2将导致低温SCR脱硝催化剂的物理中毒(液体硫酸氢铵的覆盖)。综上所述,对于目前需要进行低温脱硝的工业烟气,找到一种能在干态条件下完成脱硫的新技术(脱硫剂)非常必要。
NaHCO3作为一种能在干态下实现脱硫的脱硫剂逐渐引起了研究人员的注意[6-7]。NaHCO3的热分解温度不高,具有较好的脱硫性能,非常适合作为置于低温脱硝之前的脱硫操作的脱硫剂,同时陶瓷管作为高效深度除尘介质的除尘技术日臻成熟[8],而积累在陶瓷管表面的粉尘层和烟气具有良好的接触效果,因此本研究团队构思采用将NaHCO3粉末喷入烟气并涂覆于陶瓷管表面,实现烟气的脱硫,本研究基于NaHCO3热分解性能的研究基础,考察了不同温度下涂覆于陶瓷管表面的NaHCO3粉末对烟气中SO2的去除性能,研究发现,涂覆于陶瓷管表面的NaHCO3粉末脱硫效果良好,在涂层厚度很薄、所导致的压降很低的情况下完全可以将烟气中SO2降低至超低排放限值以下,其持续有效脱硫时间为19~41 min,完全高于陶瓷管除尘过程的反吹再生周期。说明将NaHCO3粉末喷入烟气结合陶瓷管除尘方法的使用,可以成功实现烟气的同时脱硫除尘操作。
1 实验部分
1.1 实验装置和试剂
NaHCO3购自阿拉丁试剂公司,SO2标气购自无锡市锡西气体有限公司,[SO2]=5%,氮气平衡。采用德国MRU公司OPTIMA7型烟气分析仪分析气体中SO2浓度,采用Netzsch Sta 499 F3 型TG/DTG 分析仪对NaHCO3进行热失重分析,空气气氛,升温速度2 ℃/min,采用Philip Xpert Pro型X射线衍射分析仪分析经热解实验的NaHCO3粉体,测试条件:Cu Kα,Ni 滤波,管电压40 kV,电流30 mA,λ = 0. 154 18 nm,2θ范围5°~90°; 步长0. 033°),采用SEM-6700F 型扫描电子显微镜(日本JOEL公司)在5 kV、10 mA 条件下分析各样品颗粒的表面形貌。在Nabertherm公司的LH 15/13型马弗炉中进行NaHCO3的灼烧实验。
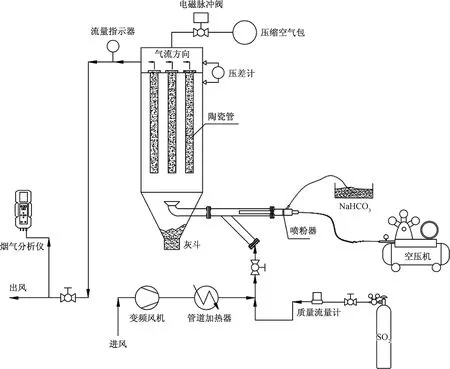
图1 除尘实验装置示意图Fig.1 Sketch of dust elimination experimental setup
1.2 实验过程
将尺寸为10 cm×5 cm的长方形瓷舟置于马弗炉中,将马弗炉温度控制于目标温度,温度稳定10 min后将NaHCO3粉体铺洒在长方形瓷舟中,5 min后将瓷舟取出,对粉体进行XRD和SEM分析。
在如图1所示的实验装置上进行除尘过程研究,除尘器中设置3根陶瓷管(管长1.5 m,外径6 cm,总过滤面积0.85 m2),通过变频风机将经过管道加热器加热的空气鼓入除尘器中,同时将一定量的NaHCO3粉体经喷粉器喷入空气流中,气流携带NaHCO3粉体穿过陶瓷管管壁后NaHCO3以粉饼层的形式积累在陶瓷管表面,粉饼形成后停止喷入NaHCO3(实验中发现积累在陶瓷管上的NaHCO3粉饼质量为40 g左右),同时在气流中通入SO2标气开始脱硫实验,空气流量为25 m3/hr(标态),对应于标态下的过滤风速为0.5 m/min,气流中SO2浓度固定于150ppm,同时开始计时,在陶瓷管除尘器后端使用烟气分析仪分析出口气流中SO2浓度随时间的变化,从而表征NaHCO3粉体的脱硫效能。
2 结果和讨论
2.1 NaHCO3粉体的热失重表征
采用Netzsch Sta 499 F3 型TG/DTG 分析仪对NaHCO3进行热失重分析,空气气氛,升温速度2 ℃/min,得到TG和DTG曲线如图-2所示,NaHCO3粉体在100 ℃左右便开始分解,123 ℃时达到最大热分解温度,147 ℃时热分解已经完成,温度升至150 ℃以上时热分解产物不再发生质量变化,总体热失重约为35%,符合NaHCO3分解为Na2CO3并释放一分子H2O和CO2的化学反应。由于热重测试过程中大量气流与少量粉体发生充分气固接触,故所得热分解数据比较接近薄层NaHCO3粉饼在陶瓷管表面沉积并被热气流加热分解的实际情况,由于NaHCO3作为脱硫剂需要先发生热分解而形成孔道,因此合理的脱硫温度应该不明显低于NaHCO3的彻底分解温度(147 ℃)。
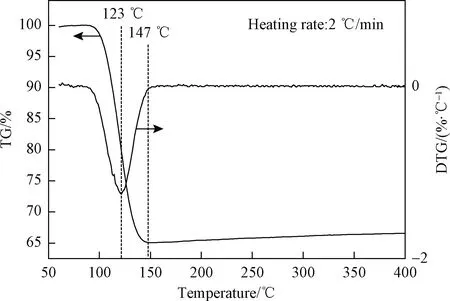
图2 NaHCO3粉体的TG和DTG曲线Fig.2 TG and DTG curves of NaHCO3 powder
2.2 NaHCO3粉体的热分解过程表征
将马弗炉温度控于目标温度下,然后将NaHCO3粉体撒于马弗炉中的瓷舟上,等待5 min后将粉体进行XRD分析,以便了解NaHCO3分解过程中的物相变化,同时通过SEM分析颗粒的表面形貌,得到由NaHCO3热分解产生的颗粒物的孔结构信息,从而获得用于脱硫时NaHCO3颗粒的合理煅烧温度范围,实验中选择120、140、160、180、200、220 ℃和240 ℃等温度点。在目标温度下受热5 min后的NaHCO3粉体的XRD如图3所示,NaHCO3粉体在马弗炉中灼烧时在140 ℃开始发生分解,160 ℃下产生具有两种物相(NaHCO3和Na2CO3)的混合物,180 ℃下热分解完成,温度升高至240 ℃时的产物与180 ℃下的灼烧产物相同,均为较纯的Na2CO3。XRD分析所得NaHCO3充分分解温度是180 ℃左右,该结果比热重分析所得的充分分解温度(147 ℃)高出33 ℃左右,其原因很可能在于热重分析中样品量很少,随着空气气氛的吹扫,样品的温度场均匀其没有滞后,热分解产物的扩散条件良好,所得的分解温度较低;然而马弗炉中的测试过程NaHCO3是一薄层洒在瓷舟底部,炉中没有明显气体流动,气固接触条件不佳,其热分解温度相对较高。
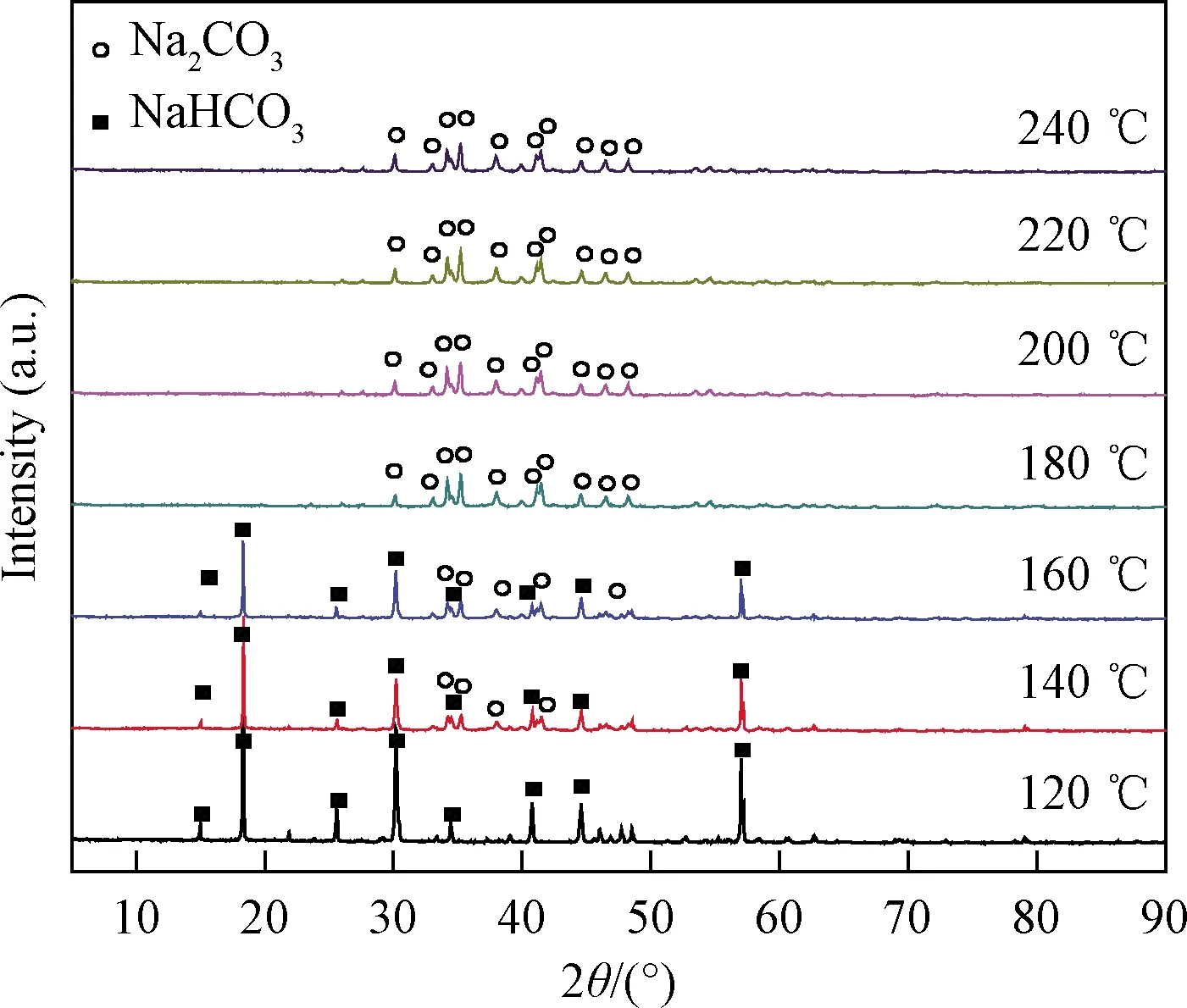
图3 NaHCO3粉体经不同温度灼烧后的X射线衍射谱图Fig.3 XRD pattern of the NaHCO3 powder calcined under various temperatures
图4是不同灼烧温度下得到的颗粒物断面的扫面电子显微镜照片。在120 ℃下灼烧的棒束状颗粒表面光滑,没有明显孔隙存在,而在140~280 ℃下灼烧后,颗粒物的断面产生丰富、均匀的孔隙,这很可能是NaHCO3分解为Na2CO3过程中H2O和CO2离开形成的孔隙,这些孔很可能对于SO2扩散至Na2CO3颗粒内部具有重要作用,比较140~280 ℃下各个样品的表面形貌可以看到,随着灼烧温度升高,颗粒表面的空隙由大变小,相比于140 ℃的情况,200 ℃和280 ℃下灼烧的颗粒的表面明显更加致密,这很可能是多孔的Na2CO3颗粒在高温下发生了烧结和孔道损失的现象;从图4G、H的对比可以更加清晰地看出:样品颗粒在灼烧后其棒束状颗粒的表面和内部均产生了丰富的孔道。根据热重、XRD和SEM的分析结果可以推断,140~200 ℃可能是NaHCO3作为脱硫剂的合理灼烧温度,因为更低的温度下干法脱硫相比湿法脱硫的优势已经不明显,而在更高的温度下由于所生成的Na2CO3发生烧结,脱硫效能将发生降低。
2.3 NaHCO3粉体的脱硫性能研究
根据以上的研究结果,在140、150、170、180、200 ℃温度下进行了NaHCO3的脱硫实验,气流中SO2浓度固定于150ppm,以粉饼形式积累在陶瓷管表面的NaHCO3粉体的质量为40 g,实验中气体流量25 m3(标态)/h,脱硫实验持续1 h,脱硫反应过程中出口气体中SO2的浓度变化曲线如图5所示,可知在140~200 ℃的温度范围内,脱硫效果随着温度的下降而提高,图5中的横线标出了出口浓度50 mg/m3(17.5 ppm)的SO2超低排放限值的位置,可知在140、150、170、180、200 ℃温度下,负载在3根陶瓷管上的40 g NaHCO3粉体分别可以在19、23、28、38、41 min内保证出口气体中SO2浓度在超低排放限值以下,可推断,在任何脱硫反应温度下均存在出口SO2浓度为0的时间段(6~10 min),而后出口SO2浓度按照近似线性的变化趋势提高,根据NaHCO3热分解的研究结果,推断存在出口SO2浓度为零的时间段的原因很可能是NaHCO3热分解所形成的Na2CO3拥有发达的孔隙结构,孔道促进了SO2向Na2CO3颗粒内部扩散并为脱硫反应提供了大量的活性表面,从而在脱硫反应初期获得了良好的脱硫效果,当Na2CO3颗粒的外表面和孔隙可及的内表面均被脱硫产物Na2SO3覆盖时,SO2不得不扩散通过Na2SO3产物层才能发生固定反应,而Na2SO3产物层随着脱硫过程进行而不断增厚,导致SO2被吸附固定的难度越来越大,最终造成出口气体中SO2浓度的不断提高。此外,在相同标态气体流量的情况下,反应温度越高,气体穿透陶瓷管的线速度越高,导致气流在Na2CO3颗粒内部上发生传质和反应的难度增大,这是随着温度提高脱硫效果降低的一个原因,同时更高的反应温度可能导致Na2CO3颗粒的烧结和孔隙丧失,这可能是更高反应温度下脱硫效果降低的另一个原因。
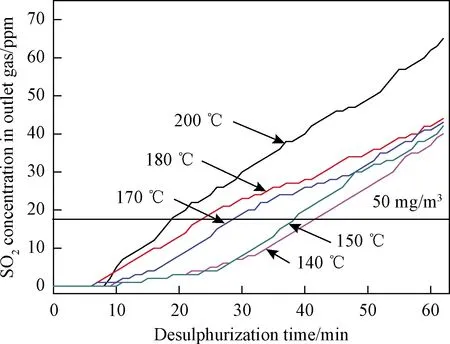
图5 NaHCO3粉体在不同温度下的脱硫效果Fig.5 Desulfurization results of NaHCO3 powder under various temperatures
实验中NaHCO3粉体的视密度为0.932 g/mL,基于该数据计算可知,40 g NaHCO3粉体分散在3根Ø 6 cm×1.5 m的陶瓷管上所形成的粉饼厚度仅有50 μm,仅和常见粉末涂料涂层的厚度相同,这层NaHCO3导致的压降上升仅有50~80 Pa,相比于多孔陶瓷管在相同过滤风速下500 Pa左右的过滤压降而言可以忽略。一般而言,常规工业操作即使在尘浓不高的情况下,陶瓷管除尘的反吹再生周期在2 min以内,故可知仅喷入少量的NaHCO3便可以作为脱硫介质保证陶瓷管除尘器在反吹/再生的循环中出口SO2浓度达到超净排放限值。同时,NaHCO3粉体作为干态烟气脱硫剂,不会造成烟气的温度和湿度明显变化,其脱硫过程不需要液态水的参与,非常适合烟气的除尘/脱硫一体化操作,为后续的低温脱硝或者直接在陶瓷管内部负载脱硝催化剂实现除尘脱硫脱硝一体化操作创造有利条件。
3 结语
本研究探讨了NaHCO3的热分解性质,以及以NaHCO3为干法脱硫的脱硫剂、以其在多孔陶瓷管表面形成的粉饼层为脱硫反应介质的新型干法脱硫技术方案,发现可以在140~200 ℃的温度下实现高效脱硫,厚度为50 μm的NaHCO3粉饼可在6~10 min内实现出口气体的SO2零排放,可以在19~41 min内实现出口气体SO2排放浓度低于超低排放限值(50 mg/m3),NaHCO3的脱硫效果随操作温度上升而下降,其原因很可能在于高温下NaHCO3分解生成的Na2CO3颗粒孔隙率下降。研究表明,NaHCO3可以作为一种高效干法脱硫剂在除尘器前端喷入烟气中,实现烟气的除尘脱硫一体化操作。
