唾液酸水平对癌症诊断与治疗的作用及其检测方法
2020-09-28朱美旗高文运
杨 阳,朱美旗,高文运
(1.西安医学院药学院 药物研究所,陕西 西安710021; 2.西北大学生命科学学院 国家微检测系统工程技术研究中心,陕西 西安 710069)
癌症是一种多基因疾病,它是由突变和表观遗传改变以及复杂的信号网络激活引起的[1]。根据世界卫生组织/国际癌症中心团队的最新全球癌症统计数据,预计癌症将成为 21 世纪各国的首位死因[2]。
唾液酸(sialic acid,SA)是以9个碳为母链的α-酮酸[3],由Blix等从颌下腺粘蛋白中分离出来,是一种天然的碳水化合物。目前,SA衍生物的类型已超过50种,主要包括3种基本形式:N-乙酰神经氨酸(Neu5Ac)、N-羟基神经氨酸(Neu5Gc)和3-脱氧-D-甘油-D-半乳壬酮糖(KDN)[4](图1)。与正常组织相比,肿瘤组织中经常可以观察到高唾液酸化的肿瘤细胞,血清中的总唾液酸(TSA)或糖脂结合唾液酸(LSP)的水平在多种癌症中显著升高。唾液酸化有助于肿瘤细胞增殖、转移以及逃避免疫系统的识别,SA有望成为癌症的生物标志物[5]。作者综述了癌症患者体内SA水平变化的可能机制,SA水平在癌症诊断、分期、治疗中的作用及其检测方法。
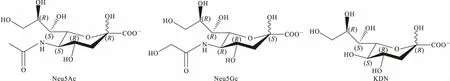
图1 Neu5Ac、Neu5Gc、KDN的结构式Fig.1 Structural formulas of Neu5Ac,Neu5Gc,and KDN
1 癌症患者体内唾液酸水平变化的可能机制
肿瘤细胞为了“自保”,会在细胞表面异常表达SA,形成SA层,掩蔽受体的抗原位点[6],借此来逃避免疫系统的识别[7]。异常的唾液酸化在癌变、肿瘤细胞的粘附、转移、侵袭及血管新生中扮演着重要的角色,了解SA水平变化的机制可为癌症的治疗提供参考。SA水平变化的可能机制如下:
第一,细胞的糖基化修饰普遍存在[8],产生修饰的主要原因是新合成的蛋白质功能激活离不开蛋白质的共翻译和翻译后修饰[9]。但是肿瘤细胞表面过度糖基化,再在糖链末端修饰SA可以提高肿瘤细胞的转移效率[10]。异常糖基化主要是因为患者体内肿瘤细胞中高尔基体的糖基转移酶(GT)表达水平发生改变,这种变化可增加细胞膜上蛋白或脂质的O-连接和N-连接多糖,增加多糖的分支,为末端唾液酸化提供了更多的结合位点,与唾液酸转移酶(ST)产生协同作用[11]。
第二, ST的过度表达或活性改变,可以将更多SA添加到多糖的末端,通过O-连接或N-连接到糖链上,ST的活性决定了唾液酸化的水平及类型[9]。例如,在结肠癌患者、肝癌患者体内,α-2,6-唾液酸转移酶(ST6Gal-Ⅰ)高度表达,提高了α-2,6-唾液酸水平,促进肿瘤细胞的生长和侵袭[12-13]。
第三,唾液酸酶的活性改变可能导致癌症患者体内SA水平升高。唾液酸酶有4种类型:NEU1、NEU2、NEU3和NEU4。在恶性肿瘤中,NEU1、NEU2和NEU4的表达减少,导致肿瘤细胞中唾液酸化多糖增加[13];但是 NEU3在结肠癌、肾癌、卵巢癌和前列腺癌等癌症中表达增加,通过诱导白介素-6(IL-6)表达和增加表皮生长因子受体(EGFR)的磷酸化,抑制细胞凋亡和促进细胞转移[9,14]。
此外,Büll等[15]认为,底物的可用性增加或参与SA生物合成的基因过度表达也是SA水平变化的机制之一。例如,以整合素受体(Integrin)、死亡受体(Fas)、EGFR、肿瘤坏死因子受体-1(TNFR-1)作为底物进行唾液酸化,介导肿瘤细胞的无限增殖、分化[12]。
2 唾液酸作为潜在的生物标志物对癌症诊断及分期的作用
目前,临床常见的癌症生物标志物是生物分子,如DNA、RNA、蛋白质、脂质、代谢物[1]等。然而,这些用于癌症诊断的生物标志物大多存在灵敏度低或特异性差等缺点,甚至在早期不能有效诊断癌症,导致大量癌症患者因得不到及时治疗而离世,有些生物标志物还会出现假阳性现象,使患者接受不必要的治疗,对患者健康不利[1]。由于SA在肿瘤组织的特殊表达,可将SA作为潜在的生物标志物诊断癌症,研究还发现,SA水平的高低可用于癌症分期。
2.1 卵巢癌
Wu等[19]研究表明,Ⅲ期卵巢癌血清中TSA水平显著低于良性疾病和健康对照者,可用于区分Ⅲ期卵巢癌和良性疾病。在早期(Ⅰ/Ⅱ期)卵巢癌中,TSA水平也降低。这些发现为早期检测卵巢癌提供了新的思路,TSA可弥补CA-125在特异性和灵敏性方面的不足,可作为潜在的辅助生物标志物对其进行进一步的研究。
2.2 乳腺癌
乳腺癌是女性最常见的恶性肿瘤之一,是女性癌症的第二大死因,每年导致全球超50万人死亡。临床用于乳腺癌筛查的首选技术是乳腺X-射线影像和超声检查,这两种技术都有限制性。约有40%年龄超过40岁的女性因乳房气肿组织密集以及年轻女性因乳房组织的致密导致早期的乳腺癌症状被掩蔽[21],通常到了晚期才能被诊断出来。
目前,很多研究者将目光转向SA水平变化在乳腺癌诊断中的应用。Hernández-Arteaga等[20]研究表明,乳腺癌患者的SA水平明显高于健康对照者和良性疾病患者,可辅助传统方法在早期诊断出乳腺癌。确定了区别良性肿瘤与乳腺癌的SA水平临界值为12.5 mg·dL-1,该值对应的灵敏度和特异性分别为80.6%和93.1%,可作为诊断乳腺癌的一种有效手段。据报道[21],乳腺癌患者与良性乳腺疾病患者相比,血清中不同形式的SA水平显著升高。Wang等[22]测定了乳腺癌肿瘤组织和正常组织中的聚唾液酸(PSA)水平,肿瘤组织中PSA水平明显高于正常组织,且随着癌症进程的加快而升高,对癌症分期有重要的指导意义。
2.3 前列腺癌
前列腺癌是一种起源于男性生殖系统的恶性肿瘤,严重危害男性健康,死亡率位居前列。临床上广泛应用的诊断标志物是前列腺特异性抗原[23],但是该方法存在检测成本高、灵敏度和特异性低、产生假阳性现象等问题,有部分患者到了晚期才被诊断出来,不利于治疗。
Zhang等[24]对良性前列腺增生患者、前列腺癌患者和前列腺癌骨转移患者血清中的SA水平进行了测定。结果显示,前列腺癌骨转移患者的SA水平最高,其次是前列腺癌患者和良性前列腺增生患者(图2),当SA水平>52.35 mg·dL-1时,患有前列腺癌的几率很大,可辅助前列腺特异性抗原检测结果进行诊断;SA水平>59 mg·dL-1时,可作为骨转移的一个指标,弥补了前列腺特异性抗原检测的不足。据报道[25],在高危前列腺癌患者中,前列腺特异性抗原上的SA水平明显高于中低危患者,该方法的灵敏度和特异性分别为85.7%和95.3%,为癌症分期治疗提供了重要指标,可作为诊断的辅助手段。

图2 不同前列腺疾病患者血清中的SA水平Fig.2 SA levels in serum of patients with different prostate diseases
2.4 口腔癌
口腔癌目前在印度男性癌症中最常见且死亡率很高,这主要归因于印度烟草的广泛使用。据统计,91%的口腔癌与烟草的使用有直接关系[26]。将血清或唾液中的SA水平作为诊断和分期标志,为研发快速、有效诊断口腔癌患者的生物标志物提供了参考。据报道,在口腔癌变前会出现口腔白斑或粘膜下纤维化[27],在口腔癌患者中血清的TSA水平升高,且随着不典型增生程度的加重而升高,此发现有助于在早期对口腔癌进行预防,从而降低发病率和死亡率[28]。Hemant等分别对健康对照者、口腔白斑患者、口腔粘膜下纤维化患者及口腔癌患者血清中的TSA和LSP水平进行了测定。结果显示,健康对照者、口腔白斑/粘膜下纤维化患者、口腔癌患者血清中的TSA水平呈递增趋势(图3),这对于口腔癌的早期诊断有重要意义。
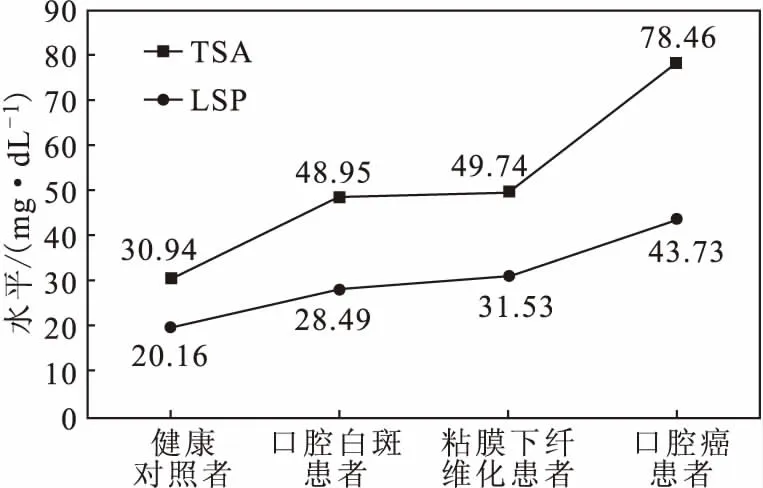
图3 健康对照者与口腔疾病患者血清中的TSA和LSP水平Fig.3 TSA and LSP levels in serum of healthy control and patients with oral diseases
Joshi等[29]对恶性肿瘤的不同时期中的TSA水平进行了测定。结果显示,血清中TSA水平随肿瘤进程而明显升高,为癌症分期和采取相应的治疗手段提供了参考。
2.5 其它癌症
SA水平的改变在其它癌症的诊断中也有显著作用。胃癌患者的SA水平低于健康者,但是在癌症分期中无明显作用,还有待进一步研究[30];喉癌患者的SA水平随着喉癌恶性程度增加呈不规则升高,即SA水平在Ⅱ、Ⅲ和Ⅳ期中逐渐升高[31]。因此,在未来的癌症诊断和分期中可将SA水平作为辅助指标,提高检测特异性。在肾癌的研究中发现,肾癌组织中的SA水平高于正常肾组织[32],可对其进一步研究,将SA水平发展为肾癌诊断的有效指标。
3 唾液酸在癌症治疗中的作用
随着研究的进一步发展,越来越多的研究人员发现,作用于ST或者唾液酸酶的药物可以减少肿瘤细胞的唾液酸化,抑制肿瘤生长,同时促进CD8+T细胞清除肿瘤细胞和激活树突细胞的抗肿瘤作用[8]。将SA作为药物载体靶向体内与SA有高度亲和力的受体以及研发与SA有亲和力的药物制剂都可以提高药物对肿瘤细胞的杀伤力。
3.1 抑制唾液酸转移酶发挥治疗作用
ST异常升高是肿瘤细胞产生耐药性的原因之一,其实质是ST导致细胞表面唾液酸化增强。顺铂对卵巢癌细胞的抑制作用减弱归因于ST6Gal-Ⅰ的表达增强,若强制将ST6Gal-Ⅰ基因敲除,顺铂诱导癌细胞凋亡的作用增强[33];ST6Gal-Ⅰ使EGFR的唾液酸化,导致靶向EGFR的药物吉非替尼抗肿瘤作用被削弱[34]。
Huang等[35]发现,人参皂苷可抑制ST6Gal-Ⅰ和α-2,3-唾液酸转移酶(ST3Gal-Ⅰ),阻滞SA与多糖进行α-2,6和α-2,3连接,从而降低SA水平;大豆皂苷Ⅰ和石胆酸类似物AL10 可以抑制ST3Gal-Ⅰ的活性,能有效减少细胞表面的α-2,3-唾液酸化[9];ST抑制剂Lith-O-Asp在白血病、膀胱癌、胃癌、结肠癌、乳腺癌和卵巢癌中都可以抑制过度表达的ST,降低其活性,还能抑制整合素唾液酸化和FAK/paxillin信号通路,降低细胞的迁移能力[36];含氟唾液酸类似物P-3Fax-Neu5Ac 和Ac53FaxNeu5Ac在结构上与Neu5Ac相似,可作为底物与ST结合,且有高度特异性,阻止天然SA与多糖结合,分别抑制黑色素瘤和神经母细胞瘤的生长[37-38]。选择性抑制ST的药物在治疗耐药肿瘤方面有着重要作用,对其进行更深入的研究可提高癌症的治愈率。
3.2 作用于唾液酸酶发挥治疗作用
早在1978年,有研究[39]证明,靶向唾液酸酶的药物在临床上可用于治疗恶性肿瘤。磷酸奥司他韦(达菲)和扎那米韦以Neu1为靶点治疗对顺铂和吉西他滨有耐药性的胰腺癌,是一种治疗获得性耐药胰腺癌的有效药物[40]。研究[41]证明,Neu3在肾癌、结肠癌、卵巢癌、前列腺癌和慢性骨髓白血病中明显上调,有发展成抗转移药物靶点的潜力。Neu3 siRNA在体外可抑制前列腺癌细胞中Neu3的表达,削弱肿瘤细胞的侵袭和迁移能力[42]。含炔基的炔铰链3-氟唾液酰氟(DFSA)是唾液酸酶的不可逆抑制剂[43],其有发展为抗癌药物的潜力,还需要进一步的研究。
3.3 唾液酸作为配体靶向体内受体
3.3.1 以唾液酸结合凝集素-1(Siglec-1)作为内源性受体
研究发现,SA-硬脂酸偶联物修饰纳米复合材料包裹的伊布鲁替尼(SA/IBR/EPG)以及用SA-聚乙烯亚胺-胆固醇(SA-PEI-CH)修饰的阿霉素脂质体(DOX-SPCL)的SA与T肿瘤相关巨噬细胞(TAMs)上高度表达的Siglec-1特异性结合,阻断TAMs更新,从而有效消除了TAMs诱导产生的免疫抑制和血管生成,增强Th1介导的免疫应答,从而抑制肿瘤进程[44-45]。维生素K2(VK2)对肝癌、肺癌、结直肠癌等多种肿瘤细胞株有抑制作用,将SA-胆固醇锚定在VK2纳米乳表面,可显著提高抗肿瘤活性。这归因于Siglec-1在肿瘤细胞中的表达,使VK2在肿瘤细胞内积聚,更加高效地促进肿瘤细胞周期阻滞和凋亡[46]。
3.3.2 以选择素作为内源性受体
选择素在肿瘤细胞和肿瘤血管内皮细胞的表面高度表达,因此,当药物载体循环到肿瘤部位时,肿瘤细胞可以通过配体-受体识别直接摄取药物,提高肿瘤细胞内药物的含量。对阿霉素-SA-右旋糖酐-十八酸胶束(SA-Dex-OA/DOX)的研究表明,SA胶束比未修饰SA的胶束更易进入细胞内。这是因为,SA与肿瘤细胞表面过度表达的E-选择素结合,提高了细胞主动转运的能力,表现出良好的抗肿瘤活性[47]。聚唾液酸-p-十八胺(PSA-p-ODA)修饰脂质体皮质酮(PIX-PSL)与硼替佐米-唾液酸前药都可特异性地靶向中性粒细胞(PBNs)表面存在过度表达的L-选择素,进而提高对肿瘤细胞的靶向性,降低非靶细胞的非特异性毒性[48-49]。以选择素为SA的靶点,为肿瘤靶向治疗提供了一条研究途径。
3.3.3 以成纤维细胞生长因子2(FGF2)为受体
PSA可与FGF2特异性结合,并通过FGF2、成纤维细胞生长因子受体(FGFR)和硫酸乙酰肝素(HS)三元复合物,直接与肿瘤细胞表面的肿瘤生物活性分子结合,抑制肿瘤细胞生长。PSA修饰的载体可以通过FGF2靶向肿瘤,提高抗肿瘤活性。以两亲性聚唾液酸胆固醇衍生物(PSA-CSCH)和F 127为载体的阿霉素复合胶束(DOX-PF-M)以及PSA-聚乙二醇(PEG)偶联物修饰的表阿霉素(EPI)脂质体的体外实验结果显示,药物在肿瘤部位的摄取量显著增加,对肿瘤细胞的杀伤能力增强[50-51]。PSA作为SA的衍生物,具有无毒、生物可降解性和分解代谢产物等优点,在药物载体表面修饰PSA在提高抗肿瘤活性方面有广阔的应用前景。
3.4 唾液酸作为体内靶点
SA和含糖复合物的SA是癌症治疗的有效靶点[52]。SA在肿瘤细胞表面大量存在,其表达高于正常细胞,若将其作为靶点,可提高药物的选择性,减少全身副作用。
研究表明,苯硼酸(PBA)及其衍生物可以选择性识别肿瘤细胞膜上的SA,SA的外环多元醇基(在肿瘤细胞中表达)与PBA的硼酸基团之间形成可逆的环硼酸酯[53],在化合物中引入PBA或PBA衍生物如4-羧基苯硼酸(CPBA)、3-羧基苯基硼酸,都可以提高非选择性药物的靶向性,降低非肿瘤组织的毒性作用[54-56],达到靶向治疗的效果。例如,用PBA修饰的大豆蛋白纳米粒[57]、PBA-奥沙利铂纳米胶束[58],可使纳米粒主动靶向过度表达SA的肿瘤细胞,同时还能改善肿瘤微环境,有效减慢了肿瘤细胞的生长和转移速度,同时也改善了药物被肿瘤细胞识别和摄取的能力。
Ono等[59]发现,选择性地将海藻酸盐分子通过离子交联与SA共价结合形成薄层水凝胶,阻止SA与受体结合,在体外可导致肿瘤细胞死亡,在体内仅抑制肿瘤细胞生长。这一技术不同于以往的抗肿瘤作用,为抗肿瘤药物研发提供了新的思路。

3.5 其它治疗作用
研究发现,在耐药细胞表面往往表达更多的SA,使细胞膜带更多的负电荷。Liu等[61]基于这一现象,选择带正电荷的聚苯胺纳米梭子(VCR-PEG-CuPani NSs)作为肿瘤治疗的纳米材料,带负电荷的耐药细胞与带正电荷的纳米材料之间产生强大的静电吸引力,有利于纳米材料滞留于肿瘤组织中。这一发现有助于耐药肿瘤的治疗,并且肿瘤细胞的表面负电位通常会随着恶性程度的增加而增大,表明该策略可能对于恶性程度较高的肿瘤有更好的治疗效果。
4 血清和血浆中唾液酸水平的检测方法
SA水平的检测方法很多,早期的硫代巴比妥酸法、薄层色谱法逐渐被更加便捷的高效液相色谱法、质谱法取代。在检测过程中,为了避免SA解离,通常在测定前对其进行衍生化,形成甲基化、酯化产物,提高稳定性,更有利于用色谱法或质谱法进行检测[62]。伍晓燕等[63]已对SA的检测方法进行了综述,接下来主要讨论可用于癌症患者体内SA水平的检测方法。
4.1 分散固相萃取与色谱法或质谱法联用
血清成分复杂,SA水平极低,对其进行提取和检测都十分困难。选择合适的分散固相萃取(DSPE)的吸附剂对血清样品进行前处理,再采用色谱法或质谱法测定血清中SA水平可提高检测灵敏度。利用PBA及其衍生物与SA之间的作用研发新型吸附剂是研究热点。
田华君等[64]在介孔二氧化硅KCC-1上修饰3-丙烯酰胺基苯硼酸(AAPBA)制备材料AAPBA@KCC-1作为分散固相萃取的吸附剂,用于提取和富集血清中的SA,解吸后采用傅立叶变换离子回旋共振质谱法(FT-MS)测定血清中SA水平。该方法测定速度快、结果准确,适用于生物样品中SA水平的测定。
Huang等[65]以3-氨基苯硼酸(APBA)、甲基丙烯酸缩水甘油酯(GMA)及Fe3O4为原料,制备了硼酸亲和磁性空心分子印迹聚合物(B-MhMIP),并以B-MhMIP为吸附剂,在pH=4的条件下吸附SA,在碱性条件下解吸,采用高效液相色谱法进行测定。在最佳条件下,SA的检出限为0.025 μg·mL-1,回收率为70.9%~106.2%。表明B-MhMIP能选择性高效富集复杂基质中的痕量SA,其推广使用将为SA水平的检测带来便利。
Qu等[66]将2-氨基对苯二甲酸连接在锆基金属有机骨架上制备了分散固相萃取的吸附剂UiO-66-NH2,用于提取血浆中的SA,用5%的醋酸水溶液进行超声解吸,采用高效液相色谱-荧光检测相结合的方法进行测定。该方法对生物样品中SA水平的测定具有较高的灵敏度和回收率,检出限低,Neu5Gc和Neu5Ac的检出限分别为0.16 pmol· L-1和0.11 pmol·L-1,对于分析痕量SA有广泛的应用前景。
4.2 表面增强拉曼光谱法
表面增强拉曼光谱(SERS)技术是一种基于拉曼光谱发展的可获得物质的分子信息以及具有超高检测灵敏度的光谱技术[67]。SERS用于宫颈癌细胞[18]、乳腺癌细胞[68]、肝癌细胞[5]中SA水平的检测,可鉴别良性疾病和癌症。为了实现SA的特异性检测,通常需要用SA配体PBA衍生物进行修饰,增强拉曼信号,实现对SA水平的检测。
Teng等[69]将金纳米颗粒(Au NPs)、氧化铟锡玻璃(ITO)、4-巯基苯硼酸(4-MPBA)组装在一起,得到ITO/Au/4-MPBA反应板,能与SA形成可逆的酯化产物。将ITO/Au/4-MPBA加入到肺癌患者血清中,得到类似于“三明治”的夹层结构——ITO/Au/4-MPBA/SA/4-MPBA/Au,采用拉曼光谱法进行检测,可避免糖类物质的干扰,与传统方法相比,灵敏度和选择性更高。
He等[70]用MPBA和4-巯基苯腈(MBN)修饰的银纳米颗粒(Ag NPs),制成无背景SERS纳米探针,可准确定量检测细胞表面的SA水平,也可用于监测SA在肿瘤细胞表面的动态表达过程。为筛选癌症提供了一种准确的活细胞表面SA水平定量分析方法。
5 展望
癌症现在仍然是人类生命健康面临的一大威胁,但及早发现癌症可以提高患者的生存率。大量研究表明,SA异常表达在肿瘤细胞中广泛存在,在某些癌症进程中SA水平在不同时期表现出明显的差异,所以SA可作为潜在生物标志物用于分期诊断、监测癌症进程。
SA以及改变SA水平的酶类(如ST、唾液酸酶)在癌症中扮演着重要的角色,在未来的研究中,可以将SA、ST以及唾液酸酶作为新药研发的靶点。例如,以SA作为靶点,可以寻找PBA衍生物作为药物载体,提高药物作用的靶向性,或者根据PBA与SA的结合形式研究新的药物载体;以ST为靶点,可以研发ST的底物类似物,与SA竞争性结合ST,减少细胞的唾液酸化,从而达到抑制肿瘤细胞增殖和转移的目的;以唾液酸酶水解多糖上的SA为思路,研发NEU1、NEU2、NEU4类似物与唾液酸酶协同水解SA,使肿瘤细胞被免疫系统识别和杀伤,达到治疗作用,也可以研发NEU3抑制剂,促进肿瘤细胞凋亡。以减少肿瘤细胞表面SA水平为目的研究药物,可以达到治疗癌症、减少对正常组织的毒副作用的目的。
血清中的成分复杂,SA水平极低,若没有高效、简便的检测方法,SA难以作为生物标志物在临床中应用。研究表明,寻找合适的分散固相萃取的吸附剂吸附血清中的SA,再联用其它分析方法如高效液相色谱法、质谱法进行测定,可以提高分析准确度,或者将萃取得到的SA进行衍生化后,采用气相色谱法进行测定,都可以作为未来的研究方向。SERS法简便、准确,选择合适的纳米材料,以SERS纳米探针为研发方向,可达到动态监测癌症进程中SA水平变化的目的。
总之,SA水平的变化在各种癌症中都很突出,SA有发展为生物标志物治疗诊断和监测癌症的潜在应用价值,对有效提高癌症患者的生存率具有重要意义。
