50例胚胎植入前遗传学诊断的临床资料分析
2020-09-28陈蕾李敏黄影揣云海舒明明朱海燕
陈蕾,李敏,黄影,揣云海,舒明明,朱海燕
(中国人民解放军总医院第六医学中心妇产科,北京 100048)
遗传性疾病是威胁人类健康的主要疾病之一,可导致严重的出生缺陷。胚胎植入前遗传学诊断(Preimplantation genetic diagnosis,PGD)是在体外受精-胚胎移植(IVF-ET)技术的基础上,对具有遗传性疾病风险夫妇的卵母细胞或者植入前的胚胎进行活检,利用分子生物学技术对胚胎进行遗传学检测,筛选出无遗传性疾病的胚胎进行植入[1]。PGD主要针对已经明确病因的遗传性疾病家系,在种植前对胚胎进行相应的遗传学诊断,主要包括单基因病(如地中海贫血、遗传性耳聋等)和染色体病(如罗氏易位、平衡易位等),选择没有发病风险的胚胎移植,一方面可以从源头上杜绝患病儿出生,另一方面也可以避免因反复人工流产或引产导致的身体和精神上的创伤[2-3]。本研究通过对40例染色体病和10例单基因病患者的PGD临床资料进行详细分析,以期为今后此类患者的诊疗及遗传咨询提供一定依据。
资料与方法
一、研究对象
选取2017年1月至2019年1月在解放军总医院第六医学中心妇产科生殖中心就诊并完成IVF/ICSI助孕周期及PGD的50对夫妇,其中40例是夫妻之一为染色体结构异常携带者,10例为单基因病家族史、夫妻一方或双方为致病基因携带者。对患者的临床资料进行回顾性分析。
二、研究方法
1.IVF/ICSI-ET方案:所有患者均采用本中心制定的常规促排卵方案,如长方案、拮抗剂方案、微刺激方案、高孕激素状态下促排卵方案(PPOS方案)及短方案等。所用的促排卵药物为重组人卵泡刺激素(r-hFSH,默克,德国),拮抗剂为西曲瑞克(思泽凯,默克,德国),长方案所用的降调药为促性腺激素释放激素激动剂(GnRH-a,曲普瑞林,达菲林,益普生,法国)。行B超检查监测卵泡发育情况,当卵泡直径≥18 mm时,给予人绒毛膜促性腺激素(HCG,默克,德国)10 000 U肌肉注射。34~36 h后,在B超引导下进行负压抽吸取卵。
2.胚胎培养:将受精卵放入卵裂期培养液进行培养,液滴大小20 μl,每个液滴放入3~5个卵裂期胚胎,放入三气培养箱进行培养。培养至第3天将卵裂期胚胎转移入事先经CO2平衡的囊胚培养液进行囊胚培养,每个液滴(20l)放1个胚胎,放入三气培养箱继续培养,培养至第5天(D5)、D6后,根据Gardner评分标准对囊胚进行评分。
3.囊胚期活检:选取D5或D6囊胚进行滋养外胚层活检,选择内细胞团对侧采用激光破膜系统在透明带上打孔,之后继续培养4~6 h,使部分滋养层形成疝后更利于囊胚活检。活检时,让内细胞团位于固定针一侧,活检针靠近形成疝的外滋养层细胞缓慢回吸,并利用激光打孔,直至活检的外滋养层细胞全部脱离囊胚,活检后囊胚继续培养30 min后冷冻保存。活检组织在配子缓冲液中清洗后装入含有2 μl单细胞裂解液的PCR管中,-20℃冷冻保存待用。所有囊胚活检后依据活检报告进行单囊胚移植。
4.单细胞全基因组扩增:应用多次退火环状循环扩增法(multiple annealing and looping-based amplification cycles,MALBAC)技术,对活检细胞进行全基因组扩增(whole-genome amplification,WGA)。采用单细胞WGA试剂盒(江苏亿康公司),按照操作说明,依次经过细胞裂解、预扩增、指数扩增步骤进行扩增。
5.染色体拷贝数分析:单细胞WGA扩增后的每个样本产生约2 M reads的数据量,使用Illumina HiSeq 2500平台,采用二代测序技术(Next generation sequencing,NGS)检测胚胎染色体拷贝数,计算每个窗口的reads数目,并使用R语言对每个窗口的GC矫正之后的reads 数目进行作图,使拷贝数变异可视化。
6.单基因病胚胎植入前遗传学检测(PGT):10个单基因病家系先证者的基因诊断均在我院产前诊断中心完成,明确致病基因突变。不同基因的检测方法不同,例如杜氏肌营养不良(Duchenne muscular dystrophy,DMD)家系的缺失突变采用多重连接依赖探针扩增(Multiple Ligated Probe Amplification,MLPA)方法检测,SCA3家系采用荧光定量PCR(qf-PCR)方法检测,其他家系的点突变采用sanger测序法。单细胞WGA扩增后,除针对不同家系进行致病基因变异位点检测之外,同时针对该病例涉及基因所在染色体多个单核苷酸多态性(single nucleotide polymorphism,SNP)位点进行检测,对胚胎及家系的进行单体型分析,协助明确胚胎基因型。
7.产前诊断:所有孕妇在妊娠18~22 W进行羊水穿刺,产前诊断,对胎儿进行核型分析及基因检测,再次复核患者核型和基因型。
三、统计学分析
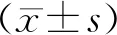
结 果
一、染色体病患者PGD临床资料
40例染色体病家系中女方年龄25~43岁,平均(33.9±4.4)岁,共有6种染色体病,分别为平衡易位、倒位、罗氏易位、白血病骨髓移植后和多态性等。其中30例为平衡易位(男性17例,女性13例),4例罗氏易位(男性3例,女性1例),3例倒位(男性2例,女性1例),2例反复胚胎停育(男方染色体多态),1例男性白血病骨髓移植后。最常见的病史为胚胎停育史(21例),占52.5%(21/40);其次为原发不孕(14例),占35.0%(14/40)(表1)。

表1 染色体病夫妇资料信息
40例染色体结构异常携带者病例共进行了49个促排卵周期,形成了150个囊胚,全部采用囊胚活检,成功率为100%。每个患者获卵数为1~12个,平均(3.8±3.1)个;经过PGD诊断后获得可移植囊胚总数为39个,60%的患者获得了可移植的囊胚(24/40),每个患者获得可移植囊胚数目范围是0~9个,平均为(1.0±1.5)个。均为单囊胚移植,移植20人。临床妊娠12人,流产2例,分娩10人,其中6例男婴(剖宫产4例,顺产2例),4例女婴(剖宫产3例,顺产1例)。所有孕妇在孕中期均行羊膜腔穿刺产前诊断,核型分析均未见染色体拷贝数目异常。妊娠率60.0%(12/20),分娩率50.0%(10/20)(表2)。

表2 染色体病患者PGD临床资料
二、单基因病患者PGD临床资料
10例单基因病家族史患者中,女性年龄23~38岁,平均(34.0±4.8)岁。共有7个病种,其中常染色体显性遗传性多囊肾3例,血友病2例;最常见的病史为不良产史和原发不孕各4例,其次为有家族史的患者2例(表3)。

表3 单基因病患者临床资料信息
10例单基因病患者进行了13个促排卵周期,获得了68个囊胚并进行了检测,全部采用囊胚活检,成功率为100%。每个患者获卵数为1~10个,平均(6.8±3.4)个,经过PGD基因检测共获得了24个可移植囊胚,每个患者获得可移植囊胚数目范围0~5个,平均为(2.4±1.8)个。全部采用单囊胚移植,移植9人,临床妊娠5人;孕中期产前诊断,胎儿染色体核型均正常,单基因病家系胎儿基因型与PGD结果相符。1例孕24 W时自然流产;1例至文章撰写时孕30 W;3例足月剖宫产,均健康。持续妊娠率55.6%(5/9),分娩率33.3%(3/9)(表4)。
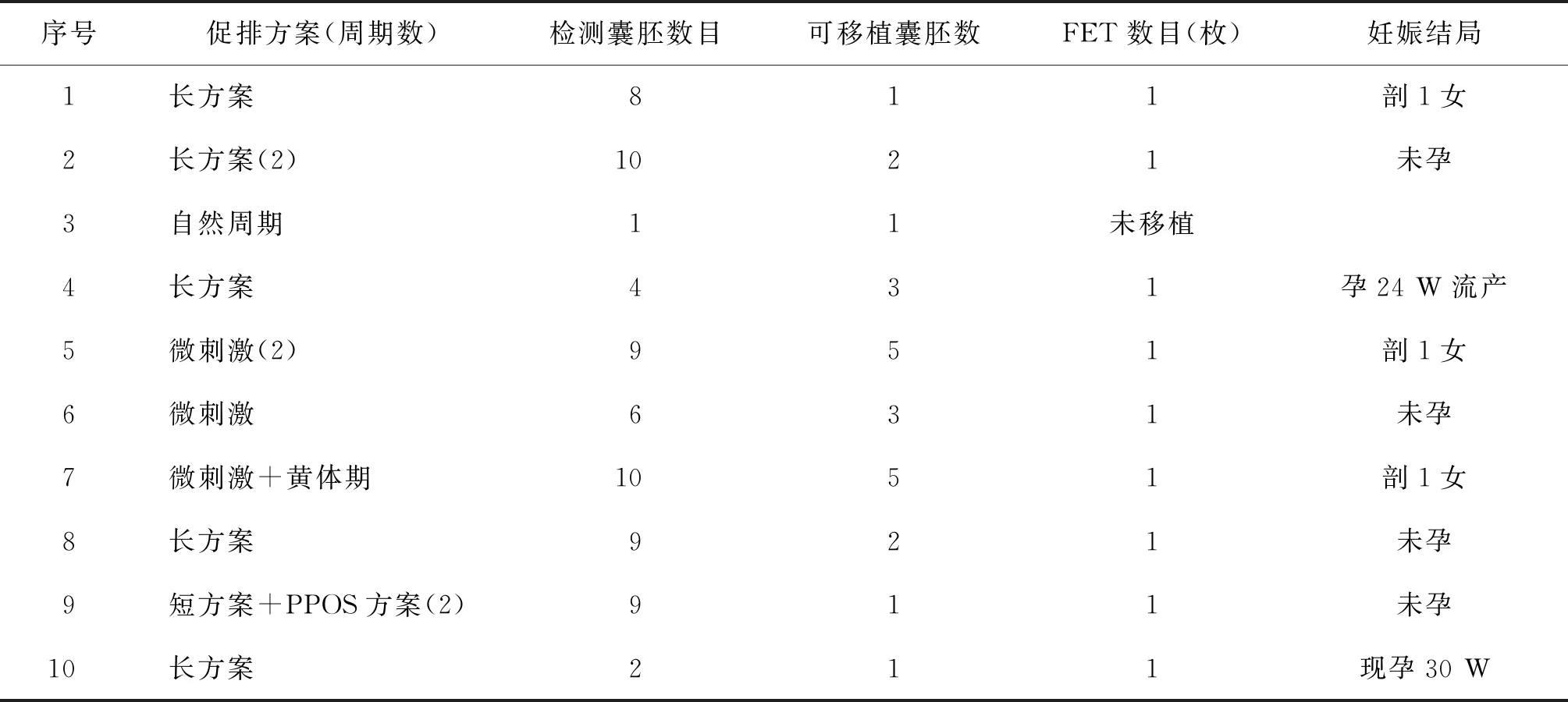
表4 单基因病患者PGD临床资料
讨 论
Handyside等[4]最早在1990年首次将PGD技术应用于临床,为5对X连锁隐性遗传病的夫妇进行胚胎移植前诊断,最终有2对夫妇获得了健康的双胎女婴。随后这项技术迅速发展,特别是结合了辅助生殖技术,对有遗传高风险的夫妇进行PGT,可大大降低出生缺陷的发生[5]。目前针对胚胎染色体的PGT,根据检测目,分为PGT非整倍体检测(PGT for aneuploidy,PGT-A)、PGT染色体结构异常检测(PGT for chromosome structural rearrangements,PGT-SR)和PGT单基因病检测(PGT for single gene/monogenic disorders,PGT-M),PGT-A主要可检测胚胎非整倍体、染色体部分缺失/重复(通常≥4 Mb),PGT-SR可以了解胚胎的染色体是否存在结构变异,即了解胚胎是否遗传了亲代染色体的易位、倒位等结构异常。PGT-M用于单基因病的植入前检测[6-7]。
染色体数目或结构异常所导致的疾病称为染色体疾病。有研究对流产、死产及新生儿和一般人群进行调查,结果显示染色体异常占流产胚胎的50%,占死产婴儿的8‰,占新生儿死亡者的6‰[8]。在一般人群中相互易位占2‰左右,在染色体病中排在第1位;排在第2位的是罗氏易位,人群中频率约为1‰,其中15%生育力低下。在自然流产夫妇中,易位的发生率显著增高,可达5%~10%[9]。相互易位由于没有遗传物质的丢失,本人无异常表型,但在其配子形成的减数分裂过程中,同源染色体重组可形成多种类型的遗传物质不平衡的配子,生育染色体异常后代几率达到50%~100%,严重影响生育。PGT-SR的出现,给这类患者带来了希望。Butler等[10]曾研究了28例PGT-SR患者,发现在IVF促排卵的过程中,60.7%的患者至少有1个正常的胚胎,胚胎移植后累积妊娠率为87.5%,持续妊娠或分娩率为42.9%。本研究的40例患者中,60%的患者有可移植胚胎,累计妊娠率为60.0%,与前述文献比较,此两项指标相似,但本研究中分娩率(50.0%)更高一些。当然分娩率的高低和PGT-SR结果、卵子数量、检测的囊胚数及适宜移植胚胎数等均有显著的相关性[11]。国际上多数生殖中心,PGT后每次胚胎移植的临床妊娠率约为40%[2],本研究数据略高于国际平均数据,这可能与我们的病例数少有关。
单基因病是由一对等位基因控制并因单个基因突变引起的疾病,一般涉及单个核苷酸到整个基因的改变。根据致病基因所在染色体及基因表现型的不同可以把孟德尔遗传病分为常染色体(autosomal)遗传和性连锁(sex-linked)遗传两大类,两者又分为显性遗传和隐性遗传两种。单基因病的发病主要在婴幼儿、青少年时期,青少年后期发病者不到10%,最主要的临床表现是智力障碍、生长发育迟缓、单器官或者多器官发育异常、听力或者神经、血液系统损害等[12]。因此很多夫妇因单基因病生育史,部分因单基因病家族史而就诊,甚至部分夫妻因家族中有基因病患者不敢生育,对家庭造成严重影响。经过PGT-M,可了解胚胎目的基因的基因型,选择没有发病风险的胚胎移植,以避免子代发病[13];对于性连锁的遗传病,还可以通过对胚胎性别进行鉴定,以避免子代发病的可能[14]。我们实验室对有血友病家族史的夫妇采用PGT-A结合PGT-M,选择染色体平衡且未遗传致病基因的胚胎植入,可以获得健康婴儿。
目前针对单基因病的PGD技术发展非常快。本研究采用MALBAC扩增测序的PGD,为了减少单细胞PCR中的高等位基因丢失的发生率,同时引入了胚胎植入前遗传学单体型分析(preimplantation genetic haplotyping,PGH)技术。该技术通过对多个SNP位点进行检测,并结合家系SNP单体型连锁分析的策略,可以从理论上为模板中等位基因丢失的问题提供解决方案。
近年来,随着PGD技术在各学科领域的扩大应用和发展,越来越多的学者开始关注PGD子代的安全问题和伦理问题。Winter等[15]曾在研究中对经PGD获得活产(47例)、经ICSI获得活产(49例)及自然妊娠后分娩(48例)的5~6岁儿童的认知发育和运动能力进行随访评估,结果显示PGD组儿童的两项指标和其他两组比较并无显著性差异,而自然妊娠组儿童和ICSI组儿童的运动能力比较存在显著性差异。本研究纳入的50例样本人群中共分娩获得新生儿13例,随访均无明显出生缺陷发生;1例孕30 W,产检胎儿健康。但PGD安全问题的探讨,涉及的内容比较多,也比较复杂,包括胚胎活检、活检的时期、活检的方法及部位等,仍需要更长久和更多的病例分析来完成,还需进一步扩大样本量以支持本文结论。
总之,PGD技术的出现为染色体疾病的夫妇带来了希望,由于本中心开展PGD工作量不大,诊疗病种不多,需积累更多的病例,一起为临床提供更多的参考。NGS技术可以有效筛查出携带染色体病和单基因病的囊胚,避免移植此类囊胚,阻断遗传病的传递。
