卵母细胞玻璃化冷冻对临床妊娠结局的影响
2020-09-28朱序理曹金凤孙庆云冯腾飞韩嫣杜元杰郝桂敏
朱序理,曹金凤,孙庆云,冯腾飞,韩嫣,杜元杰,郝桂敏
(河北医科大学第二医院生殖医学中心,石家庄 050000)
随着辅助生殖技术(ART)的发展,近几年,卵母细胞冷冻一直是生殖领域的研究热点。自1999年世界首例卵母细胞玻璃化冷冻婴儿诞生以来[1],随着玻璃化冷冻技术的成熟以及卵胞浆内单精子注射(ICSI)的应用,卵母细胞的冷冻复苏率、受精率和临床妊娠率都有较大的提高,但玻璃化冷冻的卵母细胞和新鲜卵母细胞行ICSI后其受精、卵裂情况以及妊娠结局,尤其是活产情况、婴儿出生缺陷等有否区别,尚没有足够的研究证据。本研究通过回顾性分析冷冻卵母细胞和新鲜卵母细胞行ICSI后的受精、卵裂情况及妊娠结局差异,旨在更好地评价卵母细胞冷冻技术在临床应用中的可行性及有效性,以更好地指导临床工作。
资料与方法
一、研究对象
回顾性分析2012年1月至2018年12月在河北医科大学第二医院生殖医学中心利用冷冻卵母细胞进行ICSI-ET治疗的37例患者(共37个周期)的临床资料(观察组)。入组标准:(1)在取卵日男方取精失败或无法获得足够可受精的精子(包括因各种原因取卵日男方不能来院者),同时拒绝供精治疗的患者夫妇;(2)行全部卵母细胞或部分成熟卵母细胞玻璃化冷冻保存,且在此期间解冻移植。采用倾向性评分(PSM)匹配方法按照1∶5匹配(按冷冻MⅡ卵母细胞、年龄、不孕类型、移植日期,卡钳值0.1),从同期在本中心行新鲜卵母细胞ICSI的3 532个周期中筛选出179例患者(共181个周期)为对照组。所有患者纳入标准:(1)促排卵方案均为长方案;(2)周期数≤2周期、获卵数≥2枚;(3)患者移植卵裂期胚胎且移植胚胎数均为2枚。排除标准:合并输卵管积水、子宫内膜异位症、宫腔积液及子宫肌瘤等的患者。
二、研究方法
1.卵母细胞冷冻:取卵后培养2~4 h去除颗粒细胞冷冻MⅡ卵母细胞,采用封闭式载体冷冻,试剂从冰箱取出后平衡20~30 min,将2~3个卵母细胞放入含7.5%乙二醇(EG)和7.5%二甲基亚砜(DMSO)的平衡液中,室温冲洗5遍以上。当卵母细胞出现皱缩再扩张(至少恢复达到80%以上,时间控制在6~8 min)时,移入含15%EG和15%DMSO的玻化液中,冲洗5遍以上,迅速用吸管将胚胎一次性放入冷冻载体上,封管并置入液氮,整个过程不超过70 s,将卵母细胞于液氮中保存。
2.卵母细胞复苏:将含胚胎载体从液氮中取出,迅速置入37℃平衡好的复苏液1(1.0 mol/L蔗糖溶液)中平衡1 min,体视镜下可见胚胎滑落。然后顺序转移至复苏液2(0.5 mol/L蔗糖溶液)室温2 min,复苏液3(0.25 mol/L蔗糖溶液)室温3 min,含10%人血清白蛋白(HSA)取卵胚胎处理液(G-MOPS,Vitrolife,瑞典)的复苏液4室温5 min,并逐渐升温至37℃。在培养液中清洗数遍,最后转移至已平衡过夜的含5%HSA的受精培养液(G-IVF,Vitrolife,瑞典)中,6%CO2培养箱内培养3 h后,对存活卵母细胞行ICSI。
3.卵母细胞存活标准:在显微镜下观察,若卵母细胞外观均匀透亮,无细胞质变性、卵细胞肿胀或固缩,无透明带断裂,则判断为卵母细胞存活;若细胞质变性、固缩、变黑,或有透明带断裂现象,则判定为卵母细胞死亡。
4.不同患者内膜准备:自然周期移植:月经周期规律、排卵正常者采用此周期,在月经第9~10天开始监测卵泡发育及子宫内膜情况,如内膜厚度≤7 mm给予戊酸雌二醇(补佳乐,拜耳,德国)2~4 mg口服,2次/d,卵泡消失日结合血E2水平解冻卵母细胞,行ICSI;同时给予黄体酮(浙江仙琚制药)20 mg肌肉注射,1次/d,第3天优选2枚胚胎移植。移植后行常规黄体支持[黄体酮20 mg肌肉注射1次/d,或黄体酮阴道缓释凝胶(默克雪兰诺,英国)90 mg阴道给药1次/d],B超见心管博动2周后逐渐减量至停止。
人工周期移植:月经第3天给予戊酸雌二醇2~4 mg,2次/d,可根据患者的内膜情况增加用药剂量,待内膜厚度≥8 mm、血E2≥732 pmol/L时给予黄体酮40 mg、60 mg、60 mg、60 mg,每日肌肉注射,于肌肉注射黄体酮40 mg当天解冻卵母细胞行ICSI,第3天优选2枚胚胎移植。移植后行黄体支持(黄体酮60 mg肌肉注射1次/d或黄体酮阴道缓释凝胶90 mg阴道给药1次/d),B超见心管博动后逐渐减量至停止。
5.临床妊娠判断:胚胎移植后14 d检测尿或血清β-HCG水平,尿HCG阳性或血β-HCG>10 U/L定义为HCG阳性;胚胎移植4~5周行B超检查见妊娠囊及原始心管搏动者确定为临床妊娠。
6.观察指标:观察两组的卵母细胞存活率、受精率、卵裂率、可利用胚胎率、临床妊娠率、种植率、流产率、宫外孕率、活产率及出生缺陷情况。卵母细胞存活率=存活卵母细胞数/解冻卵母细胞数×100%;正常受精率(2PN受精率)=2PN受精卵数/ICSI卵数×100%;2PN卵裂率=2PN卵裂数/2PN受精卵数×100%;可利用胚胎率=(移植胚胎数+冷冻胚胎数)/2PN受精卵数×100%;临床妊娠率=临床妊娠周期数/新鲜移植周期数或解冻卵母细胞移植周期数×100%;种植率=孕囊数/移植胚胎总数×100%;流产率=流产周期数/临床妊娠周期数×100%;宫外孕率=宫外孕周期数/临床妊娠周期数×100%;活产率=活产率周期数/胚胎移植的周期总数。
三、统计学处理
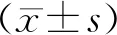
结 果
一、两组患者的一般资料比较
观察组和对照组平均年龄分别为(28.6±4.0)岁和(28.9±3.7)岁,移植卵裂胚数均为2枚。两组间子宫内膜厚度、MⅡ卵母细胞数、平均年龄、原发不孕比例比较均无显著性差异(P>0.05)(表1)。

表1 两组患者的一般资料比较[(-±s),M(Q25,Q75),%]
二、观察组卵母细胞复活情况及两组患者受精、胚胎发育情况比较
观察组共37个周期进行卵母细胞冷冻并解冻后移植,共冷冻361枚卵母细胞,复苏后存活卵母细胞344枚,复活率达95.3%(344/361)。
两组患者的2PN受精率比较无显著性差异(P>0.05);观察组的2PN卵裂率、可利用胚胎率显著低于对照组(P<0.01)(表2)。

表2 两组患者受精及胚胎发育情况比较(%)
三、两组患者的妊娠结局比较
观察组37个周期胚胎移植后,获得20例妊娠,其中1例流产,活产19例,单胎12例,双胎7例(包括1例双胎自然减胎为单胎),已分娩25例健康婴儿,观察组患者无出生缺陷儿。对照组181个周期胚胎移植后,获得95例妊娠,单胎55例,双胎40例(包括1例双胎自然减胎为单胎,另1例双胎分娩1例存活婴儿和1例死婴),1例宫外孕,13例流产(单胎7例、双胎6例),活产81例,已分娩113例活婴,出生随访有1例出生缺陷儿。统计结果显示,两组患者的临床妊娠率、种植率、流产率、宫外孕率及活产率比较均无显著性差异(P>0.05)(表3)。

表3 两组患者的妊娠结局比较(n,%)
讨 论
近10年来玻璃化冷冻卵母细胞技术逐渐成熟,2013年美国生殖医学会提出卵母细胞冷冻保存不再属于实验研究技术,并将其列为成熟的临床应用项目[2]。临床上,生殖领域医生一直比较关注玻璃化冷冻卵母细胞复苏后ICSI的妊娠结局,与新鲜卵母细胞ICSI助孕的妊娠结局有无差别。本研究采用PSM匹配方法,去除年龄、内膜因素、MⅡ卵数、不孕类型、移植日期(年度差异)等因素对妊娠结局的影响;纳入研究的两组患者均采用长方案促排,周期数≤2周期,移植胚胎均为卵裂期胚胎,且移植胚数均为2枚;研究结果显示两组患者的临床妊娠率、种植率、流产率、宫外孕率及活产率比较均无显著性差异。提示冷冻卵母细胞能够达到和新鲜卵母细胞相似的妊娠率及活产率,这和之前的文献报道[3-5]相似。两组患者活产率虽然没有显著性差异,但对照组患者活产率略低于观察组,这可能与对照组受促排卵周期的影响,子宫内膜被高水平雌激素影响有关,故流产率稍高,活产率略低,但尚需后续加大样本量进一步证实。本研究中观察组患者获得了较好的周期临床妊娠率(54.1%)和活产率(51.4%),进一步证实卵母细胞玻璃化冷冻确实是一种较好的生育力保存方法,可应用于取卵日男方因各种原因不能提供精子的女性患者[5-6],如取卵日男方取精困难、取不到精子或特殊情况不能来院者,可将取出的卵母细胞冷冻保存。同时可应用于因卵巢功能早衰积攒卵母细胞的患者,以及行放疗或化疗等可能影响卵巢功能的患者,可在放疗或化疗前将患者的卵母细胞取出冷冻保存,保存其生育力。
本研究中玻璃化冷冻卵母细胞的复活率95.3%,高于Sole等[7]报道的卵母细胞复苏率85.6%,也高于另两位学者的报道[8-9],和Cobo等[10]报道的复活率(96.7%)相似。玻璃化冷冻卵母细胞成功的关键是必须保证较高的卵母细胞存活率,这就要求在工作中应严格把握卵母细胞冷冻技术的关键环节,进一步改进冷冻载体及冷冻方法。卵母细胞玻璃化冷冻复活率相对于本生殖中心玻璃化冷冻胚胎复活率(99.41%)[11]较低,其原因在于卵母细胞是人体最大的细胞,胞膜和胞浆比例相对较小,卵膜渗透性差,细胞脱水不充分。因此,实验室操作时应注意几个关键步骤:在玻璃化冷冻卵母细胞时在平衡液中要充分平衡6 min或以上,即可见卵母细胞皱缩后扩张,一定在扩张达到80%以上,再移入下一步玻化液中,尤其卵母细胞质量差可适当延长在平衡液中的时间;而移入玻化液、装载胚胎和投入液氮的总时间应控制在60~70 s;同时在解冻卵母细胞时要将液氮中含有卵母细胞的载体迅速置入37℃平衡好的复苏液1(1.0 mol/L蔗糖)中,这是解冻的关键,其余复苏液2、3、4为室温下操作,当卵母细胞移入4号液后即逐渐升温至37℃,以避免卵母细胞内冰晶再形成,从而造成卵母细胞损伤甚至崩解死亡。
本研究中观察组和对照组的2PN受精率分别为85.8%和82.4%,二者比较无显著性差异;而观察组的2PN卵裂率及可利用胚胎率显著低于对照组,该结果与之前文献报道[12-13、4]略有不同,可能与玻璃化冷冻对卵母细胞有不利影响有关,成熟卵母细胞处于减数分裂中期,对温度、理化因素非常敏感,冷冻过程可能存在卵母细胞的细胞骨架轻度损伤如皮质颗粒变化、线粒体丢失等[14],虽然不影响卵母细胞受精和胚胎最终的发育结局,但部分影响了卵细胞的分裂,少部分胚胎存在细胞分裂速度慢等,继而影响可移植胚胎数等。提示我们在临床工作中能冷冻胚胎要优先选择冷冻胚胎,而不是优先冷冻卵母细胞[15];但玻璃化冷冻卵母细胞作为胚胎冷冻的补充,可以避免取卵日因取精不成功而造成女性生育资源的浪费和经济损失,在生育力保存方面起着不可替代的作用[16-17]。
卵母细胞玻璃化冷冻复苏后妊娠分娩的子代安全情况也是生殖领域比较关注的一个方面。Levi-Setti等[18]对意大利冷冻卵母细胞助孕出生的2 152例婴儿进行随访分析,结果显示新生儿先天异常的发生率为0.9%,表明玻璃化冷冻卵母细胞并不增加婴儿出生缺陷[19-20]。本研究中观察组37个周期共出生婴儿25例,随访均健康且无智力水平的差异,无出生缺陷婴儿;对照组共出生113例婴儿,1例21三体嵌合婴儿。提示冷冻卵母细胞技术是较成熟的技术,并未增加婴儿出生缺陷的风险。但由于本研究样本量小,尚需后续增大样本量进一步证实。至于卵母细胞冷冻是否会对子代健康产生远期影响有待于以后多中心大样本的前瞻性研究和长期跟踪随访加以探讨。
本研究中两组患者均移植2枚第3天的卵裂期胚胎,多胎率较高。为了预防双胎引起早产,保障母婴安全,今后的工作中应尽量采取第3天单胚胎移植或囊胚培养后行单囊胚移植,以降低多胎率。
综上所述,玻璃化冷冻卵母细胞可获得较高的复苏率,且复苏后行ICSI能达到和新鲜卵母细胞ICSI相似的受精率和妊娠结局,虽然其卵裂率和可利用胚胎率略有下降,但并不影响最终的妊娠结局;且并不增加婴儿出生缺陷发生风险。因此,对于取卵日男方因各种原因不能提供精液的女性患者,卵母细胞玻璃化冷冻是一个较好的生育力保存方法。
