激光联合氟钾酚醛树脂对牙本质小管封闭作用的实验研究
2020-09-28孙慧斌李泽雨孙莉青
王 芳,孙慧斌,李泽雨,孙莉青

本研究拟通过扫描电镜观察激光联合氟钾酚醛树脂脱敏剂对牙本质小管的封闭效果,是否具有更好的封闭性能及抗洗刷能力,为临床激光联合氟钾酚醛树脂脱敏剂的推广应用提供理论依据。
1 材料与方法
1.1 主要材料与仪器
氟钾酚醛树脂脱敏剂(自制)[4],95%乙醇(利尔康,中国山东),100%脱水乙醇(利尔康,中国山东),单面金刚砂片(MANI,日本);低速手机(NSK EX-203C,日本 )、超声波清洗机(宁波蓝野)、Oral-B3757 电动牙刷、激光治疗仪(Fotona,德国)、 VEGA3 TESCAN 扫描电镜(德国)、EM-DSC30真空干燥器(JEOL,日本)、高真空离子溅射镀膜仪(Eiko,IB-3,EIKO公司,日本)。
1.2 牙本质模型制备
收集新鲜拔除的无龋坏、无缺损第三磨牙48颗, 去净根周附着物,超声震荡清洗2 min,蒸馏水冲洗后用于制备牙本质敏感模型[17]。用低速金刚砂磨片垂直于牙体长轴方向、于釉牙本质界下1~4 mm处切取2.5 mm厚的牙本质片,制备成3.0 mm×3.0 mm×2.5 mm大小的标准牙本质块,水磨砂纸磨平抛光远髓断面。 60 g/L 柠檬酸处理 2 min,去离子水反复冲洗,超声震荡清洗5 min 去除牙本质表面的碎屑等玷污层,存放在37 ℃的生理盐水中。
1.3 样本处理
实验分为 4组:A组为空白对照组,不做任何处理;B组为氟钾酚醛树脂组(FR),用无菌小棉球蘸取氟钾酚醛树脂脱敏剂于牙本质片上反复涂抹30 s,将65 ℃~70 ℃的金属楔热器械末端置于小棉球上加热2 s,重复操作3次,静置20 min后擦干; C组为激光处理组,手持 XD-2激光(Fotona,德国)手机垂直标本脱敏面保持1 mm距离均匀扫照标本30 s,参数设定为:1.0 W,20 Hz,占空比为1/4;D组为激光联合氟钾酚醛树脂脱敏剂组,先用氟钾酚醛树脂脱敏剂处理牙本质片表面(方法同B组),再用激光照射(方法同C组)。 后3组样本每组随机选择6个作为即刻组,其余6个作为磨损组,进行刷牙实验[18-19]磨损组标本固定于硅橡胶中,脱敏面朝上,使用 Oral-B电动牙刷对牙本质标本脱敏面进行刷牙磨耗试验,每次2 min,每天2次,持续8 d(相当于手动刷牙平均120 次/min,每次3 min, 2 次/d,连续使用约3年),随后用去离子水冲洗30 s。每次操作完成后将标本浸泡于37 ℃ 生理盐水中,生理盐水每天更换1次。
每组随机选择3个标本,沿牙体长轴方向劈开,用于观察纵剖面。
1.4 扫描电镜观察
将所有标本依次放置于25%、50%、75%、95%、100%乙醇中浸泡15 min,自然干燥2 d;真空干燥器中抽真空、干燥,高真空镀膜仪喷镀金膜;扫描电镜观察所有样本牙本质小管表面的封闭情况及纵剖面的封闭深度。
1.5 图像分析
分别于2 000 、5 000倍扫描电镜下获取图像,使用Image-Pro Plus 6.0 图像分析软件测量分析牙本质小管口表面的封闭情况及纵剖面封闭剂的渗透情况。该软件可通过图片颜色变化自动分辨牙本质小管边界,选中小管开放区域,测量开放的总面积,从而计算开放牙本质小管口的相对面积,分析牙本质小管口的封闭情况。对于纵剖面,根据比例尺矫正软件标尺,可直接划线测量牙本质小管内封闭的深度。
1.6 统计学方法
采用 SPSS 24.0 统计软件对数据进行ANOVA方差分析, LSD法进行两两比较。每组组内比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组标本表面形态
A组空白对照组:牙本质表面光滑,形态清晰,小管口完全开放(图1a) 。B组FR处理组:牙本质小管口大部分被堵塞,表面有部分凹坑状和凝固的脱敏液堆积 (图1b),磨损后牙本质小管口大部分仍处于封闭状态,部分小管口呈凹坑状(图2a)。C组激光处理组:牙本质表面封闭均匀致密,个别小管口未完全封闭(图1c),磨损后部分原来封闭的区域重新开放,堵塞物变薄(图2b) 。D组联合组:牙本质表面致密均匀,牙本质小管全部被堵塞(图1d),磨损后牙本质表面致密均匀,几乎无小管开放(图2c) 。

a:空白组;b:氟钾酚醛树脂组;c:激光组;d:联合组

a:氟钾酚醛树脂组;b:激光组;c:联合组
2.2 各组标本纵断面牙本质小管的封闭深度
A组:牙本质小管完全开放,形态清晰,小管内表面光滑清洁(图3a) 。B组:脱敏液渗入牙本质小管深度较深((15.68 ±0.98)μm),部分与小管壁结合,部分呈颗粒状或片状散落在牙本质小管内 (图3b) 。磨损后与磨损前无差异(P>0.05,图4a) 。C组:表面牙本质熔融,呈晶体状,无小管结构,熔融深度为(8.19 ±0.56)μm(图 3c) 。磨损后表面牙本质熔融层变薄,封闭深度与磨损前有差异(P<0.05,图4b) 。D组:牙本质表面呈熔融状,深层有脱敏液渗入的颗粒或片状物,且深度较深((15.45±1.17) μm,图3d)。磨损后熔融堵塞的深度变小,深层仍有脱敏液渗入, 与磨损前无差异(P>0.05,图4c)。

a:空白组;b:氟钾酚醛树脂组;c:激光组;d:联合组

a:氟钾酚醛树脂组;b:激光组;c:联合组
2.3 各即刻组封闭效果的比较
开放的牙本质小管口的相对面积比较(表1):B、C、D 3组与空白组比较均有统计学差异(P<0.05)。B组与C组相比无显著差异(P>0.05),D组表面完全封闭,与B、C组比较均有统计学差异(P<0.05)。纵剖面牙本质小管封闭深度的比较(表2):B组脱敏液渗透深度大于C组牙本质熔融深度(P<0.05),D组封闭深度大于C组,与B组之间无差异(P>0.05)。

表1 即刻组表面开放牙本质小管口相对面积的比较Tab.1 Comparison of the relative area of surface open dentin tubules in the immediate group
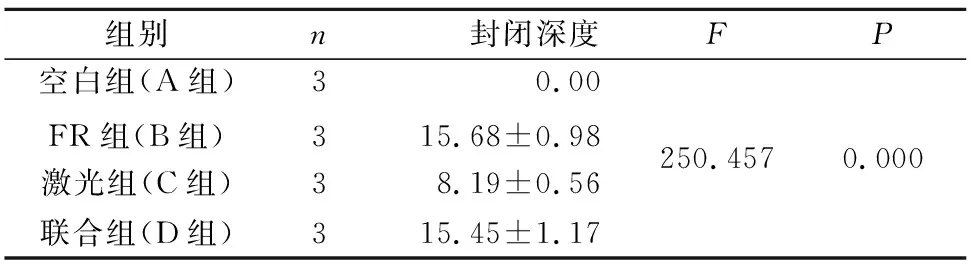
表2 即刻组纵剖面牙本质小管封闭深度的比较Tab.2 Comparison of closure depth of dentin tubules in longitudinal section of immediate group μm
2.6 刷牙磨损后各组封闭效果的比较
磨损后表面开放的牙本质小管的相对面积比较见表3:B组开放牙本质小管的相对面积少于C组,因此封闭性优于C组;D组开放的牙本质小管口的相对面积小于B组和C组,封闭性最好,三者之间均有统计学差异。磨损后纵断面牙本质小管的封闭深度的比较见表4:B组磨损后脱敏液渗入牙本质小管深度大于C组熔融封闭深度(P<0.05),D组封闭深度为大于C组封闭深度,D组与B组之间无统计学差异(P>0.05)。
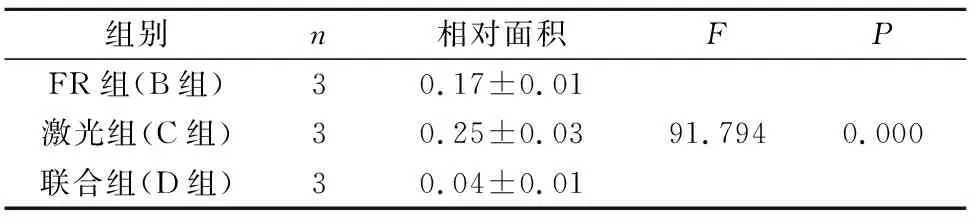
表3 磨损组表面开放牙本质小管口相对面积的比较Tab.3 Comparison of the relative area of surface open dentin tubules in the wear group
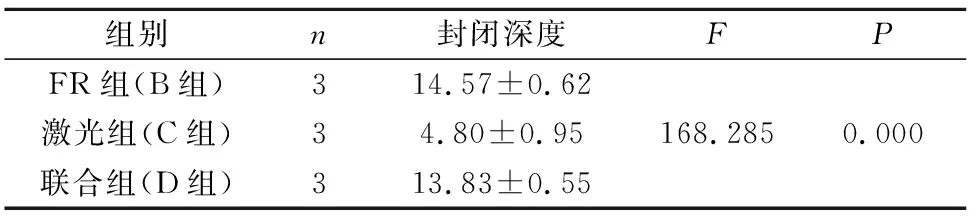
表4 磨损组纵剖面牙本质小管封闭深度的比较Tab.4 Comparison of closure depth of longitudinal section dentin tubules in wear group μm
2.7 刷牙磨损后各组组内封闭效果的比较
刷牙磨损前后组内比较,C组磨损前后,表面开放的小管相对面积和封闭深度均有统计学差异(P<0.05),B、D两组磨损前后开放小管的相对面积和封闭深度均无统计学差异(P>0.05)。
3 讨 论

目前对于牙本质敏感的治疗,主要基于封闭牙本质小管和降低神经兴奋性两个方面[20]。相应的方法很多,其中药物脱敏和激光治疗一直是口腔医生比较关注的两种方法。应用于脱敏的药物大都是通过堵塞或封闭牙本质小管达到脱敏的目的,但很多药物脱敏都不能持久,可能是药物脱敏剂只在牙本质小管浅层形成沉淀,这些沉淀并不能深入牙本质小管深部,并且在受到刷牙等机械性磨损后,易被磨除,导致牙本质小管重新开放。本研究FR组应用氟钾酚醛树脂脱敏剂封闭牙本质小管,酚醛树脂聚合后能形成塑料保护层,并渗入牙本质小管深处,以封闭牙本质小管。氟钾酚醛树脂脱敏剂,是在酚醛树脂基础上加入了氟化钾, 临床研究表明其耐磨性强,是治疗牙本质过敏症的有效方法[4]。
在本研究中,使用氟钾酚醛树脂脱敏剂后,表面观察牙本质小管大部分封闭,开放小管的相对面积只有 0.16±0.03,与空白组比较差异有统计学意义(P<0.05), 表面未完全封闭的牙本质小管呈凹坑状,脱敏剂渗透不均匀。同时,纵剖面观察,脱敏剂渗入牙本质小管内,部分与小管壁紧密结合,降低牙本质小管的通透性,大部分呈颗粒状或片状散在分布于牙本质小管内,这些颗粒状和块状物应为氟离子与钙盐结合形成的氟磷灰石、氟化钙或类似氟化钙晶体的沉积物[21]。堵塞物与根管壁并不十分紧密结合的原因可能与劈裂牙本质标本时,凝固的氟钾酚醛树脂碎裂有关。通过Image-proplus 6.0 图像软件测量分析,氟钾酚醛树脂渗入牙本质小管的深度大于激光组表面牙本质熔融深度。脱敏剂渗入牙本质小管内的深度与脱敏剂的耐磨性有关,经过刷牙实验后,FR组的封闭深度与激光组相比,也有统计学差异,由此可见,氟钾酚醛树脂脱敏剂组,具有较好的耐磨性。原因是氟钾酚醛树脂脱敏是药物渗入,并没有改变正常牙本质结构。
目前用于牙本质脱敏的激光种类繁多,本研究所使用的是半导体激光。有学者认为半导体激光的脱敏机制应该是该类激光可在对牙体组织最小热损害的前提下,通过产生的热效应使牙本质表面瞬间熔融、再结晶,封闭牙本质小管[22]。本研究激光组的牙本质表面熔融层类似混合层,无正常牙本质结构,熔融厚度约8 μm。 小管几乎全部被堵塞,开放小管相对面积约0.11±0.04,这与临床上观察到的3个月内较好的脱敏效果一致[23]。纵剖面看近表面牙本质熔融堵塞深度较FR组小(P<0.05)。磨损组显示部分封闭的牙本质小管呈针孔样开放,堵塞物变薄,堵塞物有部分塌陷,开放小管口相对面积2.5±0.03,与磨损前对比有显著性差异;纵剖面显示,牙本质熔融层变薄,熔融深度与磨损前比较有统计学差异(P<0.05),进一步说明其耐磨性欠佳。
近年来,激光联合药物进行脱敏的方法备受关注。激光与药物联合应用,一方面能使牙本质小管熔融和封闭,另一方面又能增加药物的渗入深度,产生协同堵塞作用,形成互补优势,能起到双重脱敏的作用。Lee 等[24]研究证实:Nd:YAP 激光与生物玻璃联合应用可以产生叠加效应,能更好地封闭牙本质小管。褚备[25]应用半导体激光联合75%氟化钠甘油脱敏剂脱敏,其即刻、1个月、3个月的有效率明显高于对照组。
在本实验中,激光联合氟钾酚醛树脂脱敏组如图1d所示,电镜下可观察到全部牙本质小管都被均匀封闭,牙本质小管全部被堵塞,牙本质表面的熔融状封闭的形态与激光组类似,但开放的牙本质小管的相对面积均小于B组和C组,证实联合组封闭效果更佳,产生协同堵塞作用,克服了脱敏剂表面堵塞不均匀的缺点;纵剖面看,近表面约8 μm厚牙本质呈熔融状,无小管结构,深层有塑化液渗入的颗粒或片状物,且深度较长((15.45±1.17)μm), 克服了激光组封闭深度较小的缺点,与FR组相比差异并不显著(P>0.05),二者均明显深于激光组(P<0.05),并且在牙本质表面散在有晶体结构,我们认为这些晶体是脱敏剂被激光产生的高温并与熔融的牙本质相结合而产生。刷牙磨损后,仍保持良好的封闭状态,仅有极小部分牙本质小管开放,呈针尖样或缩窄,开放小管相对面积为0.04±0.01,与磨损前相比无差异,组间比较显示,D组与B、C组均有统计学差异,显示出了更好的耐磨性;纵剖面观察表面牙本质呈熔融状,无小管结构,熔融的深度较磨损前变小,深层仍有脱敏液渗入的颗粒或片状物,且深度较深((13.83±0.55)μm), 与磨损前比较无统计学差异,保持了氟钾酚醛树脂组耐磨性较好的优势;组间比较显示,D组与C组有统计学差异,提示联合组耐磨性更好,激光组耐磨性差的原因一方面是激光熔融的深度较浅,另一方面可能是激光照射脱敏使牙本质表面熔融再结晶,破坏了正常牙本质的结构。Camerlingo 等通过拉曼光谱和扫描电镜观察发现,激光作用后牙本质表面的物理和化学结构均有一定程度的改变[26]。而B组是氟钾酚醛树脂脱敏的渗入,并没有改变正常牙本质结构,且渗入较深,具有较好的耐磨性。二者联合应用,既保留了激光熔融封闭均匀的优势,克服了脱敏液不能均匀封闭的缺点,又保留了脱敏剂渗入较深,具有较好耐磨性的优势,克服了激光熔融封闭较浅、耐磨性差的的缺点,因此,先用脱敏剂处理牙体表面,再用激光照射,对牙本质小管的封闭作用要优于单用脱敏剂或单用激光,且更持久耐磨。
本实验参考黄燕华等[18]、董鑫等[19]的实验设计,空白组未做刷牙磨损试验,主要是本研究的目的是通过扫描电镜观察刷牙实验前后氟钾酚醛树脂脱敏剂(fluorine potassium phenolic resin desensitizer,FR)、激光、激光联合氟钾酚醛树脂脱敏剂对牙本质小管的封闭情况。实验中空白组未做任何脱敏处理,牙本质小管是完全开放的,没有任何封闭或堵塞,故刷牙磨损前后表面形态和纵剖面的零封闭状态都没有变化,所以未做刷牙磨损实验。即刻组设有空白组的原因是为了说明在统一的牙本质敏感模型下空白对照组牙本质小管完全开放,管内空洞无物,符合牙本质过敏症的形态学特征,适合扫描电镜用于观察样本微细结构。
综上,激光与药物的联合应用是治疗牙本质敏感的较好选择,它克服了单一脱敏方法的不足,通过协同作用获得了更好、更为持久的疗效,可在临床上推广使用。
