肝切除术作为Bismuth Ⅳ型肝门部胆管癌根治性切除术首选方法的探索
2020-09-28王学文吴燕彬牛洪凯孔令群
王学文,李 晗,吴燕彬,牛洪凯,孔令群,成 雨
滨州医学院附属医院 肝胆外科,山东 滨州 256600
肝门部胆管癌(hilarcholangiocarcinoma,HCCA)是在肝总管分叉处由胆管上皮引起的恶性肿瘤,占所有胆管癌的50%~60%[1-2]。目前,国内外唯一被公认的临床方法是根治性手术切除[3-4]。Bismuth Ⅳ型被定义为肿瘤累及左右两侧肝管,长期以来被认为是无法手术根治性切除的肿瘤[5]。但在过去的几十年中,随着医疗技术的发展,手术切除被认为是Bismuth Ⅳ型胆管癌治疗的主要方式[6-7],但具体的手术方式尚未达成共识。本研究将肝切除术作为Bismuth Ⅳ型胆管癌根治性切除的首选方法,对其临床疗效进行观察。
1 资料与方法
1.1 研究对象 回顾性分析滨州医学院附属医院肝胆外科2014年1月-2018年12月11例Bismuth Ⅳ型HCCA患者的临床资料,所有患者均行肝切除术,手术均由同一组医师完成。11例患者中男7例,女4例,平均62(40~80)岁;术前胆红素水平为368.8(192.3~562.0)μmol/L。术前对胆红素水平>400 μmol/L 和Child分级B级以上的3例患者行经皮肝穿刺胆道引流术减黄。同时给与对症支持治疗,使其术前肝功能恢复到Child C级以下。行彩超、CT等辅助检查对肿瘤情况进行详细评估。本研究方案经由滨州医学院附属医院伦理委员会审批。
1.2 手术方法 术前利用IQQA手术模拟系统及吲哚菁绿清除实验评估术前肝脏功能(图1)及切除方案,如果肿瘤超过保留侧胆管分离极限点则放弃手术。常规消毒铺巾,以右上腹肋缘下为切口依次进腹,首先探查肝脏是否有转移,有无腹水、血管浸润、远处转移等,对能否行肝切除术进行详细的评估。在十二指肠上2 cm横行离断胆总管,进一步解剖胆总管,显露肝动脉和门静脉,游离肝右动脉和门静脉右支,若肿瘤浸润可联合血管切除重建,同时阻断肝左动脉和门静脉左支;上述步骤完成后,沿肝脏缺血线、肝中静脉于左侧离断肝实质,直至下腔静脉前壁,结扎并切断肝左静脉;在右半肝实质内距肿瘤0.5 cm切断二级以上胆管,从上到下将肿瘤连同左半肝、尾状叶及肝十二指肠韧带内容物(除外肝右动脉和门静脉右支)一并切除,十二指肠上缘切除胆总管,两切缘送快速病理;最后右半肝内2-4支胆管整形后与空肠吻合(图2)。
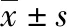
2 结果
所有患者均行肝切除术,即包括肿瘤连同左半肝、尾状叶及肝十二指肠韧带内容物(除外肝右动脉和门静脉右支)一并切除,十二指肠上缘切除胆总管,其中3例患者接受了部分血管切除和重建,2例患者在没有重建的情况下进行了肝动脉切除术。探查11例患者的肿瘤直径,平均为24.3(16.0~36.0)mm。手术时间平均为251(200~350)min,手术过程中出血量平均为286(150~550)ml(表1)。
手术1周后,患者黄疸现象明显减轻,复查肝功能,AST为65(35~100)U/L, ALT为69(42~107)U/L,TBil由术前的368.8(192.3~562.0)μmol/L下降到25.2(15.1~45.3)μmol/L。11例患者中2例出现术后并发症,1例出现短暂的吻合口渗漏,另1例出现小肝综合征。2例患者均经保守治疗后好转。11例患者术后平均住院时间为14.5(12.0~28.0)d。通过术中快速病理结果显11例患者手术切缘均无肿瘤细胞,均可行R0切除;肿瘤的病理组织分型包括高分化腺癌4例,中分化腺癌3例,低分化腺癌3例,乳头状腺癌1例(表2)。
根据Karnofsky评分标准,所纳入患者的Kamofsky评分为86(70~100)分,虽然患者有一些症状和体征,但能进行正常活动。术后进行随访,平均随访时间为23(6~42)个月,1例患者在广泛转移6个月后死亡,另1例患者在19个月后因肝内转移而死亡。其余9例患者术后平均随访25.3个月,无任何复发迹象。术后平均生存时间23个月(表2,图3)。

表1 11例患者的手术资料
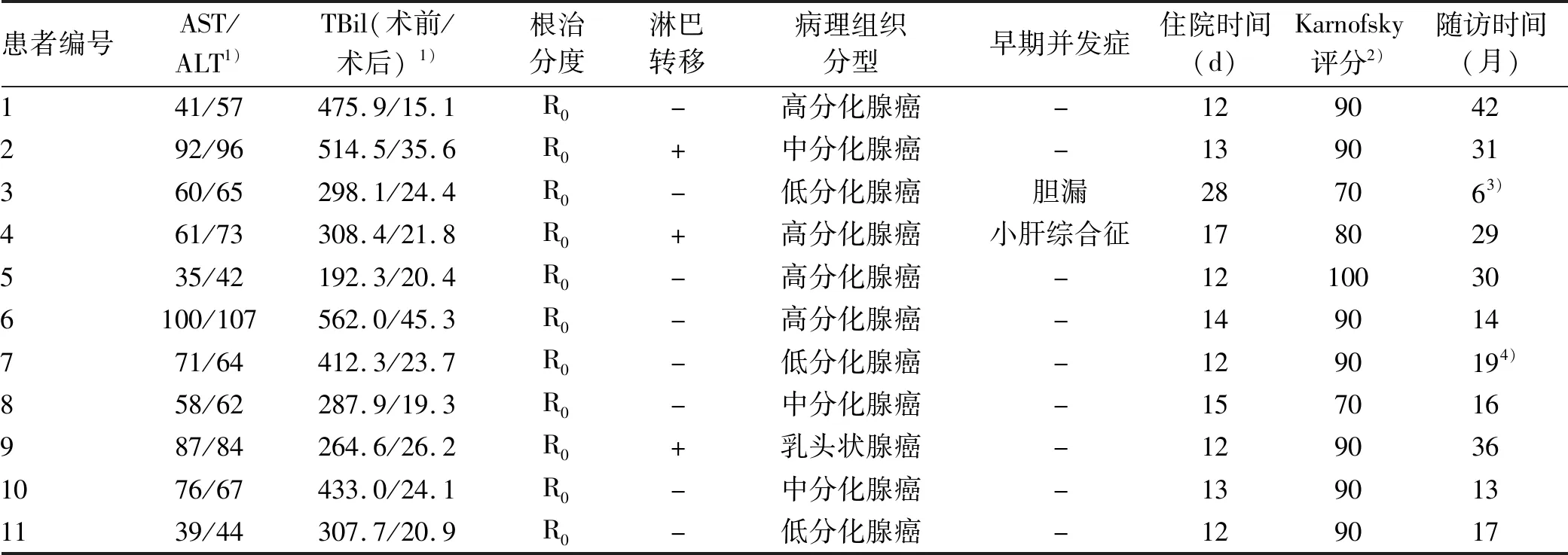
表2 11例患者的术后资料
3 讨论
胆管癌主要分为肝内胆管癌、远端胆管癌以及HCCA,其中HCCA发病率最高,可达50%~60%,且发病率呈逐年上升趋势[1,8]。在HCCA中高达90%的患者表现为无痛性黄疸,10%可能有急性胆管炎的症状[9]。由于HCCA发现时大多处于晚期,只有35%的患者可以手术切除[10]。Bismuth Ⅳ型HCCA因肿瘤累及左右肝内二级胆管,之前一度被认为无法进行手术切除。近期的Meta分析显示[11],手术切除Ⅳ型胆管癌可改善患者存活率,是治疗该病的有效选择。本研究收治Bismuth Ⅳ型患者11例,治疗体会如下。
首先,详细的术前评估尤为重要,评估HCCA切除可行性的内容主要有以下4个方面。(1)确定肿瘤的解剖位置和浸润范围。目前对于HCCA的诊断主要包括超声、多螺旋CT、核磁共振、MRCP等影像学检查联合肿瘤标志物,并且常在术前进行腹腔镜探查明确腹腔情况[12]。多排螺旋 CT对HCCA的诊断率达75%~92%,已成为术前评估HCCA的标准影像学手段[13-14]。MRI及磁共振胰胆管造影(MRCP)也成为评估肿瘤扩展和相关血管受累的常用方法[10]。(2)评估胆道的梗阻水平。据报道[15]术前胆道引流可以减少黄疸和术后并发症,提高术后肝脏的再生能力。黄志强院士[16]认为对血清TBil水平超过400 μmol/L的患者实行大范围肝切除手术前应进行术前减黄治疗。按照Tang等[15]荟萃分析的结论,对3例患者行经皮肝穿刺胆道引流术引流,术后均未出现胆管炎的症状。(3)对剩余肝功能储备进行预评估。术后剩余肝脏体积不足是导致肝衰竭的主要原因,对于黄疸患者术后剩余肝脏体积不应小于总体积的40%[17-18]。有研究[19]认为门静脉栓塞技术可增加肝脏体积来降低肝衰竭的风险,但其存在术前等待时间延长等缺点,目前其应用仍存在一定的争议。IQQA-Liver自动分析软件能够快速测得较为精确的肝脏体积[20]。本研究运用IQQA软件精确、直观地评估出了残余肝脏的体积,术后仅1例患者出现了小肝综合征,保守治疗后好转,避免了术后肝衰竭的发生。(4)判断是否具有远处转移。有学者[21]研究在接受R0切除的患者中,无淋巴结转移的患者5年总生存率超过67%,而有淋巴结转移的患者5年总生存率下降到22.1%。本研究随访中1例患者于术后6个月广泛转移死亡,另1例在19个月后因肝内转移而死亡,提示术前是否可以行PET-CT检查排除远处转移的患者。
其次,R0切除是影响患者预后的重要风险因素。根治性切除(R0切除) 指的是切缘两端肉眼和镜下均无肿瘤残留,是提高HCCA长期生存率的关键[22]。目前许多学者认为半肝切除或扩大半肝切除可以整块切除肿瘤浸润的肝组织从而提高HCCA的R0切除率[23]。最近Hong等[24]通过对326例HCCA患者比较发现,左半肝切除组术后腹水等术后并发症较右半肝组少,在适当的肿瘤位置情况下建议左半肝切除作为首选的手术方式。HCCA患者中尾状叶受侵犯的概率为31.0%~98.0%,而且术后复发也常在尾状叶发生[25]。Gazzaniga等[26]研究发现患者行尾状叶切除,5 年的总体生存率可达25%,相反未行尾状叶切除组的患者5年总体生存率为0。本研究11例患者均采用左半肝联合尾状叶切除的术式,无术后肝衰竭的发生,进一步证实了Lu等[27]认为该术式安全可行的观点。
最后,精细的手术操作是影响术后并发症的主要因素。Bismuth Ⅳ型HCCA容易侵犯肝动脉和门静脉血管,对术者的手术操作技巧提出了较高的要求,需要其仔细分离组织结构,必要时进行血管的切除与重建。血管的切除重建可以提高根治性切除率,但在总体存活率及术后并发症方面仍存在着争议。一项对201例HCCA患者的多机构研究发现[28],接受血管对HCCA患者行血管切除重建可明显延长其生存期。而另有文献[29]表明,行门静脉切除重建者的长期生存率与未行血管切除重建者相似。本组中2例患者术中接受了肝动脉的切除,1例接受了肝动脉切除后重建,另外有2例行门静脉切除重建,术后随访均无瘤残留,仅有肝动脉切除重建的患者出现了小肝综合征的相应症状,治疗后好转。本组认为联合血管切除重建,在提高R0切除的同时可以改善患者总体生存率。此外手术最后的胆肠吻合对术者的操作也提出了一定的要求,有报道[30]称,胆肠吻合术后可发生11%左右的胆道感染概率,因此术者需根据术中情况仔细吻合,防止胆漏的发生。
总之,肝切除术可以作为Bismuth Ⅳ型HCCA治疗的首选方式。详细的术前评估、精细的术中操作,完善的术后处理,不仅能够实现Bismuth Ⅳ型HCCA的根治性切除而且可以提高患者的治愈率、延长总体生存率、改善患者生存质量。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:王学文、成雨、李晗、吴燕彬负责课题设计,资料分析,撰写论文;牛洪凯、孔令群参与收集数据,修改论文;王学文、成雨负责拟定写作思路,指导撰写文章并最后定稿。
