肝硬化合并门静脉血栓患者外周血血管内皮生长因子的检测及意义
2020-09-28姚运海朱京乐甘建和赵卫峰
姚运海,罗 艳,朱京乐,甘建和,赵卫峰
1 苏州大学附属第一医院 感染科/肝病ICU,江苏 苏州 215006; 2 湖南省妇幼保健院 医务部,长沙 410007
门静脉高压及其并发症是失代偿期肝硬化的主要临床表现,门静脉血栓(portal vein thrombosis,PVT)也是门静脉高压的常见并发症,发生率为10%~25%[1]。肝硬化患者PVT形成的临床表现从无症状期到危及生命表现不一,多在随访期间行影像学检查发现,其发生机制复杂,但并不认为低凝状态是其高发的高危因素,目前肝硬化PVT形成的诊断与治疗管理尚未有共识。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种内皮细胞特异性有丝分裂原,在肝硬化组织中高表达[2],诱导微血管生成,其水平高低与PVT发生相关[3]。本文为求探索一种简便、无创的检测指标,便于早期准确诊断PVT发生情况。
1 资料与方法
1.1 研究对象 选取2017年1月-2019年12月在苏州大学附属第一医院门诊随访或者住院的肝硬化合并PVT患者60例(PVT组),同期肝硬化合并门静脉高压无血栓形成者161例(LC组)。所有入组患者均需符合2019年中华医学会制定的《肝硬化诊治指南》[4],PVT组需彩色多普勒、CT、MR或者血管造影等检查首次发现明确诊断。入组221例肝硬化患者中有36例患者因食管胃底静脉曲张破裂出血行经颈静脉肝内门体分流术(transjugular intrahepatic portosystem stent-shunt,TIPS)治疗,术中测量肝静脉压力梯度(hepatic venous pressure gradient,HVPG)。排除血液系统疾病、恶性肿瘤癌栓、腹腔感染、布加综合征等可能导致的PVT。
1.2 观察指标 收集患者入院时的临床资料,包括性别、年龄、WBC、PLT、TBil、ALT、Alb、PT、INR、AT-Ⅲ水平等,根据实测值进行Child-Pugh分级。
1.3 双抗体夹心原理酶联免疫吸附法检测血清VEGF水平 在微孔板中预包被VEGF单克隆抗体等,再加入酶标抗体工作液(辣根过氧化物标记的VEGF单克隆抗体)和显色剂TMB,通过酶标仪检测吸光度(A值)从而判断样品中VEGF水平。
1.4 伦理学审查 本研究经由苏州大学附属第一医院伦理委员会批准(审批号:156号),所有患者家属签署过知情同意书。
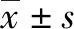
2 结果
2.1 一般资料 PVT组与LC组患者基线指标比较,血清VEGF水平有明显差异(P<0.05),其他指标差异均无统计学意义(P值均>0.05)(表1)。
2.2 2组患者血清VEGF水平在不同Child-Pugh分级中比较 结果显示,不论是Child-Pugh A级还是Child-Pugh B、C级,PVT组与LC组患者血清VEGF水平比较,差异均有统计学意义(P值均<0.05)(图1)。
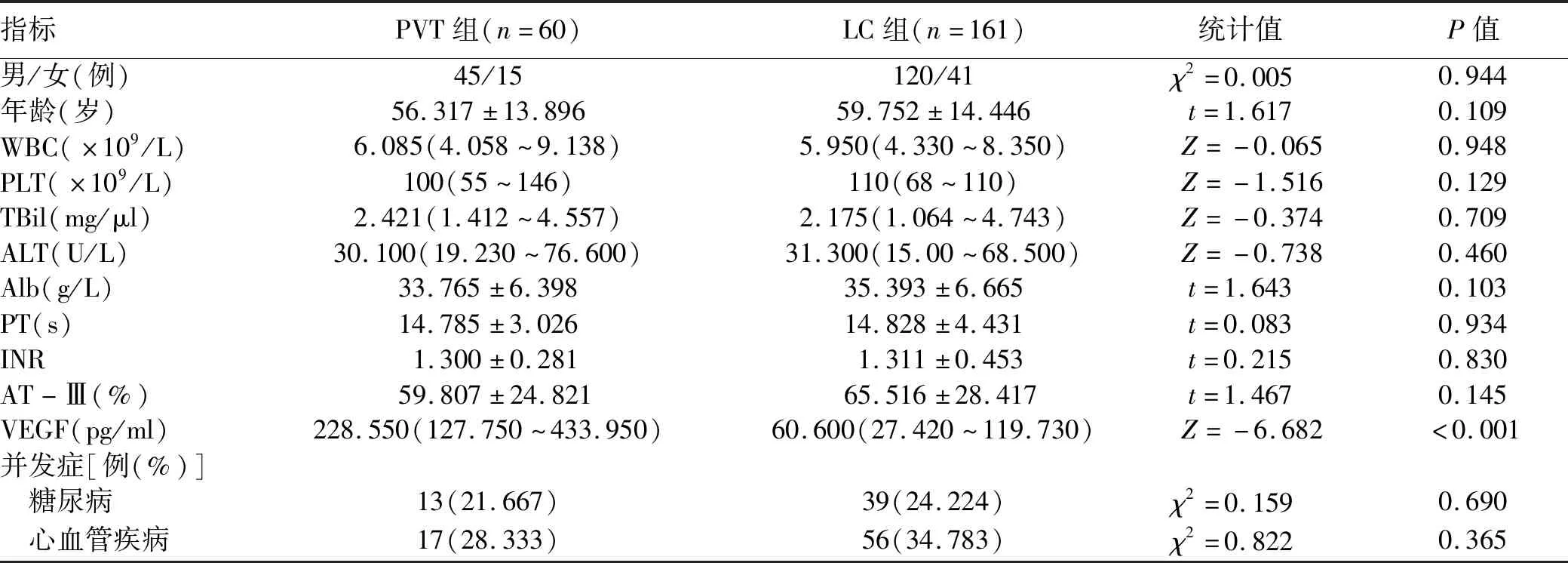
表1 PVT组与LC组患者一般资料比较
2.3 血清VEGF水平与HVPG的相关性 36例肝硬化合并食管胃底静脉曲张破裂出血患者的HVPG检测值为(24.444±5.578)mm Hg。相关性分析显示,VEGF水平与HVPG呈正相关(r=0.593,P<0.001)(图2)。
2.4 logistic回归分析肝硬化合并PVT的危险因素 单因素分析显示,性别和VEGF是肝硬化合并PVT的影响因素(P值均<0.05)(表2)。将单因素分析中有统计学意义的变量进行二分类logistic回归分析,结果显示只有VEGF水平为肝硬化合并PVT的独立危险因素(OR=1.004, 95%CI: 1.003~1.006,P=0.013)。
3 讨论
门静脉高压和侧支循环形成是失代偿期肝硬化的特点,PVT形成是晚期肝硬化的常见并发症[5],血管生成与肝内外因素均有关,在肝脏内,血管生成促进肝纤维化,从而促进门静脉高压,在肝脏外,与侧支循环形成也有相关性[3]。VEGF又称血管通透因子,是一种高度特异性的促血管内皮细胞生长因子,具有促进血管通透性增加、细胞外基质变性、血管内皮细胞迁移、增殖和血管形成等作用[6]。研究[7]显示,VEGF水平升高与慢性肝病及肝细胞癌之间有密切关系。
本研究显示,PVT组与LC组相比,外周血VEGF水平明显升高(P<0.001),且在Child-Pugh A级、Child-Pugh B及C级中,PVT组均较LC组有明显差异(P值均<0.05)。既往在肝硬化患者中的研究显示,其外周血VEGF高于健康人群,而VEGF增加可能与其并发症发生有关[8],可能的解释是慢性肝病的慢性炎症刺激肝星状细胞和窦状内皮细胞局部释放血管生成因子[9]。在本研究中,有36例患者因食管胃底静脉曲张破裂出血行TIPS治疗,进一步研究显示血清VEGF水平与HVPG呈正相关。这也与既往研究[10]结果相似,因HVPG与肝硬化分期、在并发症发生发展等过程中都存在重要意义。肝硬化患者外周血VEGF水平明显升高[11-12],推测可能的机制为:(1)门静脉高压者肝细胞处于缺氧状态[13],使得Nrf2/HO-1表达增加,激活相关信号通路,从而达到血管生成标志物(包括VEGF)表达增加[14];(2)在肝硬化发展过程中,Neuropilin-1通过血管内皮生长因子受体2依赖的PI3K/Akt途径促进肝窦内皮细胞血管生成而加重肝硬化,同时表达更高的VEGF[15-16]。
VEGF选择性诱导细胞增殖[17],引起血管渗透性增强,导致血管渗透、水肿及炎症加重,引起内皮细胞增生[18],与肝硬化分期有关[19]。本研究显示,VEGF可作为肝硬化合并PVT的危险预测因子,提示VEGF在肝硬化合并PVT中起到一定的作用,这也与既往相关研究[8]一致。PVT形成的机制可从经典的Virchow理论理解:(1)血管内皮损伤,肝硬化患者肝脏假小叶形成以及纤维压迫小叶下静脉、中央静脉、肝窦使门静脉回流受阻,导致内皮细胞缺血损伤,另外随着门静脉高压形成,此外血流剪切力增高也可损伤血管内皮细胞,暴露内皮下胶原,启动凝血途径,另外包括TIPS、脾切除术、胃镜下治疗、感染等均有使肝脏血管内皮暴露的风险[20],以致缺血或者受损的肝细胞释放VEGF;(2)肝硬化形成后,假小叶形成,门静脉血流速度减慢或者受阻,门静脉压力发生改变[21-22],研究[23]显示门静脉血流速度是PVT形成的独立危险因素;(3)凝血与抗凝机制紊乱,任何因素引起两者脆弱的平衡状态发生改变均有诱发出血或者形成血栓的风险[21],既往多项研究[24-25]结果可予以证实。
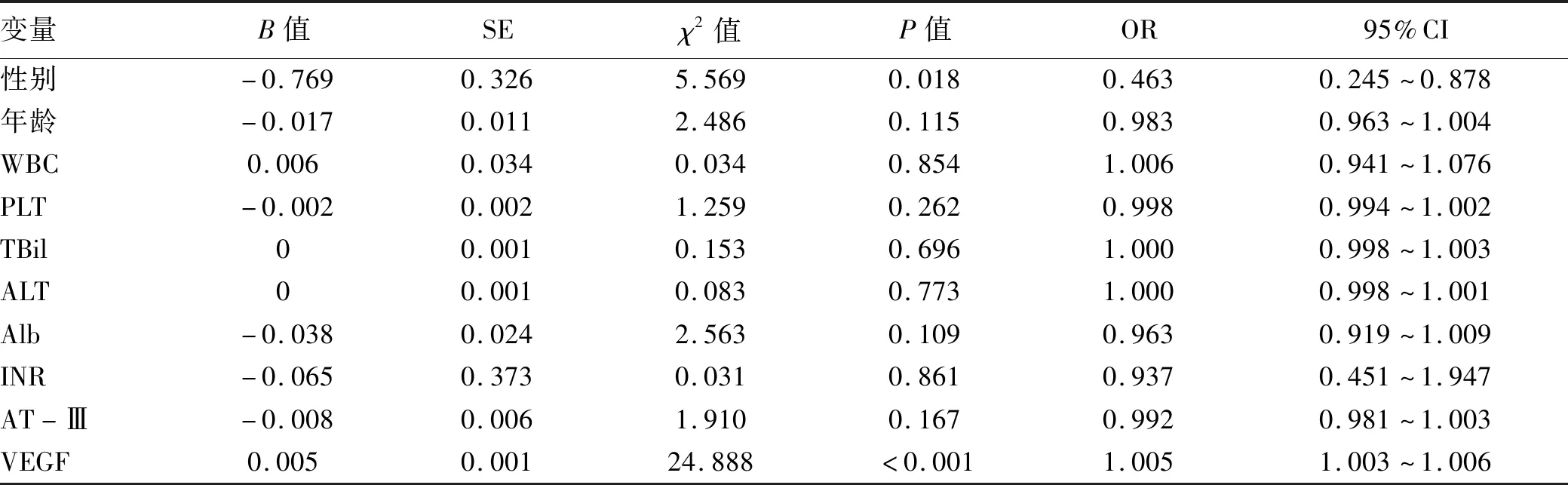
表2 肝硬化合并PVT危险因素的单因素logistic回归分析
总之,肝纤维化伴随肝脏血管再生,血栓形成导致血管壁受损,诱发血管通透性增加,加重肝细胞缺血缺氧性改变,引起内皮细胞增生,释放VEGF,表现为外周血VEGF表达增多。故而当肝硬化患者发生门静脉血栓时患者外周血VEGF可更高的表达,对临床诊断有指导作用。
利益冲突声明:本研究不存在研究者、伦理委员会、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:姚运海、罗艳、朱京乐等负责提出研究选题、设计研究方案、实施研究过程、采集整理数据;姚运海等负责调研整理文献、设计论文框架、起草论文、修订论文、终审论文;甘建和、赵卫峰等负责统计分析、获取研究经费、技术或材料支持、指导性支持。
