乙型肝炎肝硬化急性恶化患者慢加急性肝衰竭的发生情况及预后分析
2020-09-28谭钧元
李 晨,谭钧元,许 祥
解放军总医院第五医学中心 a.肝衰竭诊疗与研究中心; b.卫勤部,北京 100039
在我国,HBV是导致慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)的主要病因[1],大部分患者具有肝硬化基础[2-3]。当肝硬化患者由于急性恶化(acute deterioration,AD)出现黄疸、凝血功能障碍等肝衰竭前期表现时,就可能进展至ACLF[3-4],如果能在患者发生ACLF前进行有效分类,筛选出更易罹患肝衰竭的人群,将有望提高救治率。本文以发生AD的乙型肝炎肝硬化患者为研究对象,根据黄疸和凝血指标分为三型,对其临床特征、28 d ACLF发生率、90 d预后进行研究。
1 资料与方法
1.1 研究对象 选取解放军总医院第五医学中心2014年9月-2016年9月收治的乙型肝炎肝硬化AD患者进行回顾性研究。纳入标准:乙型肝炎肝硬化基础;既往病情稳定,短时间出现乏力、纳差、黄疸等急性恶化的表现;TBil>51.3(3×ULN)μmol/L,PTA<60%,且未达到ACLF诊断标准;通过病例资料可判定28 d是否发生ACLF,可判定90 d是否生存。排除标准:合并溶血性、先天性非溶血性、梗阻性等原因所致黄疸;合并恶性肿瘤;合并其他严重影响生命的基础疾病;病历及随访资料不完整。
1.2 观察指标 一般状况、并发症、发生ACLF时间、90 d生存情况,实验室检验指标:Alb、ALT、AST、ALP、GGT、TBil、总胆汁酸(TBA)、PTA、国际标准化比值(INR)、总胆固醇(TC)、血肌酐(Cre)、血清钠(Na)、血氨(BLA)、AFP、HBV DNA、WBC、PLT等。
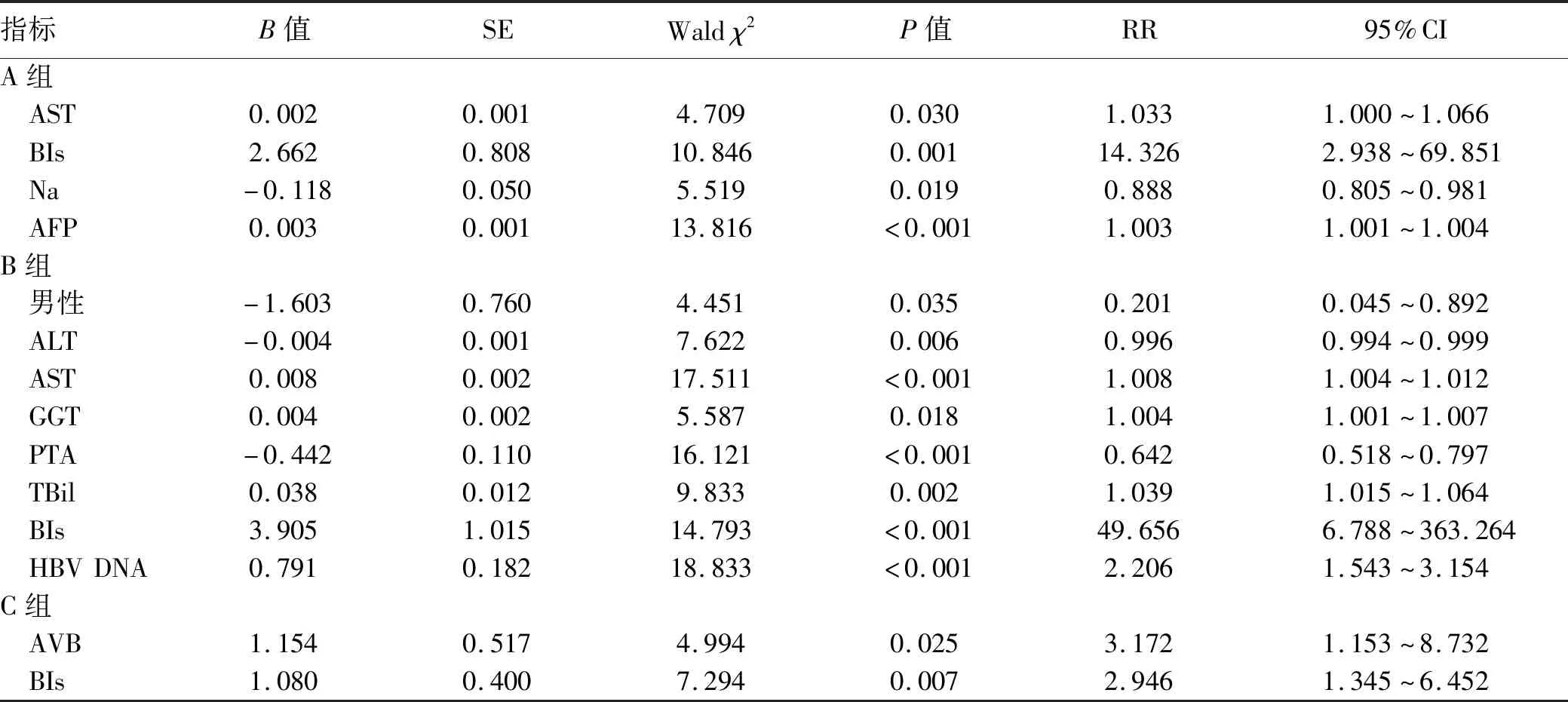
1.3 分组 根据基线TBil、PTA水平,分为三组。A组:51.3(3×ULN)μmol/L 1.4 诊断标准及相关定义 肝硬化及其相关并发症的诊断标准参考我国《肝硬化诊治指南》[5]。ACLF的诊断标准参考我国《肝衰竭诊治指南(2018年版)》[1]。MELD=3.78×ln [TBil(mg / dl)]+11.2×ln [INR]+9.57×ln[Cre(mg / dl)]+ 6.43[6]。Child-Pugh分值由TBil、Alb、腹水、肝性脑病(HE)、凝血酶原时间(或INR)5种参数进行综合计算[7]。 1.5 伦理学审查 本研究方案经由解放军总医院第五医学中心伦理委员会审批(批号:2019089D),患者均签署知情同意书。 2.1 一般状况 研究纳入670例患者,男性527例,女性143例,年龄(51.3 ± 10.7)岁。463例(69.1%)合并腹水,63例(9.4%)合并急性肾损伤(AKI),51例(7.6%)合并HE,93例(11.6%)合并细菌感染(bacterial infections,BIs),39例(4.6%)合并急性静脉曲张破裂出血(acute variceal bleed,AVB)。MELD分值为17.5±5.5,Child-Pugh 分值为9.8±1.3。69例(10.3%)在28 d内进展至ACLF,发生时间为12.0(7.0~15.0)d。79例(11.8%)在90 d内死亡(表1)。 表1 患者的一般情况 2.2 三组患者临床特征的比较 A组134例,B组393例,C组143例,三组患者年龄、发生HE比例、BLA水平比较差异均无统计学意义(P值均>0.05),其余指标差异均有统计学意义(P值均<0.05)。B组发生腹水、AKI、BIs比例均低于A组和C组(P值均<0.017),且TBil、Cre、HBV DNA、MELD分值、Child-pugh分值低于A组和C组,Alb、TC、Na均高于A组和C组(P值均<0.05)。C组男性比例高于A组和B组(P值均<0.017),且ALT、AST、ALP、GGT、TBil、TBA、Cre、AFP、WBC、PLT、MELD分值高于A组和B组(P值均<0.05)。A组男性比例低于B组和C组(P值均<0.017),且PTA、PLT均低于B组和C组,INR高于B组和C组(P值均<0.05)(表2)。 2.3 三组患者28 d ACLF累积发生率比较 A组19例(14.2%)、B组17例(4.3%)、C组33例(23.1%)在28 d内发生ACLF。进展至ACLF时间,A组为10.0(8.0~15.0)d、B组为14.0(10.0~21.5)d、C组为11.0(6.0~14.0)d,三组间无显著性差异(H=5.609,P=0.061)。通过Kaplan-Meier分析及log-rank检验,三组ACLF发生率存在显著差异(χ2=46.603,P<0.001),B组ACLF发生率显著低于A组(χ2=15.937,P<0.001)和C组(χ2=48.502,P<0.001)(图1)。 2.4 三组患者发生ACLF的影响因素 单因素Cox回归(为避免干扰因素,未将MELD及Child-pugh评分纳入多因素分析)显示以下变量(P<0.05)进入多因素Cox回归,A组为年龄、AST、GGT、TBil、AVB、BIs、AKI、Cre、Na、AFP、WBC;B组为男性、ALT、AST、GGT、PTA、TBil、AVB、BIs、HBV DNA、WBC;C组为PTA、AVB、BIs、AKI、HE、INR、CRE、Na、BLA。多因素Cox回归显示以下变量为各组发生ACLF的独立性影响因素,A组为AST、BIs、Na、AFP;B组为男性、ALT、AST、GGT、PTA、TBil、BIs、HBV DNA;C组为AVB、BIs(P值均<0.05)(表3)。 表2 三组一般情况的比较 表3 三组患者发生ACLF的独立危险因素 2.5 三组患者90 d病死率比较 观察纳入患者90 d病死情况,A组死亡29例 (21.6%),B组死亡15 例(3.8%),C组死亡35例 (24.5%),B组病死率低于A组(χ2=41.492,P<0.001)和C组(χ2=52.905,P<0.001)。在发生ACLF患者中,A组死亡8 例(42.1%),B组死亡3例 (17.6%),C组死亡17例 (51.5%),3组间均无显著差异(P值均>0.017)。在未发生ACLF患者中,A组死亡21例 (18.3%),B组死亡12例 (3.2%),C组死亡18例 (16.4%),B组病死率低于A组(χ2=31.899,P<0.001)和C组(χ2=25.494,P<0.001)。三组发生ACLF患者90 d病死率均高于各自未发生ACLF患者[A组:χ2=4.151,P=0.042;B组:P=0.022(Fisher精确法);C组:χ2=16.968,P<0.001]。 2.6 三组患者90 d生存的影响因素 单因素logistic回归(为避免干扰因素,未将MELD及Child-pugh评分纳入)显示以下变量(P<0.05)进入多因素logistic回归,A组为PTA、TBil、INR、TC、Cre、Na、BLA、WBC、Alb、AVB、BIs、AKI、发生ACLF;B组为年龄、ALT、AST、GGT、PTA、TBil、INR、TC、Cre、Na、Alb、腹水、AVB、BIs、AKI、发生ACLF;C组为年龄、ALT、ALP、PTA、TBil、TBA、Cre、Na、BLA、WBC、Alb、腹水、AVB、BIs、AKI、HE、发生ACLF。多因素logistic回归显示以下变量为各组90 d生存的独立性影响因素,A组为Cre、Na;B组为AVB、Na;C组为AVB、Na、发生ACLF(P值均<0.05)(表4)。 由于HBV再激活、细菌感染、药物、酒精、HBV突破及复发、重叠其他病毒感染等因素作用,HBV相关慢性肝病患者可迅速出现AD状态,并最终有一部分患者发生ACLF[8-9]。根据不同慢性肝病基础,ACLF可分为A(非肝硬化)、B(代偿期肝硬化)、C(失代偿期)三型[1,10],我国65%~82%的HBV相关ACLF患者具有肝硬化背景[2,11],因此乙型肝炎肝硬化AD患者是发生ACLF最大的潜在人群,此类患者中容易进展至ACLF者即属于肝衰竭前期阶段的范畴。既往研究[3,12]显示,TBil、PTA、HBV DNA、Na等指标是AD患者发生ACLF的影响因素。前期研究[4]也发现根据TBil和PTA,AD患者可能会分为不同的亚型。本研究进一步发现,该类患者可分为三个类型,即A型(低凝血型)、C型(高黄疸型)、B型(中间型),各型间具有不同的临床特征、ACLF发生率及预后。 A型临床表现为:女性比例较高,黄疸轻中度增高,酶学轻中度增高,凝血功能低下,肝脏合成及储备能力差,HBV DNA载量较高,易出现腹水、BIs、AVB等并发症;C型临床表现为;男性比例高,黄疸重度增高,酶学显著增高,胆汁淤积明显,凝血功能轻度下降,Cre较高,易出现腹水、BIs、AKI等并发症;B型临床表现为:黄疸轻中度增高,酶学轻中度增高,凝血功能轻度下降,HBV DNA载量较低,Na较高,较少出现除腹水以外的并发症。B型病情明显轻于其他两型。 相比B型,C型、A型患者更容易发生ACLF,并且进展速度也更快。虽然各型发生ACLF的影响因素存在较大差异,但BIs是三型相同的危险因素。BIs既是导致肝硬化患者发生ACLF的重要诱因,也是加重ACLF病情的重要因素,并且还与患者近期病死风险相关[13]。由BIs诱发ACLF患者的30 d病死率(71.6%)明显高于非BIs诱发者(33.8%)[14]。因此对于AD患者,应该积极排查有无合并BIs,一旦诊断要积极进行抗感染治疗。对于存在危险因素的AD患者应该被作为肝衰竭前期状态对待,我国指南[1,15]先后两次定义了肝衰竭前期概念,但在研究中仍发现一些问题:(1)定义中有酶学大幅度上升,但此类患者多是早期酶学大幅升高,随即较快回落,甚至出现“胆酶分离”现象;(2)没有考虑腹水、BIs、AVB、HE、AKI等并发症的影响;(3)定义中有TBil每日上升幅度,但没有具体时间窗;(4)TBil>171 μmol时,PTA介于40%~60%的患者被排除在外,但本研究证实该类患者具有较高的ACLF发生率和病死率。因此将AD患者的分型、危险因素引入肝衰竭前期诊断标准很有必要。 与既往结果一致[16],不论哪种亚型,AD患者一旦发生ACLF,其近期病死率都明显增加。值得注意的是,Na在三型患者中都是90 d生存的保护性因素。肝硬化患者由于门静脉高压、内脏血管扩张,进而激活肾素-血管紧张素酶-醛固酮系统、抗利尿激素系统,产生腹水及不同程度的低钠血症。而低钠血症与肝硬化、ACLF患者的病情及预后密切相关[17-18]。因此对于合并明显低钠血症的此类患者,可给予Alb、加压素V2受体拮抗剂等药物治疗[19-20]。此外,对于B型、C型患者,还应注意门静脉高压导致的AVB,即使不发生ACLF,也会影响预后,因此评估曲张程度、预防出血、降低门静脉压力、急诊胃镜治疗都有可能减少病死风险[5]。 表4 三组患者90 d生存的影响因素 综上所述,针对乙型肝炎肝硬化AD患者,可采用有针对性的诊疗方案。首先,进行临床分型。高黄疸型侧重退黄、改善胆汁淤积等治疗,低凝血型侧重改善凝血、预防出血等治疗,所有患者还需积极治疗BIs等并发症。其次,进行危险度分级。评估患者有无发生ACLF的危险因素,具有危险因素的高黄疸型、低凝血型患者属于肝衰竭前期状态,有较高的ACLF发生风险,治疗中应对发生高胆红素血症、低凝血状态的因素积极综合防治以减少进展至肝衰竭的比例。再次,进行预后预测。治疗中注意评估死亡风险,积极纠正低钠血症、预防及治疗AVB。本研究为回顾性分析,希望今后能有更多的前瞻性研究加以验证,并最终提高患者救治率。 利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。 作者贡献声明:李晨负责课题设计、撰写论文;李晨、许祥负责数据分析;谭钧元、李晨参与收集数据、修改论文;李晨负责拟定写作思路并最后定稿。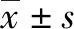
2 结果


3 讨论