胰腺癌联合动脉切除术的安全性与疗效Meta分析
2020-09-27龙海若侯圣忠田伯乐
龙海若,侯圣忠,田伯乐
(四川大学华西医院 胰腺外科,四川 成都 610041)
胰腺癌是目前公认的最具侵袭性的恶性肿瘤之一,预计到2030年,其将成为癌症相关死亡的第二大常见原因[1]。手术是胰腺癌唯一的根治办法,仅有20%的患者被诊断时仍有手术切除指征[2],即使这些患者接受新辅助治疗和手术,5年生存率也只有28%左右[3]。局部进展的胰腺癌可侵犯血管,包括门静脉、肠系膜上静脉、区域内的动脉等。为了提高切除率,延长生存时间,血管切除及重建技术已经广泛应用于胰腺癌患者的治疗。已有研究证明,与无血管切除的胰腺切除术相比,联合静脉切除手术并发症和病死率并不增加,长期生存率与前者相当[4-6]。然而,对于联合动脉切除(arterial rescetion,AR)目前尚存在不小争议,争议焦点在于这样的治疗手段是否安全以及能否使患者最终生存受益。笔者采用Meta分析方法对既往研究进行综合分析,重点探讨联合动脉切除的胰腺手术的安全性及疗效,以期更好地指导临床实践。
1 资料和方法
1.1 文献资料
纳入标准:(1)研究类型:回顾性队列研究;(2)研究对象:接受胰腺切除手术的胰腺导管腺癌患者;(3)干预措施:试验组和对照组分别实施联合动脉切除的胰腺切除术和单纯胰腺切除术(不含血管切除);(4)结局指标:总并发症发生率、围手术期死亡率、再手术率、输血率、住院时间、切缘情况、术后1年及3年生存率。排除标准:(1)所有动物实验、综述、个案报道、研究方案报告、壁报及非回顾性队列研究;(2)不能提供完整研究数据、研究设计缺陷等的研究;(3)联合动脉切除例数≤5的研究。
1.2 文献检索方案
在PubMed、Embase、Cochrane library、知网、万方数据库进行检索,收集2009年1月至2019年12月期间发表的文献。检索关键词包括“pancreatectomy”“pancreaticoduodenectomy”“hepatic artery”“superior mesenteric artery”“celiac artery”“arterial resection”“vascular resection”“胰腺切除”“胰十二指肠切除”“胰体尾切除”“动脉切除”“血管切除”,语言限定为英文和中文。
1.3 文献筛选及纳入研究的质量评价
2名研究者独立浏览文献标题及摘要,初步排除不合格文献,再仔细阅读全文进一步筛选。按照纽卡斯尔-渥太华量表标准进行评价,内容包括研究人群选择、可比性和结果评价,共8个条目,满分9分。由2名评价员独立地对初步纳入文献进行方法学评价并标注等级,评价结果一致的文献则纳入后续研究,意见不一致的文献,则由第3名评价员与前2名评价员协商来判定是否纳入。
1.4 数据提取
(1)纳入研究的基本特征,包括作者、发表年份、观察年份、国家、病例数、术前措施、干预措施。(2)主要研究结局指标,包括并发症总体发生人数、围手术期间死亡人数、再手术人数、术中输血人数、住院时间、切缘情况、1年生存率、3年生存率。
1.5 统计学分析
采用Revman5.2软件对提取的数据进行统计分析。二分类资料采用优势比(odds ratios,OR)值,以OR值评测数据。连续变量资料如住院时间则采用均数差(MD)作为效应量进行分析。效应量以95%置信区间(95%CI)表示,检验水准α=0.05。采用Q检验和I2的结果判断异质性。若I2<50%且P>0.1,则可判定数据间呈同质性,说明各项研究的一致性较好,采用固定效应模型。若I2≥50%或P≤0.1则可判定数据间呈异质性,采用敏感性分析寻找异质性来源,剔除异质性较大研究后再次采用固定效应模型分析。
2 结果
2.1 文献纳入及质量评价结果
共纳入文献1 330篇,排除重复文献50篇,通过阅读题目和摘要,排除不相关的文献1 129篇,排除系统评价、综述、病例报告等方面的文献62篇,初步纳入89篇文献。随后通过阅读全文的方式进一步排除明显不符合纳入标准的76篇文献。最终符合纳入标准的文献共13篇,见图1。
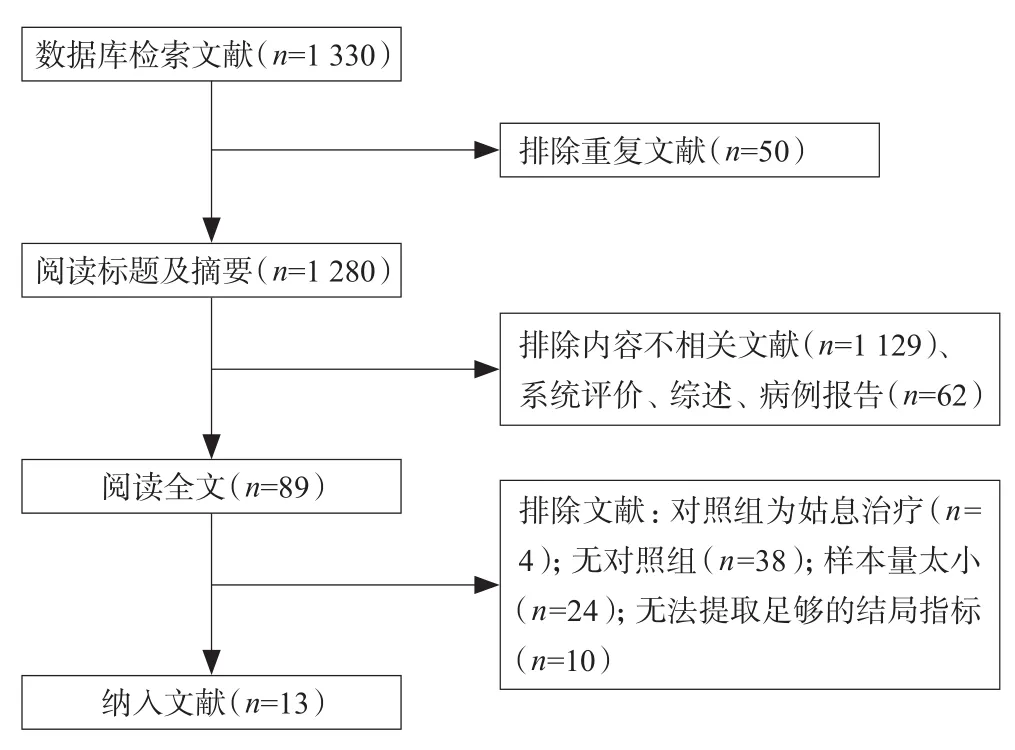
图1 文献检索流程
2.2 纳入文献的基本特征
从纳入的13项研究中,提取Meta分析中所需的基本信息:作者、文章发表的年份、观察年份、国家、研究总例数、术前措施、干预措施,有无合并静脉切除等,纳入研究的具体特点见表1。
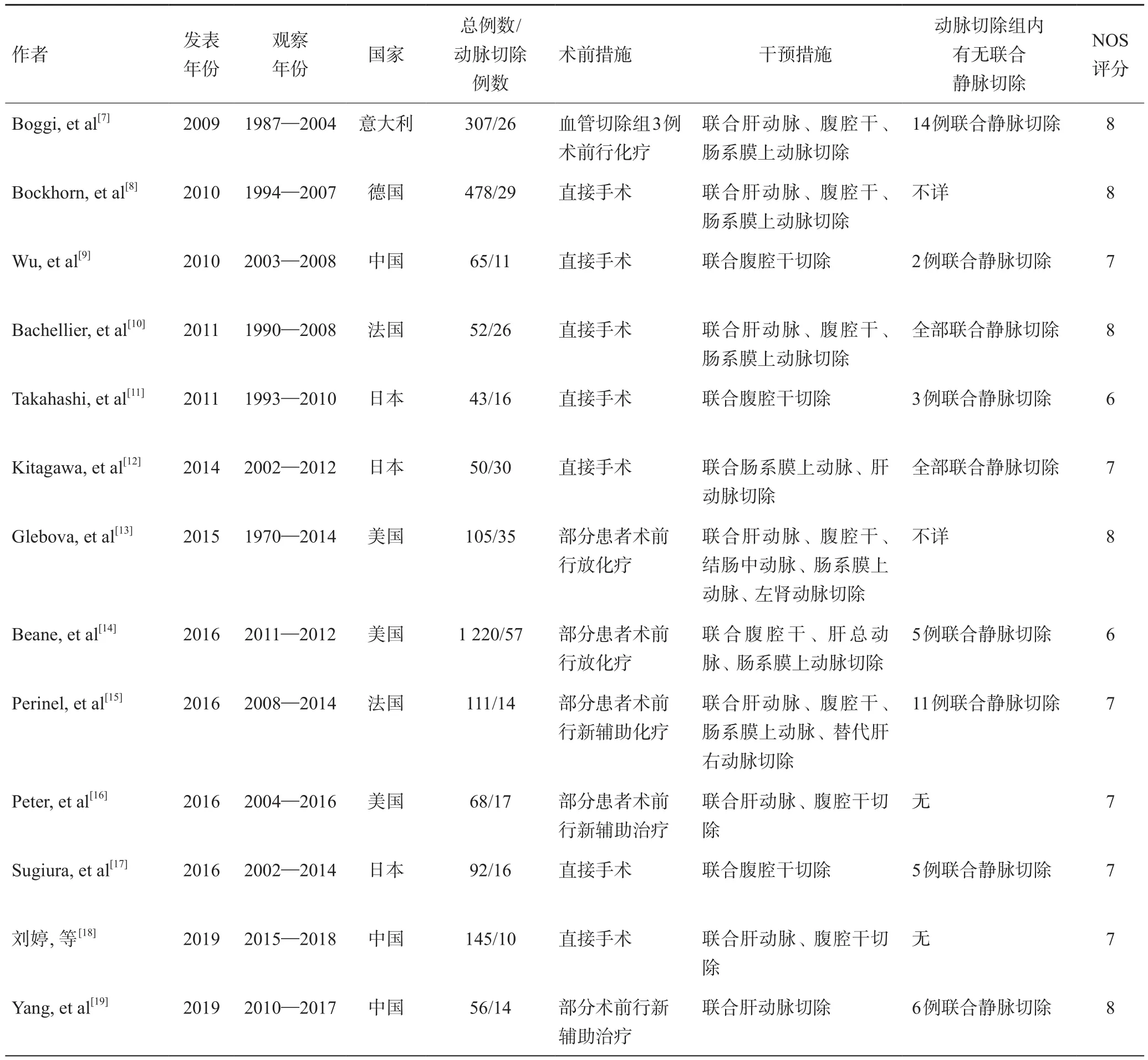
表1 纳入文献的基本特征与质量评价
2.3 研究结局指标Meta分析结果
2.3.1 总并发症发生率:12项[7-8,10-19]研究报道了并发症总体发生率。各研究间未见明显异质性(P=0.31,I2=14%),采用固定效应模型合并,结果提示联合动脉切除组总并发症发生率更高(OR1.66,95%CI1.25~2.21,P=0.0005),见图2。
2.3.2 围术期病死率:7项研究[7-8,10-12,14-15]报道了围术期病死率。各研究间未见明显异质性(P=0.83,I2=0%),采用固定效应模型合并,结果提示联合动脉切除围术期病死率更高(OR2.91,95%CI1.43~5.95,P=0.003),见图3。
2.3.3 再手术率:5项研究[7-8,11,14-15]报道了再手术率。各研究间未见明显异质性(P=0.47,I2=0%),采用固定效应模型合并,结果提示联合动脉切除组与单纯胰腺切除组再手术率无统计学差异(OR1.50,95%CI0.82~2.74,P=0.19),见图4。
2.3.4 术中输血率:4项研究[14-16,18]报道了术中输血率。各研究间未见明显异质性(P=0.16,I2=42%),采用固定效应模型合并,结果提示联合动脉切除组术中输血率更高(OR2.72,95%CI1.75~4.23,P<0.00001)。见图5。
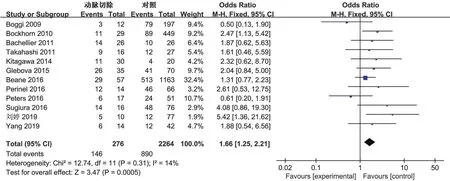
图2 联合动脉切除组和单纯胰腺切除组总并发症发生率Meta分析

图3 联合动脉切除组和单纯胰腺切除组围术期病死率Meta分析
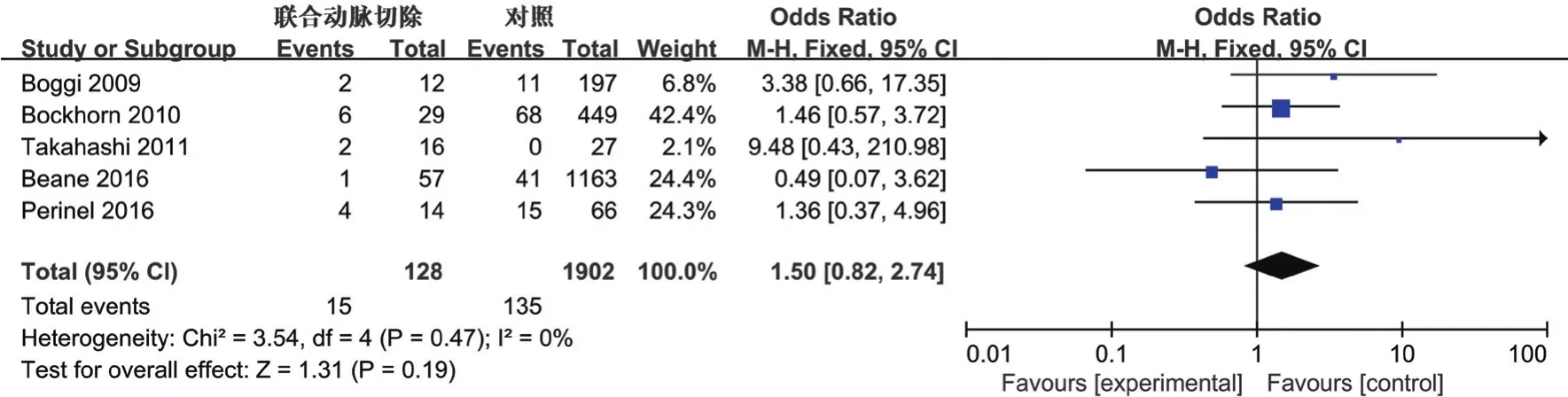
图4 联合动脉切除组和单纯胰腺切除组再手术率Meta分析
2.3.5 住院时间:有7项研究[8-9,11,13-15,19]报道了住院时间。各研究间未见明显异质性(P=0.76,I2=0%),故采用固定效应模型分析。其结果显示,联合动脉切除组与单纯胰腺切除组的住院时间差异无统计学意义(MD 0.10,95%CI-1.90~2.10,P=0.92),见图6。2.3.6 切缘阴性率:10 项研究[8,10-13,15-19]报道了切缘阴性率。各研究间未见明显异质性(P=0.82,I2=0%),采用固定效应模型合并,结果提示联合动脉切除组较单纯胰腺切除组切缘阴性率更低(OR0.45,95%CI0.31~0.65,P<0.0001)。见图7。
2.3.7 术后1年生存率:8项研究[7-11,13,16-17]报道了术后1年生存率。各研究间未见明显异质性(P=0.13,I2=37%),采用固定效应模型合并,结果提示联合动脉切除组较单纯胰腺切除组术后1年生存率更低(OR0.57,95%CI0.39~0.84,P=0.005)。见图8。
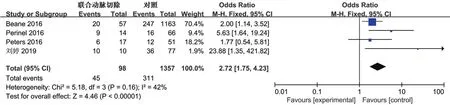
图5 联合动脉切除组和单纯胰腺切除组术中输血率Meta分析
2.3.8 术后3年生存率:7项研究[8-11,13,15,17]报道了术后3年生存率。各研究间未见明显异质性(P=0.25,I2=24%),采用固定效应模型合并,结果提示联合动脉切除组较单纯胰腺切除组术后3年生存率更低(OR0.37,95%CI0.21~0.65,P=0.0006)。见图9。
3 讨论

图6 联合动脉切除组和单纯胰腺切除组住院时间Meta分析

图7 联合动脉切除组和单纯胰腺切除组切缘阴性率Meta分析

图8 联合动脉切除组和单纯胰腺切除组术后1年生存率Meta分析

图9 联合动脉切除组和单纯胰腺切除组术后3年生存率Meta分析
1953年,Appleby等[20]首次报道了联合腹腔干切除的进展期胃癌根治术,开创了动脉切除的先河。1973年,Fortner等[21]首次将腹腔干和肝动脉切除运用于胰体尾切除术中。随后20世纪80年代至90年代,由于围术期死率居高不下和长期生存率不佳,联合动脉切除的胰腺切除术不再被认同[22]。而近年来,随着影像技术、全身疗法及手术技巧的进步,国内外众多学者又逐渐将目光重新聚焦于联合动脉切除(arterial resection,AR)的胰腺切除术,以期使动脉受累的局部晚期胰腺癌患者能够获得手术切除的机会并实现R0切除。
本Meta分析发现,联合动脉切除组围术期并发症总发生率和死亡率较单纯胰腺切除组更高。在理解这一结果时,首先应该注意到各研究之间对围术期并发症的定义存在一定差异,有一些仅统计手术相关并发症,有些则包含了系统并发症。另外,对比单纯胰腺切除组,究竟是AR组肿瘤的更强的侵袭性导致了围术期更高的风险还是AR操作本身引起的风险,这是难以判断的。同时,部分AR组患者合并静脉切除,较单纯胰腺切除组也可能增加围术期风险的发生,由于部分原始文献动脉切除组全部联合静脉切除或者数据结局指标记录不充分,无法展开亚组分析。
本Meta分析发现,联合动脉切除组术中输血率高于单纯胰腺切除组,这提示血管切除可在一定程度上增加手术创伤,增加输血可能;操作需在清晰视野下进行,故需扩大切口,加之切除血管会增加手术范围,因而增加术中出血量。而本次Meta分析发现住院时间差异无统计学意义,结合前面病死率统计,表明AR有可能增加致死并发症风险,而不增加非致死性并发症风险与住院时间。剔除了围术期死亡人数后我们发现,AR组术后1、3年生存率仍低于单纯胰腺切除组。这与侵及血管的肿瘤侵袭性更强、病程分期更晚有关,需要联合动脉切除的肿瘤可能产生更高的切缘阳性率、淋巴结转移率,进而导致更低的长期生存率[23-24]。尽管不断有研究[25-26]报道联合动脉切除治疗胰腺癌生存率低,但也指出治愈胰腺癌的唯一机会是保持切缘阴性,血管切除是有效的治疗方法,部分患者可从中受益。
本Meta分析表明AR组更多的围术期风险和更差的生存,但并非完全否认AR的作用和价值,仍有相当多的患者通过AR获得了根治性的R0切除和长期生存。因此,在应用AR时应高度谨慎,选择合适的患者:年龄(比如<55岁),体力情况(ECOG评分0~1分),AR切除的可行性(术前受侵动脉和肿瘤的影像学评估,肠系膜上动脉侧枝循环是否充足,术中评估胰十二指肠动脉弓和胃十二指肠动脉能否代替腹腔干、肝总动脉血供),患者及家属的同意和理解等[25],合理选择适应证,避免盲目扩大化是关键。
本Meta分析不可回避的问题是研究中是否有混杂因素影响。首先,AR组和非AR组在术前情况是否一致上存在疑问,而术前情况对围术期风险和预后具有重要影响。13篇入选文献中,4篇文献[9,11-12,19]未进行术前情况匹配;3篇文献[8,17-18]仅匹配了年龄、性别、ASA等基本情况;3篇文献[7,15-16]详细匹配了术前基本情况、化验指标、合并症、肿瘤性质(病理、大小、位置、分化程度、是否存在淋巴结和周围神经侵犯等);3篇文献[10,13-14]进行了倾向性评分匹配,确保了AR组和非AR组术前情况基本一致。因此,总体来看,AR组与无AR组术前情况客观上可能存在参差。另外需要关注的是对于AR组部分患者,术前的新辅助治疗对围术期风险和术后生存是否带来混杂影响。一项样本量445例的研究表明,术前新辅助化疗的胰腺癌患者术后胰瘘和出血发生率低于直接手术患者[27];另有一项大样本量的新辅助治疗结合手术对比直接手术的Meta分析表明新辅助治疗组生存期更长(18.8个月vs14.8个月),且联合新辅助治疗组切缘阴性率更高(86.8%vs66.9%)[28]。而本Meta分析AR组患者即使术前接受了新辅助治疗,围术期风险发生率和预后仍较非AR组差,证明了新辅助治疗虽然减轻围术期风险和改善预后,但在AR的患者中这些正面影响被抵消。
本Meta分析有一定的局限性与不足之处。首先纳入的是观察性回顾队列研究,而不是随机对照试验,这就会有与生俱来的观察偏倚。但是,如果将动脉受肿瘤侵犯的患者随机分配至动脉切除或不切除组,则在试验可行性上会面临伦理问题;其次,就如上文所提到的,部分动脉切除患者合并静脉切除,这样的混杂因素可能进一步增加了围术期风险的发生;另外,除刘婷等[18]的报道外其他文献均未提及患者术后生活质量的量化评估;最后,本研究纳入的文献质量有参差,各中心技术和经验存在差异,胰腺切除术式的选择和动脉处理的方式可能存在区别,这也一定程度上降低了纳入研究之间的同质性,影响结论可信度。但就现有证据而言,我们没有发现联合动脉切除术较单纯切除有更高获益,所以,我们认为胰腺切除是否联合动脉切除应因视患者具体情况、外科医师对血管切除重建的熟练程度而定。当然,这还有待后续的大样本、多中心、高质量的研究进一步证实。
