大鼠胸主动脉腹腔移植套管法的改良
2020-09-27张松林孙来龙
张 鹏 张松林 孙来龙
(三峡大学 第一临床医学院[宜昌市中心人民医院] 胸心外科,湖北 宜昌 443003)
心脏移植物血管病(cardiac allograft vasculopathy,CAV)是影响移植后心脏长期存活的主要因素,是免疫因素和非免疫因素共同介导的心脏慢性排斥反应,主要表现为以血管平滑肌细胞增殖为主的新生内膜形成和移植物血管的进行性增厚,最终导致管腔狭窄,移植物功能衰竭[1]。传统大鼠心脏腹腔移植模型的建立,是通过血管的端侧吻合,血流从腹主动脉经冠状动脉-冠状窦口到右心房,再从右心室泵出到腹腔静脉,由于左心房和左心室工作较少,所以移植心脏不久会萎缩[2]。且这种腹腔心脏异位移植,需要血管的端侧吻合,操作技术要求高。血管套管的替代使用可使模型的建立更加简便,但套管的稳固、移植放入和能否避免套管内血管产生褶皱是成功的关键[3]。我们在以往套管模型的基础上,通过翻转后血管的对称吻合和单侧打结固定以及半针管的运用,使血管套管更加稳固,移入更加方便,期望能成功诱导出同种异体移植物血管病的病理损伤,为心脏慢性排斥反应的干预研究提供理想的动物模型。
1 材料与方法
1.1 实验动物
SPF级雄性SD大鼠,体重300~330 g,购自三峡大学实验动物中心[SCXK(鄂) 2017-0012];SPF级雄性Wistar大鼠,体重120~150 g ,购自湖北省实验动物研究中心[SCXK(鄂)2015-0018]。大鼠饲养温度为(23±2)℃,相对湿度为(55±5)%,自由饮食。实验操作在三峡大学实验动物中心屏障实验室[SYXK(鄂)2017-0061]进行,并遵循实验动物的“3R”原则给予人文关怀。
1.2 实验器材与药品试剂
显微外科器械包(卓越医疗器械),XTL-165双目外科显微镜( 江西凤凰光学股份有限公司),16 G静脉留置针(贝朗医疗上海国际贸易有限公司),20 G静脉留置针(江西丰临医用器械有限公司),8-0、9-0显微带线缝合针(宁波医用缝针有限公司),3-0真丝非吸收缝线(扬州市金环医疗器械厂),玻璃培养皿(60 mm),半针管笔尖(0.5 mm),撑开器(16 cm),玻璃分针13 cm。肝素钠(北京亚米生物科技有限公司),戊巴比妥钠(上海化学试剂公司),4%多聚甲醛固定液,苏木素-伊红染液(武汉谷歌生物科技),α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)兔抗鼠单克隆抗体,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)兔抗鼠单克隆抗体(武汉三鹰),HRP标记的山羊抗兔鼠通用(DAKO公司)。
1.3 实验分组与结果测定
实验动物分为两组,以Wistar大鼠为供体及空白对照组(n=17),SD大鼠为受体及模型组(n=34)。成功建模30只,随机分为7 d组、28 d组和56 d组,每组10只。取动脉标本后,每组随机选取6只,常规HE染色和免疫组织化学α-SMA和PCNA染色。采用Image-pro plus 6.0软件测量弹性纤维平面到内膜边缘的平均距离,代表移植动脉的内膜厚度(n=6);以棕黄色为阳性表达,测量免疫组织化学染色的积分光密度值(integrated optical density,IOD)。
1.4 套管制作
取16 G静脉留置针管切去尖端,显微镜下切取约4 mm的管长,使两端光滑、平整。显微镜下剪取直径相当的供体动脉约7 mm。用显微镊使供体动脉穿过切取的16 G小管,取20 G静脉留置针切去多余部分,生理盐水润湿针管,缓慢插入小管内的供体动脉中。调整小管两端动脉使之等长,放入60 mm的玻璃培养皿中(图1A)。8-0显微带线缝合针对称穿过小管两端动脉,针边距约1 mm,反向牵拉缝线使动脉翻转,一侧打结固定(图1B)。残留线端不超出小管边缘,对称侧同样操作,留适当长度后,缠绕小管一端两圈再打结固定,同样残留线端不超出小管边缘,使供体动脉完全包裹小管,制成动脉套管(图1C),放4℃生理盐水中保存。
1.5 供体手术
以Wistar大鼠为供体,术前腹腔注射肝素钠生理盐水(5 mg/kg),腹腔注射1.5%戊巴比妥钠(40 mg/kg)。待麻醉后,胸腹部剃毛备皮,四肢固定于解剖台上,碘伏胸腹部局部消毒,取尿道口上约3 cm至剑突下腹正中切口,剪开皮肤及肌肉等组织。暴露腹腔脏器,将胃和肠管牵拉置于腹部左侧,打开后腹膜,找到腹主动脉和下腔静脉,纱布垫于其上,用剪刀剪断腹主动脉及下腔静脉,直至血液放尽。沿膈肌和腋中线两侧剪开胸壁,将胸壁上翻,暴露胸腔脏器,剪除心肺、胸腺和食管等组织,可见沿脊柱走形的胸主动脉。在主动脉弓处离断分支血管,剪除周围组织及肋间动脉,分离胸主动脉至膈肌处,肝素钠生理盐水反复冲洗管腔。显微镜下剥脱动脉外层脂肪组织,修剪肋间动脉保留断端约1 mm(动脉弹性回缩,防止血液漏出),置于4℃生理盐水中,以备套管制作。
1.6 受体手术
以SD大鼠为受体,术前禁食12 h,自由饮水,麻醉及腹部切口同供体手术。开腹后用撑开器固定,牵拉胃及肠管于左腹外侧,无菌纱布覆盖,温盐水润湿。打开后腹膜,暴露腹腔动脉,用显微镊小心游离肾动脉平面下方约15 mm、髂动脉分叉处上方约5 mm的腹主动脉,动脉夹夹闭游离动脉的最上端、最下端(图1D)。在上端动脉夹下方约5 mm处,显微剪剪开动脉前壁约1/3周径血管,取供体动脉套管置于半针管上(图1E),打结固定一端朝向外侧,轻提剪口处平行插向远心端,待完全插入改用玻璃分针弯部尖端完全送入动脉中。9-0显微针线缝合剪口中央点管壁全层一针,打结后做牵引,再缝合其两边剪口,先开放远心端动脉夹,无漏血后再开放近心端动脉夹。少量渗血可用纱布轻压迫或加针缝合出血处,无血液渗出后观察远端血管是否充盈通畅(图1F)。温生理盐水冲洗局部动脉,将胃及肠管复位,注入肝素钠生理盐水(5 mg/kg),3-0丝线连续缝合肌肉、皮肤层关腹,碘伏消毒后,放保温垫上,待苏醒后转动物房。术后48 h,大鼠四肢能够自由活动,大小便正常视为手术成功。
1.7 移植物摘取
术前腹腔注射肝素钠生理盐水(5 mg/kg)肝素化全身,麻醉等步骤同受体手术。打开腹腔及后腹膜,可见套管处被纤维结缔组织包裹,在其上、下方阻断动脉,剪去周围组织取出包裹的套管,立即放血处死大鼠,肝素生理盐水反复冲洗管腔,显微镜下剥离纤维组织,取出套管内的移植动脉,盐水冲洗后放入4%的多聚甲醛中固定,用于HE染色和免疫组化染色。
1.8 统计学分析
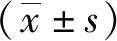
2 结果
2.1 移植时间
模型组34只,成功建模30只,成功率为88.24%。移植各环节所需时长如下:供体动脉准备(获取、修剪)所需时长为(16±2) min,套管制作时间为(10±2) min,受体动脉分离(20±3)min,套管移植(6±2)min,动脉阻断时间(10±2)min。
2.2 移植动脉HE染色和内膜厚度变化
分别取对照组、移植后7 d组、28 d组、56 d组动脉行HE染色。与对照组相比,7 d组动脉内皮细胞脱落,少量单核巨噬细胞浸润(图2A和2B);28 d组动脉被大量单核巨噬细胞侵蚀,中膜弹性纤维断裂(图2C);56 d组中膜弹性纤维排列紊乱,内膜出现大量炎症细胞,并向管腔中心延伸,形成多个狭小的管腔,管壁机化(图2D)。与对照组比较,7 d组、28 d组和56 d组内膜厚度显著增加(均P<0.01);与7 d组比,28 d组内膜厚度增加显著(P<0.01);与28 d组相比,56 d组内膜厚度显著增加(P<0.01)。此结果提示,随时间的增加,动脉内膜厚度不断增加(图2E)。
2.3 移植动脉α-SMA和PCNA表达情况
免疫组化观察α-SMA和PCNA表达情况(图3A)。结果显示,正常对照组血管平滑肌细胞中高表达α-SMA、低表达PCNA,7 d组、28 d组和56 d组α-SMA的表达范围和强度明显减少,PCNA的表达量逐渐增加(均P<0.05);且与7 d组比较,28 d组α-SMA的表达量明显减少,PCNA的表达量明显增加(均P<0.05);与28 d组比较,56 d组α-SMA的表达量也显著减少,PCNA的表达量显著增加(均P<0.05)。提示随时间的增加,α-SMA的表达量不断减少,PCNA的表达量不断增加(图3B和3C)。
3 讨论
除传统腹腔移植外,小鼠颈部心脏移植同样需要血管吻合,并存在小鼠颈总动脉、颈静脉不在同一手术平面,供受体血管大小不匹配,术后血管吻合口扭转或压迫等缺点;随着袖套技术的运用,简化了移植部分的血管吻合,但袖套管的安置过程繁琐,并延长了手术时间,并且预实验成功率低,动物消耗多[2-5]。我们选择了血管套管移植的替代模型,在比较以往大鼠动脉移植模型的基础上,发现血管翻转后两端打结固定,在插入动脉过程中容易脱落,而一旦脱落只能重新制作套管,增加了动脉阻断时间和大鼠死亡风险[6]。因此,本研究在其基础上,借鉴了翻转血管的两端打结和对侧缝合法[7],建立了翻转后血管的对称吻合和单侧打结固定法,而0.5 mm半针管笔尖结构,在不损伤动脉套管的前提下,能更好地辅助套管的移植,使套管的放置更加方便、快捷。
共有34只大鼠采用本改进法行移植动脉手术,其中2只死于术后腹部开裂(大鼠对腹部切口刺激的撕咬),1只夹闭腹腔动脉时心脏停跳(可能与腹腔生理盐水过多、循环血量增多有关),1只术后下肢瘫痪(急性排斥或血栓形成),最终成功建模30只,成功率达88.24%。套管制作时间虽延长,但易化了移植部分,预实验成功率增高,减少了动物消耗。
在各时间点摘取动脉后,行HE染色发现,移植动脉在28 d,管壁被大量单核巨噬细胞侵蚀,中膜部分弹性纤维断裂;在56 d内膜增厚显著,管腔机化。平滑肌细胞是CAV中新生内膜的主要组成部分[8]。α-SMA是构成平滑肌细胞收缩装置的细胞结构蛋白,在分化成熟的平滑肌细胞中高表达,当平滑肌细胞出现凋亡、纤维化或由“收缩型”转换为“合成型”时,α-SMA表达量将减少[9-11]。本研究免疫组化观察α-SMA表达及分布情况,结果发现,随时间增加,α-SMA的表达量逐渐减少,表明平滑肌细胞的收缩功能降低,并向分泌型细胞转变。PCNA可评价平滑肌细胞重塑过程中的增殖状态[12]。免疫组化观察PCNA的表达情况,发现随时间增加,PCNA的表达逐渐增高,表明细胞增殖活跃,与动脉内膜厚度的增加及管腔闭塞相对应。α-SMA表达不断减少和PCNA表达逐渐增加,表明平滑肌细胞经历了凋亡、增殖和表型转变,最终导致大量平滑肌样细胞在内膜下的聚集,引起管腔闭塞性改变[13-15]。综上所述,改进后的模型可有效诱导出移植动脉的CAV样病理变化。
模型建立中,我们应注意以下几点:①供体Wistar大鼠重量超过150 g时,血管套管制作中容易出现褶皱,应将体重控制在120~150 g,受体SD大鼠应控制在320~350 g,低于320 g插管阻力大,超过350 g动脉分离困难、更易形成侧支循环;②套管的切取长度可在显微镜下以半针管笔尖为参考,供体动脉切取以套管为参考,供体动脉全长可制作数个动脉套管以供移植或备用;③剪取的动脉应比套管长约3 mm,动脉翻转后,两端对称缝合,针边距适当,减少中央隆起,使动脉有一定的紧张度,避免套管内动脉褶皱的发生;④受体大鼠腹腔动脉的分离可从肾动脉平面下方开始,显微镊小心游离动脉侧周围组织,玻璃分针动脉下穿孔后,可一直游离到髂腰静脉水平;⑤动脉夹夹闭后,如有血液持续从剪口处渗出,可在动脉夹处用丝线活结结扎,玻璃分针弯部尖端光滑、平整,用肝素生理盐水润湿后可扩增剪口,方便套管的插入。
综上所述,此套管法的改良使制作的供体动脉套管更加稳固,克服了受体动脉阻力高的情况,并且半针管的运用使套管移植过程更加简便。同时,可多人协作或一人独立完成,缩短了手术时间,并能有效诱导出血管的慢性排斥反应。经过预实验训练,此方法上手快,可复制性强,符合实验动物的“3R”原则,可为心脏移植慢性排斥反应的病理和治疗提供模型。
