线粒体凋亡通路在皮质酮(CORT)诱导海马神经元凋亡中的作用
2020-09-25李鑫月郎立敏杨焕民
李鑫月,徐 彬,连 帅,陈 妍,郎立敏,杨焕民
(黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163000)
由于我国东北地区所处的地理位置,冬季寒冷的气候条件在一定程度上制约着畜牧养殖业的发展。虽然现代化的供暖设备可以保持室内温度恒定,但是气候骤降、强降雪等不可控的自然因素以及停电、运输等情况带来的冷应激无法避免,一旦发生,会造成不可挽回的经济损失。
面对包括寒冷、炎热在内的各种应激源刺激时,机体都会产生一部分与刺激性质无关的非特异性反应,称为应激反应。应激反应主要由下丘脑前交感神经细胞的刺激触发的交感-肾上腺髓质系统(SNS)以及下丘脑分泌的激素触发的下丘脑-垂体-肾上腺皮质轴(HPA)介导。其中,肾上腺皮质分泌的糖皮质激素(GC)是重要的应激激素,它可以在应激时重新调动机体的能量储备,使能量分配向重要器官偏移以应对应激[1]。但是,糖皮质激素并不总是发挥正向的神经元保护作用。低剂量的糖皮质激素对神经元是有益的,然而由于海马神经元具有高水平的糖皮质激素受体,作为糖皮质激素的主要神经靶点,极易受到高水平的糖皮质激素的损害[2-4]。有研究证明,长期过量的暴露于糖皮质激素会加速海马神经元老化,使海马CA3区锥体细胞树突萎缩,并且降低海马神经元应对癫痫、中风等神经损伤的能力[4-7]。而海马对于啮齿动物的空间记忆形成是至关重要的,过量的糖皮质激素会造成海马依赖的记忆形式的障碍[8-9]。因此,有必要关注并研究冷应激情况下海马神经元发生的变化。
细胞调亡存在2条主要通路:内源性的线粒体通路和外源性的死亡受体信号通路[10]。已知糖皮质激素可以造成神经元中活性氧(ROS)产生增加,而线粒体是细胞产生ROS的主要部位,同时其受到损害后又会引发线粒体通路介导的凋亡[11]。据此推测应激情况下糖皮质激素可能通过影响海马神经元线粒体功能造成海马神经元损害。加之本实验室前期研究显示,冷应激会造成大鼠血浆皮质酮(CORT)水平升高,并且冷应激后大鼠海马神经元凋亡增加[12-13]。综上,结合本实验室前期工作基础,本研究旨在从细胞水平研究糖皮质激素对于海马神经元的作用,以探索冷应激损伤海马神经元的机制。
1 材料与方法
1.1 细胞系小鼠海马神经元细胞系HT22细胞购自美国ATCC公司。
1.2 主要仪器二氧化碳细胞培养箱(力康发展有限公司);CytoFLEX 流式细胞仪(Beckman,美国);酶标仪(深圳迈瑞生物医疗电子股份有限公司);电泳仪、电泳槽(BIO-RAD,美国);化学发光数字成像系统(BIO-RAD,美国);TCS SP2激光共聚焦显微镜(Leica,德国)。
1.3 主要试剂CORT(Sigma-Aldrich,美国);DMEM培养基(Sigma公司,美国);胎牛血清(Gibco,美国);Bax、Bcl-2、Caspase-3一抗(武汉三鹰生物技术有限公司);HRP标记山羊抗兔IgG(Cell Signaling Technology,美国);CCK-8检测试剂盒、Annexin V-FITC细胞凋亡检测试剂盒、JC-1线粒体膜电位检测试剂盒、BCA蛋白浓度测定试剂盒增强型、SDS-PAGE凝胶配制试剂盒均购自碧云天生物技术公司。
1.4 HT22细胞的培养用DMEM高糖培养基在37℃条件下培养HT22细胞,胎牛血清10%,青霉素浓度100 U/mL,链霉素质量浓度0.1 g/L。
1.5 CCK8法检测CORT对HT22细胞存活率的影响将HT22细胞接种于96孔板内,继续培养待细胞融合到80%,对照组不予CORT处理,试验组用500 μmol/L CORT处理3 h,每组3个重复。之后每孔加入10 μL CCK8溶液,1 h后用酶标仪测定D450 nm值。细胞存活率=(试验组D值-空白对照组D值)/(细胞对照组D值-空白对照组D值),计算细胞存活率。
1.6 流式细胞仪检测HT22细胞凋亡情况按凋亡检测试剂盒说明书进行,对照组不予CORT处理,试验组用500 μmol/L CORT处理3 h。用胰酶把细胞从培养皿上消化下来,再加入之前的培养液,一并转移到离心管内,离心收集细胞。用PBS重悬细胞并计数,取1×105细胞离心,弃上清后加入195 μL AnnexinV-FITC结合液重悬,再加入5 μL AnnexinV-FITC,混匀后加入10 μL碘化丙啶染色液,混匀,室温避光孵育30 min。用流式细胞仪检测。细胞调亡率=右下象限百分比(早期调亡细胞)+ 右上象限百分比(晚期调亡细胞),计算细胞凋亡率。
1.7 JC-1探针法检测线粒体膜电位细胞在六孔板中培养,试验组用500 μmol/L CORT处理3 h,对照组不予CORT处理。按线粒体膜电位检测试剂盒(JC-1)说明书配制JC-1染色工作液。细胞先换液,之后加入1 mL JC-1染色工作液,混匀,37℃孵育20 min。配置JC-1染色缓冲液,用JC-1染色缓冲液洗涤孵育后的细胞2次,再加入2 mL细胞培养液,随后在激光共聚焦显微镜下观察。相对荧光强度=绿色荧光强度/红色荧光强度,计算相对荧光强度。
1.8 Western blot检测凋亡相关蛋白表达细胞裂解提取总蛋白,按BCA蛋白浓度测定试剂盒操作,并计算出蛋白浓度。之后准备电泳:清洗玻璃板,把玻璃板夹紧、卡在架子上,验漏。配制10%分离胶、5%浓缩胶,灌胶,按每孔上样量30 μg上样,进行SDS-PAGE凝胶电泳。然后把PVDF膜、滤纸、胶按顺序放入电转夹,夹紧电转夹,放入电转仪中进行转膜。转完膜后,用5%脱脂奶粉溶液(用TBST溶液稀释)室温封闭PVDF膜1 h。再用下列一抗4℃孵育过夜:Bax、Bcl-2、Cyt-c、Caspase-3,β-actin作为内参。TBST震荡洗涤3次,之后用1∶8 000倍稀释的辣根过氧化物酶HRP标记山羊抗兔IgG二抗室温孵育1 h。再次用TBST震荡洗涤。配制显影剂,将显影剂覆盖在膜表面,在化学放光检测器中显影,曝光时间为3 s到15 min。用Image Pro Plus5.0软件进行图像分析。

2 结果
2.1 CORT对HT22细胞存活率的影响用500 μmol/L CORT处理HT22细胞3 h后,用CCK-8法检测CORT对HT22细胞的影响,结果见图1。500 μmol/L CORT处理3 h使HT22细胞存活率显著下降(P<0.001),表明CORT对HT22细胞的生长具有明显的抑制作用。

图1 CORT对HT22细胞存活率的影响 ***.示与对照组相比差异极显著,P<0.001。下同
2.2 细胞凋亡检测用500 μmol/L CORT处理HT22细胞3 h后,用流式细胞术 AnnexinV-FITC/PI 双标法检测HT22细胞凋亡率,把细胞分为如图2所示4个象限,左下象限代表活细胞,右下象限为早期凋亡细胞,右上象限为晚期凋亡细胞,左上象限为坏死细胞。
结果显示,500 μmol/L CORT处理组细胞凋亡率为19.79 %,与对照组相比明显升高,差异有统计学意义(P<0.001)。
2.3 线粒体膜电位检测用500 μmol/L CORT处理HT22细胞3 h后,用JC-1探针法进行线粒体膜电位检测,结果见图3,4。相比于对照组,500 μmol/L CORT处理组的绿色荧光增强,绿色与红色荧光强度比值显著升高(P<0.001),表明500 μmol/L CORT处理后线粒体膜电位下降。
2.4 凋亡相关蛋白表达的检测用500 μmol/L CORT处理HT22细胞3 h后,用Western blot检测凋亡相关蛋白表达水平,结果见图5。相比于对照组,凋亡相关蛋白Cyt-c水平显著升高(P<0.001),Bax/Bcl-2比值以及活化的Caspase-3与Caspase-3前体的比值均显著升高(P<0.001)。
3 讨论
越来越多的研究证实环境应激与精神疾病密切联系,慢性应激下异常分泌的糖皮质激素会显现出神经毒性,损害海马神经元[4]。有研究表明,用大剂量糖皮质激素可以模拟慢性应激对小鼠海马神经元线粒体产生的影响[14]。本实验室前期研究结果也显示冷应激情况下血浆CORT水平升高。因此,本研究采用CORT刺激HT22细胞的方式,构建体外冷暴露模型。
研究已证实长期的过量的糖皮质激素暴露会导致海马神经元凋亡[4]。本试验结果表明,用CORT处理后HT22细胞凋亡率显著增高。虽然糖皮质激素损害海马的机制还没有完全明确,但早期研究就已提出过量的糖皮质激素可以通过 “能量代谢破坏”和“谷氨酸-钙离子-活性氧级联反应”损害大脑神经元[4,15]。氧化应激是糖皮质激素神经毒性机制中极关键的一个环节。糖皮质激素可以调节海马神经元中与ROS生成有关的基因,提高NADPH氧化酶的表达,降低神经元中铜/锌超氧化物歧化酶(Cu/Zn-SOD)、谷胱甘肽过氧化物酶(GPx)等抗氧化酶活性,从而降低神经元的抗氧化能力[16-17]。
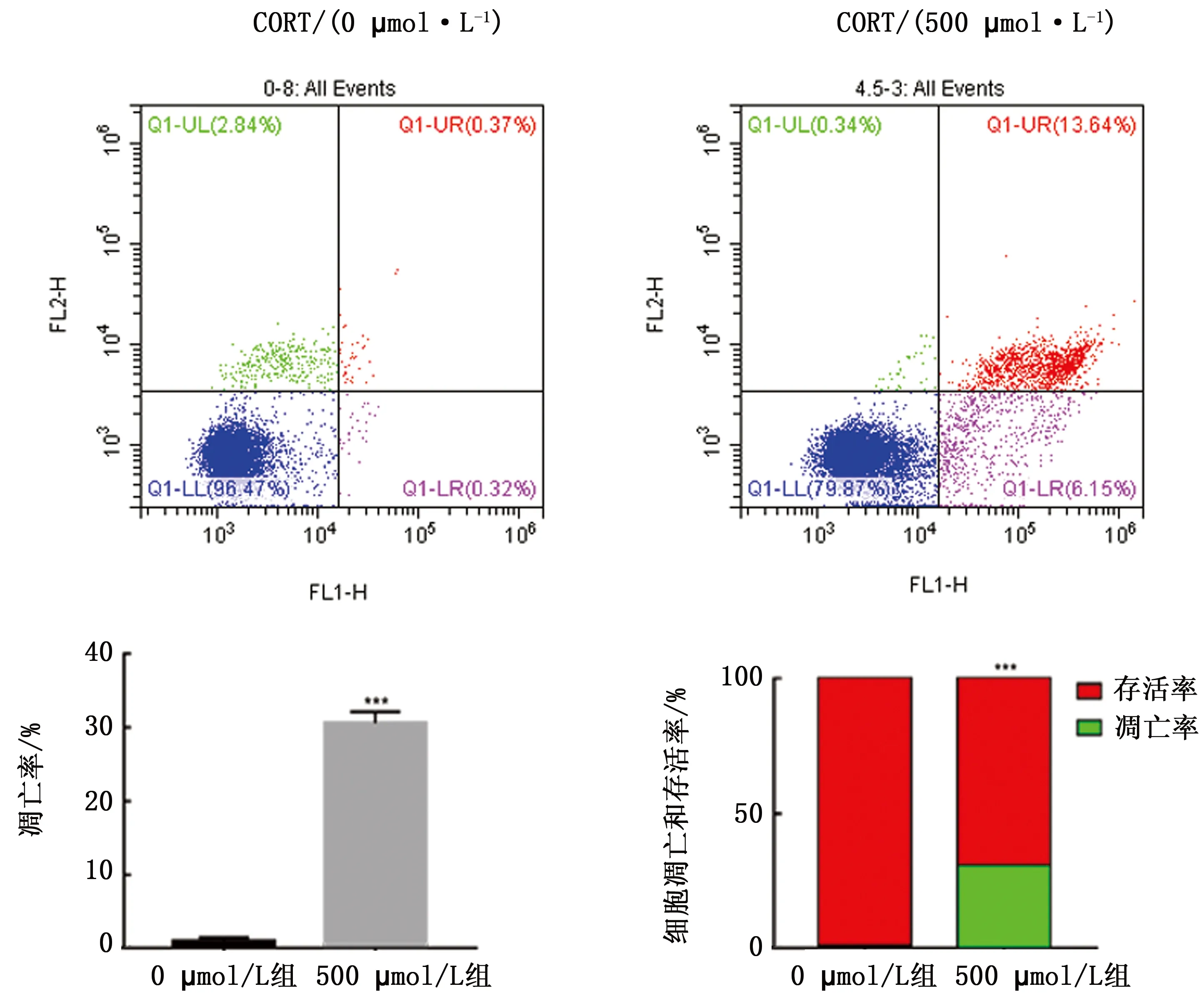
图2 CORT处理后HT22细胞凋亡情况

图3 CORT处理后HT22细胞凋亡情况 A1~A3对照组; B1~B3.500 μmol/L CORT处理组

图4 CORT对HT22细胞线粒体膜电位的影响
线粒体是细胞产生ROS的主要部位,同时线粒体当中产生的ROS又会以攻击线粒体DNA(mtDNA)等方式破坏线粒体,因此线粒体与氧化应激有密切关系[11]。一项采用PC12细胞的研究表明,慢性CORT处理通过降低线粒体呼吸链复合物I的活性以及SOD的活性,造成了对胞内蛋白质的氧化损伤[18]。这提示应激情况下机体分泌的糖皮质激素可能通过直接损伤线粒体来诱导海马神经元凋亡。
因此,本试验检测了CORT处理后的线粒体膜电位,以进一步探究CORT引起HT22细胞凋亡的机制。结果显示CORT处理后HT22细胞线粒体膜电位显著下降。而线粒体是细胞氧化磷酸化的重要场所,线粒体功能障碍将对细胞造成灾难性的后果。据报道,糖皮质激素对于线粒体功能的调节是双相的:低剂量的CORT短时间处理可以加强皮质神经元线粒体上GR与Bcl-2 复合物的形成,增强线粒体膜电位和钙保持能力,具有神经元保护作用;但是大剂量的CORT长时间处理会产生相反效果、增强兴奋性氨基酸的神经毒性[3,19]。这种CORT对皮层神经元线粒体的双相效应可能同样存在于海马神经元,本试验中采用的500 μmol/L CORT时长3 h的处理已经造成了HT22细胞线粒体膜电位下降,很显然这种浓度和时长的CORT处理已经超过了对神经元具有保护作用的范围,转而损害了线粒体的功能。

图5 CORT对HT22细胞凋亡相关蛋白表达水平的影响 ***.示与对照组相比,差异极显著(P<0.001);A.Western blot;B.Bax/Bcl-2比值;C.Cyt-c相对表达水平;D.Cleaved-C-3/Pro-Caspase-3
线粒体在细胞凋亡调控中发挥重要作用,线粒体膜电位下降是内源性凋亡的早期标志[20]。细胞受到应激或者辐射等凋亡刺激因素时,Bax等促凋亡蛋白会易位到线粒体,使线粒体通透性转换孔(MPTP)由正常的周期性开放转变为异常的持续性开放,这导致线粒体膜电位降低,位于线粒体内外膜之间的Cyt-c释放到胞质[20-21]。Cyt-c在胞质内首先与细胞凋亡活化因子(Apaf-1)结合,Apaf-1在无刺激的情况下在胞质内以单体形式存在,Cyt-c的结合使得Apaf-1的核苷酸结合结构域与dATP的亲和力增强,与dATP结合后Apaf-1以及Cyt-c复合物发生寡聚化形成凋亡小体,Apaf-1才可以通过其半胱天冬酶募集结构域(CARD)募集多个Caspase-9前体,促进Caspase-9自激活[21-22]。活化的Caspase-9又可以激活Caspase-3,活化的Caspase-3破坏核纤层以及细胞骨架蛋白等胞内关键物质,是细胞凋亡具体的执行者[10,23]。因此,本研究中经CORT处理的HT22细胞中活化的Caspase-3与Capase-3前体的比值显著升高,Cyt-c的表达水平也显著升高,说明CORT诱导HT22细胞发生了内源性线粒体通路介导的凋亡。
在内源性凋亡途径中,Bcl-2家族蛋白可以首先响应于ROS等刺激因素并发生变化,其易位到线粒体膜并触发了线粒体的一系列变化。抗凋亡蛋白Bcl-xl可以与MPTP的组分电压依赖性阴离子孔道蛋白(VDAC)相互作用,抑制膜间隙中Cyt-c的释放,而Bax、Bak会加速VDAC的开放并允许Cyt-c通过VDAC[20,24]。Bcl-2可以与Bax形成异源二聚体而中和Bax的凋亡诱导效应,通过这种蛋白间的竞争性二聚作用,Bcl-2抑制Bax同源二聚体的形成并发挥抗凋亡作用[25]。因此,在细胞受到凋亡因素刺激后,Bax/Bcl-2的比值决定了细胞是走向凋亡还是继续存活[26-27]。本试验结果中,经CORT处理的细胞Bax/Bcl-2比值显著升高,说明CORT处理诱导HT22细胞发生了凋亡。
综上所述,本试验在细胞水平探讨了CORT引发海马神经元凋亡的机制,证实线粒体凋亡通路在其中发挥的重要作用。提示我们未来可以尝试从线粒体着手,寻找解决应激损害大脑的方法。
