Lys-GO 对PLCL 形状记忆纤维的力学增强和成骨诱导作用
2020-09-25易兵成王先流沈炎冰秦春萍张彦中
刘 畅, 易兵成, 王先流, 沈炎冰, 秦春萍, 张彦中
(东华大学化学化工与生物工程学院,上海 201620)
在全球范围内,每年有成千上万的患者因严重创伤、感染或肿瘤等造成大面积骨缺损,这在很大程度上影响了患者的健康和生存质量。目前,用于骨移植的材料主要包括自体骨、同种异体骨以及异种骨[1],由于这些骨移植物均存在局限性和不足,骨组织工程技术已成为最有潜力的一种解决方案[2]。骨组织工程技术的基本方法是将生物材料支架作为生长因子和细胞的载体来诱导成骨, 或从周围骨组织募集细胞使其原位生长和分化,最终形成新骨[3]。骨组织是承力组织,力学刺激对细胞的成骨诱导分化起着重要作用[4],因此,通过生物材料支架合理施加和调节力学刺激促进骨修复是骨组织工程支架设计的关键。
形状记忆聚合物(SMPs)的出现为发展可原位施加力学刺激的力学主动式骨组织工程支架提供了新思路[5]。SMPs 是一类能够在外界刺激下回复到初始状态的智能高分子材料,在回复过程中材料如果与周围骨组织接触,就会对骨产生力学刺激,对力学微环境有很好的仿生效果[6]。此外,SMPs 还具有可实现保形微创植入[7]、控制药物释放速率[8]等优点,在发展多功能组织工程支架方面具有较大的应用潜力。但是,SMPs 作为一种形状记忆材料,与其他形状记忆材料如形状记忆合金(SMAs)相比,存在着形状回复力较弱的问题(回复应力通常小于5 MPa[9]),且一些常见的生物降解聚酯类SMPs 的生物活性不佳、体内降解产物呈酸性容易引起无菌炎症也是广受关注的共性问题[10]。
过去通常采取添加超细纤维[11]、碳纳米管或碳纳米纤维[12]、纳米黏土[13]、纳米碳化硅[14]、炭黑[15]以及其他无机或有机填料等方式增强SMPs 的动态、静态力学性能。氧化石墨烯(GO)作为一种二维(2D)纳米片材料,不仅具有杨氏模量高和易于表面功能化等特点,而且具有可用于细胞附着的活性位点、增强细胞的黏附和增殖[16]等优势,已被用于生物医学领域。赖氨酸(Lys)是一种具有生物活性的碱性氨基酸,其分子结构上含有两个氨基(—NH2)和一个羧基(—COOH),如果将Lys 这种碱性氨基酸和GO 纳米增强材料共同引入SMPs,不仅可以增强SMPs 的力学性能,而且可以中和酸性降解产物、缓解炎症反应和提高SMPs 的生物活性,能为解决一些代表性聚酯类SMPs 的共性问题提供新思路。
乳酸-己内酯共聚物(PLCL)是常用的具有形状记忆特性的组织工程支架构建材料[17]。本课题组[18]之前的研究表明,PLCL 基纳米纤维膜的形状记忆转变温度(即玻璃化转变温度Tg)在38 ℃左右,形状固定率和形状回复率均在96%以上,形状记忆性能良好。基于以上背景,本文将经Lys 功能化后的GO(Lys-GO)通过电纺丝引入到PLCL 纤维中,形成Lys-GO/PLCL 纤维,并通过一系列的材料表征和生物学评价,研究Lys-GO 对具形状记忆效应的PLCL 纤维膜的力学增强和成骨诱导作用。为此,本文首先研究了GO 对PLCL 纤维膜的力学增强作用,优化GO 的添加量并考察其形状回复力;然后探讨了Lys-GO 的引入对所形成的Lys-GO/PLCL 纤维膜的力学增强和酸性降解产物的中和作用;最后通过体外细胞增殖、黏附和矿化实验评价了Lys-GO/PLCL 的诱导成骨能力。
1 实验部分
1.1 原料和试剂
PLCL:医用级,乳酸与己内酯共聚投料物质的量之比为90/10,特性黏度为3.6 dL/g,济南岱罡生物工程有限公司;GO:医用级,片径0.5~5 μm,厚度0.8~1.2 nm,南京先丰纳米材料科技有限公司;Lys:医用级,国药集团化学试剂有限公司;N-羟基琥珀酰亚胺(NHS)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDC):气相色谱级,上海梯希爱化成工业发展有限公司;六氟异丙醇(HFIP):分析纯,上海达瑞精细品化学有限公司;蛋白酶K(比活3.0~15.0 U/mg):医用级,Sigma 公司;磷酸盐缓冲剂(PBS):医用级,北京鼎国昌盛生物技术有限责任公司;鼠源骨髓间充质干细胞(rBMSCs):本实验室自提;胎牛血清(FBS):细胞培养级,美国Gibco 公司;杜氏改良Eagle 培养基营养混合物F-12(DMEM/F12)培养液:细胞培养级,杭州吉诺生物医药技术有限公司;细胞计数试剂盒(CCK-8)、碱性磷酸酯酶显色试剂盒:细胞培养级,上海碧云天生物技术有限公司;胰蛋白酶:细胞培养级,上海迈基生物有限公司;罗丹明-鬼笔环肽(Phalloidin):细胞培养级,美国Invitrogen 公司;4,6-二脒基-2-苯基吲哚(DAPI):细胞培养级,瑞士Roche 公司;碱性磷酸酶测试盒:细胞培养级,南京建成生物工程研究所;茜素红染色液:细胞培养级,北京索莱宝科技有限公司;聚乙二醇辛基苯基醚(Triton X-100):细胞培养级,国药集团化学试剂有限公司。
1.2 测试与表征
扫描电子显微镜(SEM):上海复纳科学仪器有限公司Phenom XL 型;傅里叶红外光谱(FT-IR)仪:美国Nicolet 公司NEXUS-670 型;差示扫描量热(DSC)分析仪:德国耐驰仪器制造有限公司DSC-822 型;X 射线光电子能谱(XPS)仪:日本岛津Kratos 公司1/AXIS UltraDLD 型;电子力学测试机:上海恒驭仪器有限公司HY-940FS 型;数显拉力计:中国艾普计量仪器有限公司SF-5 型;pH 计:上海精密科学仪器有限公司PHSJ-4A 型;酶标仪:美国Thermo Fisher Scientific 公司MK3 型;倒置荧光显微镜:日本Nikon 公司Nikon TI-S 型。
1.3 GO/PLCL 纳米纤维膜的制备及性能表征
在常温下分别按m(GO)∶m(PLCL)为0,0.5%,1%,2%配制纺丝液。为使GO 均匀分散,首先将GO 置于HFIP 中冰浴超声90 min,然后加入PLCL 搅拌过夜配成PLCL 质量浓度为0.10 g/mL 的纺丝液进行电纺丝。PLCL 纤维的纺丝参数如下:电压15 kV,注射速率1 mL/h,接收距离15 cm,湿度50%~70%,室温。GO/PLCL纤维的纺丝参数为:电压8~13 kV,接收距离12 cm,其他纺丝条件与PLCL 纤维保持一致。将制备的电纺纤维膜置于真空干燥箱中72 h 以上,以除去残留溶剂。
通过SEM 观察各纤维膜的形貌,并用Image J 统计纤维直径。采用DSC 进行热分析。采用电子力学测试机进行拉伸力学测试。
采用数显拉力计进行回复力测试:先将纤维膜在40 ℃水浴中拉伸30%,0 ℃下固定做塑形处理。然后将纤维膜的一端固定在水浴锅底部夹子上,另一端固定在数显拉力计上。将样品固定好后,调节数显拉力计的高度至刚好有示数。随后在水浴锅中加入40 ℃的蒸馏水,记录拉力计上的数值并进行统计。
1.4 Lys-GO/PLCL 纳米纤维膜的制备及性能表征
1.4.1 Lys 对GO 的化学嫁接 参照文献[19]的方法对GO 进行Lys 化学嫁接,然后将经Lys 接枝的GO 用大量蒸馏水和乙醇离心(3 000 r/min)洗涤3 次,以除去未反应的Lys,室温下自然干燥得到Lys-GO。通过FT-IR 对Lys-GO 的结构进行表征。采用XPS 检测Lys-GO 的分峰情况及氮含量。
1.4.2 Lys-GO/PLCL 纳米纤维膜的制备与酸度中和作用 Lys-GO/PLCL 纳米纤维膜的制备方法同GO/PLCL 膜,m(Lys-GO)∶m(PLCL)=0.5%。对制备的电纺纤维膜在真空干燥箱中进行干燥处理。对GO/PLCL(0.5/100,质量比,下文同)和Lys-GO/PLCL(0.5/100)纳米纤维膜进行形貌、拉伸力学、形状回复力等表征。
GO/PLCL 和Lys-GO/PLCL 纳米纤维膜降解液的pH 测定方法为:将尺寸为50 mm×50 mm 纤维膜样品放入离心管中;然后用PBS 配制质量浓度为0.2 mg/mL 的蛋白酶K 降解液,每管加入5 mL;最后检测降解0、12、24、36、48、60 h 后降解液的pH。
1.5 Lys-GO/PLCL 纳米纤维膜的成骨诱导作用
1.5.1 支架材料的制备及处理 用经干燥处理的玻片接收PLCL、GO/PLCL、Lys-GO/PLCL 这3 种电纺纳米纤维,并在真空干燥箱中干燥7 d 以上。之后,将覆有纳米纤维膜的玻片置于24 孔板中,紫外照射过夜;放入钢环,于酒精中浸泡2 h;吸掉酒精,PBS 洗涤3 次;培养基预培养过夜。
1.5.2 细胞种板 从液氮中取出冻存的rBMSCs(2~4 代),置于37 ℃环境下进行细胞复苏并培养2 d 后放在培养箱中消化。消化完成后,取样10 μL 加入计数板中计数,每孔按照2×104个细胞的种植密度和500 μL 的培养基进行种板(24 孔板),每2 d 换液1 次。
1.5.3 体外细胞相容性 细胞增殖:将rBMSCs 分别种植在PLCL、GO/PLCL 及Lys-GO/PLCL 这3 种纳米纤维支架上,培养1、4、7 d 后进行检测(每2 d 换液1 次)。吸掉培养基,加入PBS 清洗3 次,在避光条件下每孔加入400 μL 含10 μL 的CCK-8 培养基,在37 ℃培养箱中避光孵育4 h 后,每孔取样100 μL加入到96 孔板中,用酶标仪检测450 nm 处的吸光度(OD)。
荧光染色:将rBMSCs 分别种植在PLCL、GO/PLCL 及Lys-GO/PLCL 这3 种纳米纤维支架上,培养4 d 后进行检测(每2 d 换液1 次)。先吸去培养基,加入PBS 清洗3 次,加入0.04 g/mL 的多聚甲醛固定细胞,30 min后吸去多聚甲醛,再用PBS 清洗3 次。每孔加入400 μL 的Triton X-100(体积分数0.1%),10 min 后吸除,PBS清洗3 次。避光加入Phalloidin(5 μg/mL),每孔400 μL,染色30 min。然后用PBS 清洗3 次,加入DAPI(1 μg/mL),每孔400 μL,染色15 min 后吸除,PBS 清洗3 次。最后在避光条件下用荧光显微镜观察。
SEM 观察:将rBMSCs 分别种植在PLCL、GO/PLCL 及Lys-GO/PLCL 这3 种纳米纤维支架上,培养7 d后进行检测(每2 d 换液1 次)。吸去培养基,用PBS 清洗3 次。加入4%多聚甲醛固定细胞30 min。吸掉多聚甲醛,用PBS 清洗3 次。将配制好的梯度酒精(质量分数分别为50%、70%、80%、90%、95%及100%)加入到24 孔板中进行细胞脱水,最后放在干燥箱中干燥,在SEM 下观察。
1.5.4 体外成骨性能 碱性磷酸酶(ALP)染色:将rBMSCs 分别种植在PLCL、GO/PLCL 及Lys-GO/PLCL 这3 种纳米纤维支架上,培养14 d 后进行检测(每2 d 换液1 次)。吸掉培养基,用PBS 清洗3 次,每孔加入200 μL 0.04 g/mL 的多聚甲醛固定30 min。吸去多聚甲醛,用无菌水洗涤3 次。按照试剂盒说明加入染色工作液(碱性磷酸酯酶显色缓冲液-氯化硝基四氮唑兰-5-溴-4-氯-3-吲哚基磷酸盐混合液(体积比为1∶150∶300),在室温下避光反应30 min 后观察显色情况,无菌水洗涤3 次,在显微镜下观察。
ALP 定量:将rBMSCs 分别种植在PLCL、GO/PLCL 及Lys-GO/PLCL 这3 种纳米纤维支架上,培养14 d后进行检测(每2 d 换液1 次)。吸去培养基,用Triton X-100(体积分数1%)进行细胞裂解。30 min 后将裂解液移至离心管中离心5 min(1 000 r/min)。取上清液30 μL 加入96 孔板中,无菌水和标准液作为对照组。按照碱性磷酸酶试剂盒说明加入缓冲液和基质液(每孔50 μL)后,37 ℃下水浴静置15 min。最后加入150 μL显色剂,用酶标仪检测520 nm 处的吸光度。
茜素红(ARS)染色:将rBMSCs 分别种植在PLCL、GO/PLCL 及Lys-GO/PLCL 这3 种纳米纤维支架上,培养14 d 后进行检测(每2 d 换液1 次)。吸去培养基,加入PBS 清洗3 次,加入体积分数60%的异丙醇(每孔200 μL)固定1 min。吸去异丙醇后用无菌水清洗3 次。每孔加入200 μL 的ARS 染色液,室温下孵育10 min。吸去染色液,用水洗涤至洗液无色,在显微镜下观察。
1.6 统计学分析
采用Origin 8.0 对数据进行分析。利用One way ANOVA 进行方差分析,评价样品之间是否存在显著性差异(*P<0.05 为显著性差异,**P<0.01 为极显著性差异)。
2 结果与讨论
2.1 GO 对PLCL 形状记忆纤维膜的力学增强作用
电纺纤维膜的微纳米结构可以促进干细胞向成骨细胞分化,并在植入体内后有效促进骨再生[20]。本文通过电纺丝技术分别制备了PLCL、GO/PLCL(0.5/100)、GO/PLCL(1/100)及GO/PLCL(2/100)4 种超细纤维膜。它们的纤维形貌良好,尺寸均一,纤维细度为670~750 nm(图1(a)),但随着GO 的用量增加,纤维表面出现明显的GO 团聚现象, GO 的不均匀分布对纤维膜的力学性能不利。
PLCL 作为一种可降解形状记忆聚合物,其形状记忆转变温度为Tg[21]。GO 用量对PLCL 纤维膜Tg的影响如图1(b)所示,纯PLCL 纳米纤维膜的Tg是40.0 ℃,随着PLCL 中引入GO 的增加,GO/PLCL 复合纳米纤维膜的Tg分别降为39.6、38.6 ℃和38.1 ℃,GO 的引入使该形状记忆纤维膜的Tg更接近人体温度,利于其在体温下实现回复,减少因为利用外源热刺激实现形状回复时温度过高带来的细胞损伤[22]。图1(c,d)的力学性能曲线表明,与PLCL 膜相比GO/PLCL(0.5/100)的拉伸强度和杨氏模量均有显著增加。这是因为在较低的GO 用量下,GO 可以改善其与聚合物基体的界面接触和相互作用[23]。然而,当GO 的用量继续增加时,PLCL 的杨氏模量无明显变化,但拉伸强度明显降低。这可能是因为GO 的团聚产生了应力集中点,导致拉伸强度下降。
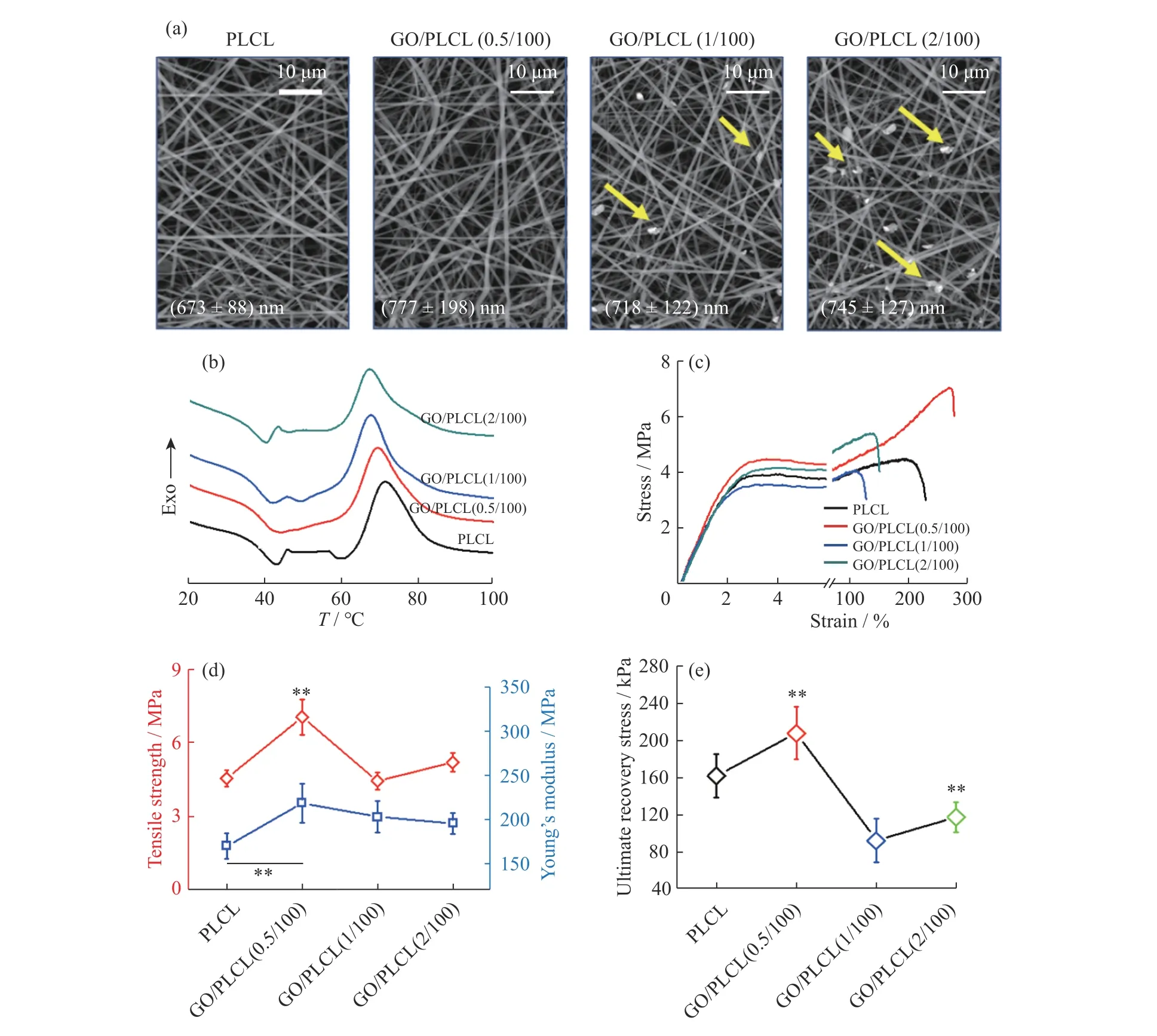
图1 纳米纤维膜的SEM 照片(a)、DSC 曲线(b)、拉伸应力-应变曲线(c)、拉伸力学性能(d)及形状回复力(e)Fig.1 SEM images (a), DSC curves (b), tensile stress-strain curves (c), tensile properties (d) and shape recovery stress (e) of the nanofiber films
GO 的引入对PLCL 形状记忆纤维膜的形状回复力影响见图1(e)所示。同样,GO/PLCL(0.5/100)纤维膜的形状回复力最佳,比PLCL 膜的形状回复力提高了28.3%。形状回复力由大变小再略微变大,说明回复力增强效果与GO 的分散性和用量均有关,其中使GO 获得良好分散显得尤为重要。
2.2 Lys-GO 对PLCL 形状记忆纤维膜的力学性能影响和降解产物的酸度中和作用
2.2.1 Lys 对GO 的化学嫁接 GO 片层的表面覆盖有大量含氧官能团,如位于石墨烯片基平面上的环氧基、羟基和连接在片基平面边缘的羧基[24]。这些反应位点适合与氨基或羟基反应形成酰胺键或酯键如图2(a)所示。FT-IR 分析GO 与Lys 的共价嫁接情况(图2(b))表明,在GO 的红外谱图中有4 个特征峰,即在1 035 cm-1处的C―O―C 拉伸振动峰,1 610 cm-1处的sp2碳骨架结构中C―C 拉伸振动峰,1 724 cm-1处羧基中C―O 的拉伸振动峰以及3 425 cm-1处O―H 的拉伸振动峰[25]。Lys 在2 923 cm-1和1 575 cm-1处存在―CH2和―COO 基团的特征峰。Lys 与GO 嫁接之后,由于酰胺键的形成,在1 036 cm-1处形成C―N特征峰,在1 590 cm-1处出现C=O 的宽峰,而3 220 cm-1处的特征峰归因于N―H 的拉伸振动。这些结果说明Lys 已经成功嫁接到GO 上[26]。
对GO 和Lys-GO 纳米片层进行XPS 分析的结果见图2(c)。可以看到,GO 在285 eV 和534 eV 处出现C1s 和O1s 峰,而Lys-GO 在400 eV 处出现了N1s 峰,表明GO 表面存在氨基,说明GO 与Lys 的确发生了嫁接[27]。对GO 和Lys-GO 的碳、氧和氮元素的含量统计结果表明,Lys-GO 的碳氧比是GO 的1.9 倍,这可能是因为在嫁接过程中―COOH 与―NH2反应,形成了酰胺键。此外,检测到Lys-GO 中的氮质量分数为7.12%。
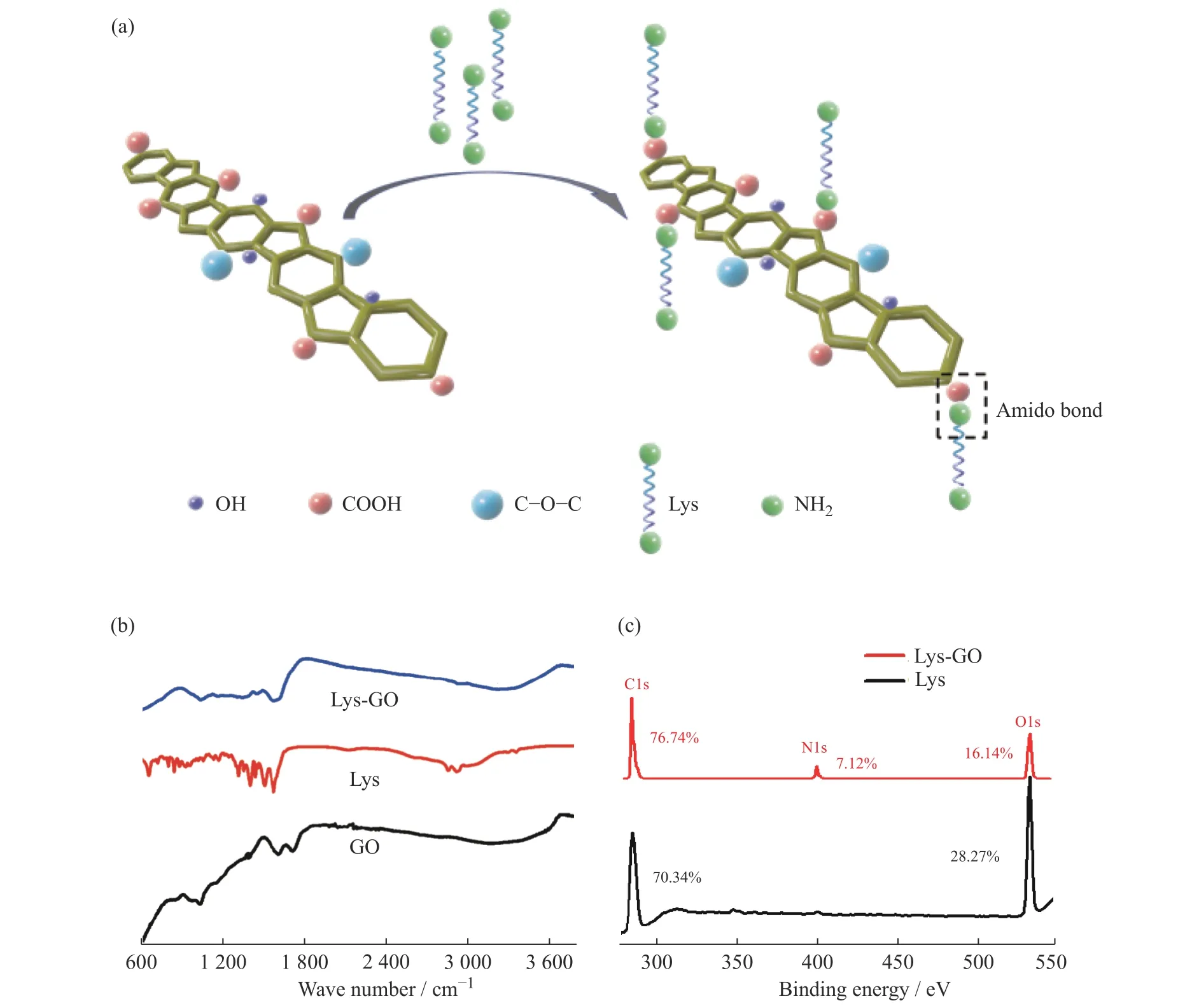
图2 Lys 与GO 的化学嫁接示意图(a),Lys-GO 的红外光谱图(b)和XPS 谱图(c)Fig.2 Schematic of the chemical grafting of Lys to GO (a), FT-IR (b) and XPS spectra(c) of Lys-GO
2.2.2 Lys-GO/PLCL 复合纳米纤维膜的力学性能与酸度中和作用 GO/PLCL 与Lys-GO/PLCL 纳米纤维膜在室温(25 ℃)下的拉伸力学性能见图3(a,b)。从结果可以看出,与GO/PLCL 膜相比,Lys-GO/PLCL 膜的拉伸强度和杨氏模量等变化不大(性能保留大于85%),但明显高于未增强的PLCL 膜(图1(d))。力学性能的略微降低可能是因为Lys 的引入会破坏纳米纤维膜的规整结构,使纤维膜的结晶度降低,导致拉伸性能降低。
GO/PLCL 与Lys-GO/PLCL 纳米纤维膜在40 ℃水浴中的形状回复力测试结果见图3(c),两者的最大回复力分别为(207.50 ± 28.00) kPa 和(195.00 ± 13.99) kPa,后者的形状回复力较前者下降了约6%。
在37 ℃下对GO/PLCL 与Lys-GO/PLCL 纳米纤维膜同时进行60 h 的酶解降解并检测降解液的pH 变化,结果见图3(d)。可以看出,Lys-GO/PLCL 纳米纤维膜降解液的pH 高于GO/PLCL 膜的,并维持在5.2 左右,而GO/PLCL 膜降解液的pH 最终维持在4.2 左右。说明Lys-GO/PLCL 膜在降解过程中对酸性降解产物有一定的中和效果,但仍然偏酸性。
2.3 Lys-GO 对PLCL 形状记忆纤维膜成骨分化性能的影响
2.3.1 Lys-GO/PLCL 复合纳米纤维膜的细胞相容性 rBMSCs 在PLCL、GO/PLCL 与Lys-GO/PLCL 支架上的增殖情况见图4(a)。从图中可以看出,rBMSCs 在支架上培养1 d 与4 d 时,3 组rBMSCs 增殖无显著性差异;到第7 d 时rBMSCs 在Lys-GO/PLCL 与PLCL 支架上的增殖有显著性差异,说明Lys-GO 的引入可促进rBMSCs 的增殖。
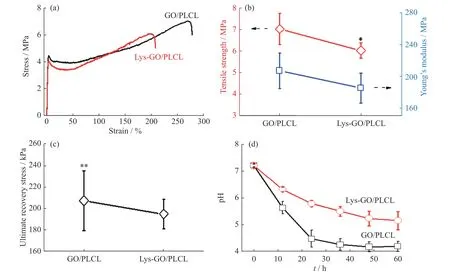
图3 纳米纤维膜的拉伸应力-应变曲线(a),拉伸强度和杨氏模量(b),形状回复力(c)以及酸度中和效果检测(d)Fig.3 Tensile stress-strain curves (a), tensile strength and Young’s modulus (b), shape recovery stress (c) and acidity neutralizing effect (d)of the nanofiber films

图4 rBMSCs 在PLCL、GO/PLCL 与Lys-GO/PLCL 支架上的增殖情况(a)、荧光染色图(t =4 d)(b)、SEM 照片(t =7 d)(c)、ALP 染色和定量统计图(t =14 d)(d)及ARS 染色图(t =14 d)(e)Fig.4 Proliferation (a), Fluorescence staining (t =4 d) (b), SEM images (t =7 d) (c), ALP staining images and quantitative measurements(t =14 d) (d) and ARS staining (t =14 d) (e) of rBMSCs cultured on the nanofibrous scaffolds
rBMSCs 在染色4 d 的细胞支架上的铺展和生长形态见图4(b),PLCL 上的rBMSCs 呈团聚态,GO/PLCL上培养的rBMSCs 形态有所改善,Lys-GO/PLCL 上培养的rBMSCs 黏附性和伸展性最好,出现了形状良好的肌动蛋白和丝状伪足。细胞培养7 d 的支架SEM 形貌观察见图4(c),rBMSCs 在Lys-GO/PLCL 支架上的铺展面积明显大于在PLCL 和GO/PLCL 上的,且rBMSCs 相互交织,这与支架材料中负载的生物活性成分Lys有关。这些结果均说明Lys-GO/PLCL 具有良好的细胞相容性。
2.3.2 Lys-GO/PLCL 复合纳米纤维膜的成骨分化性能 ALP 是成骨分化的标志性蛋白,反映干细胞向成骨细胞分化的程度[28]。将rBMSCs 分别种植在PLCL、GO/PLCL 与Lys-GO/PLCL 支架上培养14 d,ALP 分泌情况的染色和定量分析结果见图4(d)。可以看出,GO/PLCL 与Lys-GO/PLCL 支架上的ALP 分泌量明显高于PLCL,其中以Lys-GO/PLCL 上的ALP 分泌量最多,说明Lys-GO 的引入更能促进细胞ALP 的分泌和成骨分化。
钙沉积是骨生长中的重要环节,也是骨细胞成骨分化的重要标志[29]。本文利用ARS 染色定性检测rBMSCs 在PLCL、GO/PLCL 与Lys-GO/PLCL 这3 种支架上的钙沉积情况,评估细胞在这些支架上的成骨矿化能力。rBMSCs 在3 种支架上培养14 d 的钙沉积结果见图4(e),其结果与ALP 检测结果一致,说明Lys-GO 的加入有利于钙沉积和成骨诱导。
3 结 论
(1)采用电纺方法制备了纤维膜状的GO/PLCL 骨组织工程支架,GO/PLCL(0.5/100)纤维膜形貌良好,直径在700 nm 左右,Tg为39.6 ℃,更接近于人体温度,与PLCL 支架相比,其杨氏模量提高了28.4%,形状回复力提高了28.3%。
(2)Lys-GO/PLCL 复合纳米纤维膜在基本维持GO/PLCL 纤维膜的力学性能以及形状记忆性能的基础上,可有效解决PLCL 存在的降解酸性问题。
(3)Lys-GO/PLCL 支架更有利于rBMSCs 的增殖、铺展与成骨分化。
