人乳头瘤病毒疫苗的发明专利分析
2020-09-24陶然李秋彤
陶然 李秋彤
摘要:人乳头瘤病毒(HPV)可诱发宫颈癌等上皮相关的恶性肿瘤疾病,严重威胁人类健康,研制疫苗能够有效预防和治疗其感染。本文分析了HPV疫苗相关专利的主要申请人及其核心专利,以期为我国HPV疫苗的开发方向和专利申请提供參考。
关键词:人乳头瘤病毒;HPV;疫苗;专利
中图分类号:G306;R737.33 文献标识码:A 文章编号:1003-5168(2020)27-0106-03
1 序言
人乳头瘤病毒(HPV)是一种属于乳多空病毒科乳头瘤空泡病毒A属的无包膜闭环双链DNA病毒[1]。目前,其已知基因型多达200种,根据对宿主细胞的转化能力和致癌能力可分为高危型和低危型。高危型HPV的持续反复感染可导致多种恶性肿瘤疾病如宫颈癌等的发生。近年来,通过研制疫苗预防和治疗由HPV感染导致的疾病成为临床研究热点。
HPV疫苗根据功能可分为预防性和治疗性。HPV衣壳蛋白L1高度保守,是其型特异性抗原,而衣壳蛋白L2变异度较高,与其抗原多态性相关[2]。L1/L2蛋白体外表达形成的重组病毒样颗粒(VLP)不具有感染能力,但保留免疫原性,可诱导机体产生特异性抗体中和病毒,预防HPV感染。早期蛋白E6和E7是HPV主要致癌蛋白 [3],为治疗性疫苗的重要靶点。
2006年,Gardasil 4(Merck,HPV6/11/16/18)成为全球首个上市的HPV预防性疫苗。2009年,Cervarix(GSK,HPV16/18)获批在美上市。2014年,推出新一代疫苗Gardasil 9(Merck,HPV6/11/16/18/31/33/45/52/58),拓宽了预防范围。我国首个国产HPV预防性疫苗Cecolin(万泰生物,隶属养生堂有限公司,HPV16/18)于2020年5月获批。而HPV治疗性疫苗仍然处于临床试验的早期阶段。
自HPV疫苗上市以来,受到了女性群体的广泛关注,九价疫苗更是一针难求、依赖国外产品,因此,亟需加快国产疫苗的研究。本文从专利角度对HPV疫苗相关技术进行总结,以期为我国HPV疫苗的开发和专利申请提供参考。
2 主要申请人分析
使用DWPI检索HPV疫苗专利,获得初步结果后进行人工去噪,数据截止2020年7月。
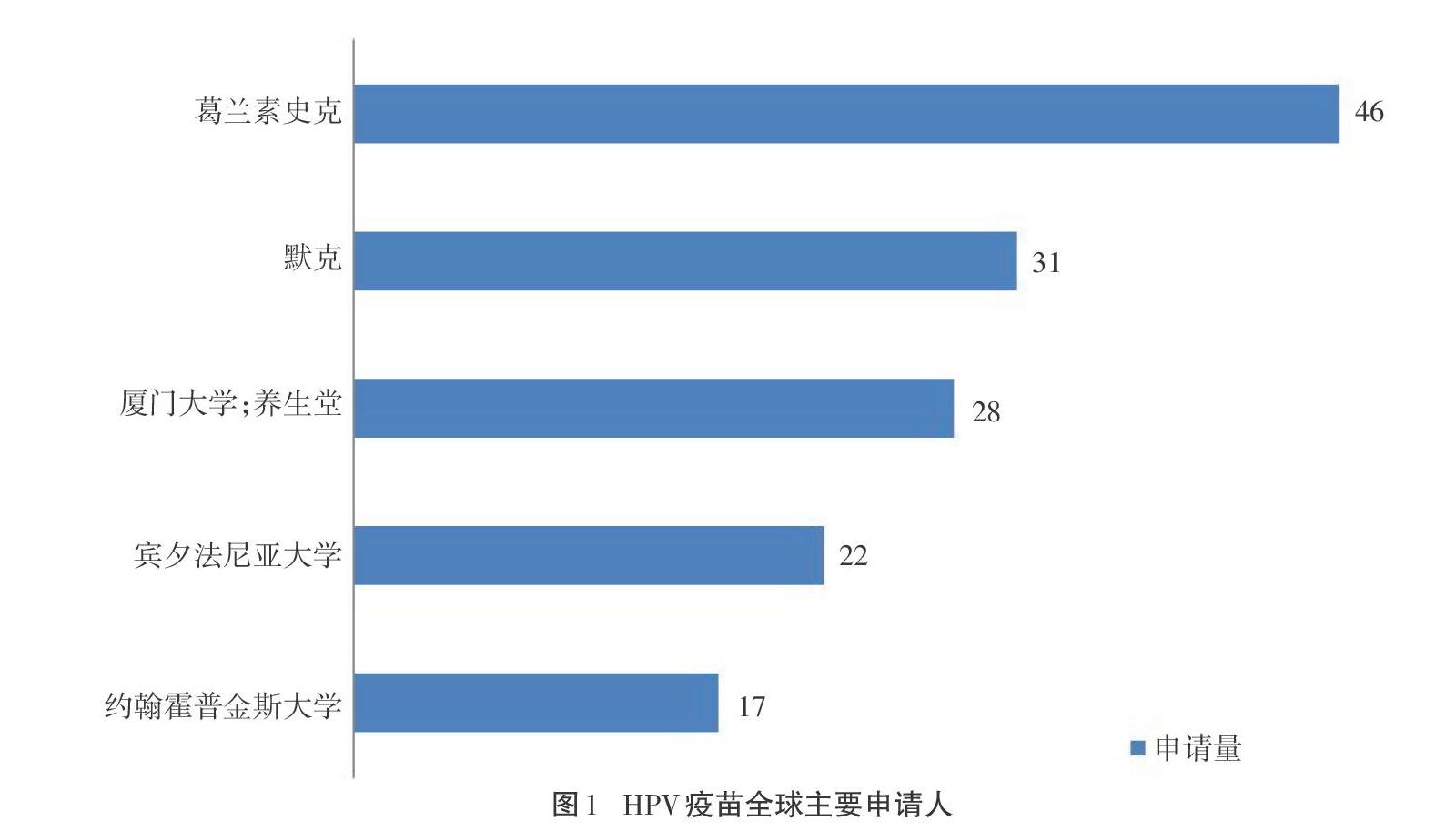
图1显示了全球HPV疫苗专利申请量排名。其中,英国葛兰素史克公司、德国默克集团、厦门大学和养生堂集团的专利申请量占有绝对优势,且三者均拥有上市疫苗产品。本文对上述申请人的核心专利进行了梳理。
3 重点申请人核心专利分析
3.1 葛兰素史克
葛兰素史克首个HPV疫苗专利申请始于1998年,EP1007551B1公开了一种包含融合蛋白的疫苗组合物,在E6/E7蛋白中引入突变以消除其潜在的转化能力作为抗原,然后连接至流感嗜血菌B的蛋白D,该疫苗激活与CD4+ T细胞有关的抗肿瘤免疫应答,治疗HPV诱导的肿瘤病变。之后,葛兰素史克专注于预防性疫苗的专利布局,技术分支包括VLP制备、多价疫苗、多联疫苗。
对于VLP制备,WO03078455A2采用昆虫细胞作为生产系统;US20120087937A1在HPV18L1多肽中插入L2表位肽制备嵌合VLP。
对于多价疫苗,CN1325117C公开了包含HPV16/18的L1 VLPs、氢氧化铝和3D-MPL的疫苗,其为Cervarix的核心专利;CN100528226C公开了包含HPV16/18/31/45的L1蛋白的疫苗组合物;CN1976718B公开了包含HPV16/18和至少一种选自HPV31/45/52的VLP的免疫原性组合物,其中HPV31/45/52的剂量少于HPV16/18,其特点在于HPV16/18的VLP可提供对HPV31/45/52的交叉保护。
对于多联疫苗,包括HPV、HBV、HSV、HIV等的联合疫苗组合物(EP1064025B1、CN1522153A、CN1171637C)。
3.2 默克
CA2022394A1是默克首个HPV疫苗专利申请,始于1990年,公开了一种多肽,能有效阻断HPV E7蛋白与视网膜母细胞瘤基因编码的蛋白的结合,用于治疗生殖器疣和宫颈癌。此后,还于1992年和1998年再次提交了治疗性疫苗专利申请,但主要申请方向也转向了预防性疫苗领域,技术分支包括L1/L2蛋白制备、多价疫苗、蛋白和疫苗的稳定。
对于L1/L2蛋白制备,CN1152935A、CN1100876C、CN1154732C、US5821087A、US5888516A采用酵母细胞作为生产系统,涉及HPV6a/6b/11/16/18/31/33/35/41/45/58;EP1212358B1、CN100506999C、CN1859923B、CN1942
583B、CN1934131B优化L1蛋白编码基因的密码子或去除酵母识别的内部转录终止信号,提高酵母细胞中L1蛋白的表达;EP1105466B1公开了纯化VLP的方法,将细胞裂解物通过羟基磷灰石层析柱,然后用含磷酸根阴离子的溶液洗脱VLP,纯度至少为75%。
对于多价疫苗,US6689366B1公开了一种包含重组HPV6 L1蛋白的疫苗,所述蛋白还包含HPV11的构象表位,可产生针对两种病毒表位的中和抗体;US7709010B2公开了一种HPV疫苗制剂,包含至少一种HPV型别的重组L1/L2蛋白和铝佐剂、ISCOMATRIX佐剂,其为Gardasil 9的核心专利。
对于蛋白和疫苗的稳定,CN1259051A在HPV抗原制剂中添加50mM~500mM的氯化钠以及至少0.2%w/v的多乙氧基醚80,在2℃~8℃稳定至少1个月;US6251678B1添加盐、非离子表面活性剂和缓冲剂使HPV疫苗长期稳定;US6436402B1通过谷胱甘肽促进硫醇氧化和30-40℃高温孵育和/或暴露于可溶性金属表面使纯化的L1/L2蛋白成熟,所得VLP具有增加的保质期和更高效力;WO2012177970A1添加甘露醇和蔗糖增加冻干HPV抗原制剂稳定性。
