蜂毒前溶血肽原基因的改造及其原核表达
2020-09-24郭新军

摘要:为进一步探讨利用基因工程技术生产蜂毒肽的方法,根据大肠杆菌密码子偏好性、基因GC含量、合成蛋白加工需求等对蜂毒前溶血肽原基因序列进行改造,并利用人工化学合成方法完成改造后全基因的合成。构建蜂毒前溶血肽原与GST融合表达重组质粒pGEX-4T-1/PPMel,转化大肠杆菌BL21感受态细胞后分别在20、37 ℃条件下经异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达,并利用SDS-PAGE和Western Blot对产物进行检测。结果表明,表达体系成功表达了目的融合蛋白,在20 ℃条件下可获得可溶性表达产物,为进一步分离纯化目的蛋白及获得蜂毒肽提供了基础。
关键词:蜂毒前溶血肽原;蜂毒肽;原核表达;融合蛋白
中图分类号:Q789
文献标志码:A
文章编号:1002-1302(2020)16-0087-04
蜂毒肽(melittin)又称蜂毒溶血肽,是蜂毒(bee venom)的主要活性成分之一[1],在抗菌[2-3]、消炎[4]、抗肿瘤[5-6]乃至肌肉再生[7]等方面具有一定应用价值。目前基因工程技术为蜂毒肽生产提供了新的途径[8-9],但从研究到生产仍有一定距离。
蜂毒前溶血肽原(melittin precursor/Prepromelittin)是prepromelittin基因的表达产物,在蜜蜂体内合成后首先加工成蜂毒溶血肽原(蜂毒肽前体蛋白,promelittin),这是蜂毒肽的前体形式,可被进一步水解而形成蜂毒肽[10]。蜂毒前溶血肽原由70个氨基酸残基构成,其结构主要包括信号肽(1~21 aa,aa为氨基酸个数的缩写)、低复杂性区域(22~43 aa)和蜂毒肽结构域(44~69 aa)[11]。与蜂毒肽相比,蜂毒前溶血肽原具有较大的溶解度,且对细胞的破坏能力小[12],可以考虑作为利用基因工程方法在体外合成蜂毒肽的初始产物。
本研究通过全基因合成的方法合成了改造后的蜂毒前溶血肽原基因,构建了蜂毒前溶血肽原与谷胱甘肽S转移酶(glutathione S-transferase,GST)融合表达重组质粒,并在大肠杆菌BL21感受态细胞中诱导表达,获得了目的融合蛋白,为利用基因工程方法生产蜂毒肽提供了一定依据。
1 材料与方法
1.1 试验材料与主要试剂
表达载体pGEX-4T-1、大肠杆菌(Escherichia coli)TOP10感受态细胞、大肠杆菌BL21感受态细胞及Pfu DNA聚合酶、缓冲液A(PBS,pH值7.4)、缓冲液B[8 mol/L尿素(urea)、50 mmol/L Tris-HCl(三羟甲基氨基甲烷与盐酸配成的常用缓冲剂)、300 mmol/L 氯化钠,pH值8.0]、异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白Marker、TMB显色试剂盒、Western Blot一抗、Western Blot二抗等分子生物学试剂均由生工生物工程(上海)股份有限公司提供。
1.2 试验方法
1.2.1 基因改造、合成及扩增 蜂毒前溶血肽原基因序列信息来自NCBI GeneBank数据库(登录号:NM_001011607),选择其CDS序列,根据大肠杆菌密码子偏好并考虑其序列GC含量、酶切位点等信息对蜂毒前溶血肽原基因进行改造。利用CondonW等软件对改造后的序列最优密码子使用频率、GC含量(DNA的4种碱基中,鸟嘌呤和胞嘧啶所占的比率)等进行分析[13]。
根据改造后的基因序列,利用人工化学合成方法进行全基因合成,设计并合成引物对合成基因进行PCR扩增,所用引物序列如图1所示。上游引物中引入EcoRⅠ酶切位点,下游引物中引入SalⅠ酶切位点。基因及引物合成工作委托生工生物工程
(上海)股份有限公司完成。PCR产物经琼脂糖凝胶电泳后利用DNA纯化试剂盒回收目的片段。
1.2.2 重组质粒的构建 利用限制性内切酶Eco RⅠ和Sal Ⅰ对回收的PCR产物及pGEX-4T-1载体进行双酶切,回收酶切后的目的片段及载体。利用T4 DNA连接酶将酶切后获得的目的片段与载体进行连接,获得蜂毒前溶血肽原与GST融合表达重组质粒pGEX-4T-1/PPMel。重组质粒转化大肠杆菌TOP10感受态细胞,经含有50 μg/mL氨芐青霉素的平板培养过夜后,筛选阳性克隆进行酶切鉴定并由生工生物工程(上海)股份有限公司测序验证。
1.2.3 蛋白表达 重组质粒pGEX-4T-1/PPMel转化大肠杆菌BL21感受态细胞,42 ℃热激90 s后涂布到含有50 μg/mL氨苄青霉素的平板上,37 ℃培养过夜。挑取单克隆到含有50 μg/mL氨苄青霉素的液体培养基中振荡培养。当菌液D600 nm值达到0.6时,加入0.5 mmol/L的诱导剂(IPTG),分别置于20 ℃条件下培养过夜、37 ℃条件下培养6 h,以未添加诱导剂的菌液为阴性对照。
菌液经离心后弃上清,收集菌体。在收集到的菌体中加入缓冲液A悬浮,使用超声破碎仪使其充分溶解,离心,分别收集上清和沉淀。收集的沉淀使用缓冲液B进行溶解。分别对收集的上清和沉淀溶解液处理后制备样本,利用SDS-PAGE和Western Blot进行检测。
2 结果与分析
2.1 优化后的基因序列信息
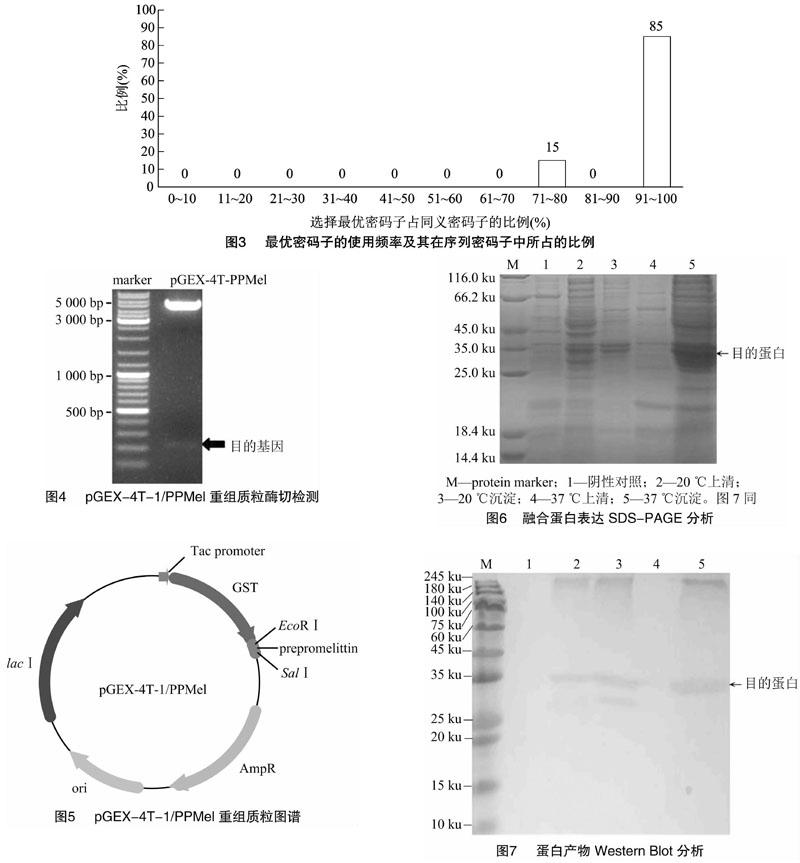
改造后的DNA序列长度为213 bp,在蜂毒肽对应的核酸序列前加入1个密码子AAC,使其表达Asn,从而形成Asn-Gly位点,用于通过羟胺裂解获得蜂毒肽[8]。根据生物信息学分析可知,蜂毒前溶血肽原基因的表达产物末端氨基酸残基为Gly,而蜂毒肽末端缺少Gly,故在改造后的序列中删除了其对应的密码子GGT(图2),保证了表达产物被酶切割后的蜂毒肽产物长度为26个氨基酸。改造后的序列中,大肠杆菌最优密码子使用频率多在90%以上(占85%)(图3),其GC含量为50.2%,且无异常GC峰。其序列中无一般顺式作用元件(Cis-acting elements)序列。
2.2 重组质粒的酶切检测
根据电泳结果可知,重组质粒的酶切产物主要是约5 000 bp和200 bp的2个片段(图4)。其中大片段为载体质粒,小片段为插入的基因片段。插入片段的测序结果与预定改造后的蜂毒前溶血肽原DNA序列一致(图2),且能与pGEX-4T-1载体中的GST基因序列形成正确的读码框。重组质粒图谱如图5所示。
2.3 蛋白表达检测
含有重组质粒pGEX-4T-1/PPMel的工程菌在20 ℃和37 ℃條件下进行IPTG诱导培养后,SDS-PAGE检测结果显示,2个温度条件下的产物在约35 ku处均有特异性蛋白条带出现,大小与预期融合蛋白大小符合(图6),由GST和蜂毒前溶血肽原构成。为进一步确定目的蛋白的表达情况,按照Western Blot步骤用TMB显色试剂盒显色。结果显示,在相应位置出现明显条带(图7),进一步表明目的蛋白已成功表达。但在37 ℃培养条件下,目的蛋白主要出现在沉淀中,表明表达产物主要为包涵体形式存在。而在20 ℃条件下,上清液和沉淀中均出现了表达产物,说明此温度下表达产物一部分以可溶性蛋白的形式存在,一部分以包涵体形式存在。
3 讨论与结论
利用人工化学合成技术获得全基因序列为基因的改造提供了方便。这种方法既可以缩短合成周期,又为序列的正确性提供了保障。同时,在进行原核表达时,可以有效地根据原核生物密码子偏好性及其他需要对目的片段的基因序列进行优化及定点突变,密码子的优化将有利于目的基因在宿主细胞内高效精确地表达。蜂毒前溶血肽原基因CDS序列全长仅213 bp,可以按一定原则对其进行充分改造,再利用上述方法将其合成,使之满足在不同细胞内表达的需要。对基因序列进行改造过程中考虑到应用羟胺裂解方法对GST-蜂毒前溶血肽原融合蛋白进行处理以获得蜂毒肽,所以在原序列上添加了相应氨基酸对应的密码子(AAC),使表达产物中蜂毒肽结构域前形成羟胺裂解位点(Asn-Gly)。若考虑通过其他酶或化学物质从表达产物上将蜂毒肽切割下来,可以设计其他相应密码子,如利用肠激酶作用位点时[9],可在蜂毒前溶血肽原基因中蜂毒肽对应的序列首密码子前添加GAC GAC GAC GAC AAG序列。已知多种酶或化学试剂在蜂毒前溶血肽原上没有切割位点或在蜂毒肽结构域没有切割位点,可以按照此思路在蜂毒肽前溶血肽原基因中相应位置添加对应的密码子序列[8]。
利用基因工程技术生产蜂毒肽被看作是获得蜂毒肽的新途径,研究者关注蜂毒肽对细胞的毒性,探索利用融合蛋白等方式实现蜂毒肽在原核细胞、真核细胞中的表达。考虑到蜂毒肽在蜜蜂体内以其前体蛋白蜂毒前溶血肽原的形式表达,笔者设计了蜂毒前溶血蛋白原的全基因序列,期望以此降低其对细胞的破坏作用。为了便于从表达产物中分离目的蛋白,选择了利用GST融合蛋白的形式进行表达。构建的蜂毒前溶血肽原与GST融合表达重组质粒pGEX-4T-1/PPMel能够在不同温度下进行表达,其在20 ℃条件下表达的目的蛋白一部分以可溶性蛋白的形式存在,为进一步分离纯化表达产物并进行切割以获得有活性的目的蛋白提供的方便。但由于GST标签自身相对分子质量较大,而设计的目的蛋白又非常小,对相关下游试验可能会有较大影响。考虑到设计的目的蛋白蜂毒前溶血肽原具有较大的溶解度,对细胞膜的破坏能力较低,也可以尝试使用分子量较小的His标签。蜂毒前溶血肽原本身具有信号肽结构,若有好的无标签分离纯化目的蛋白的方法,也可以尝试直接表达蜂毒前溶血肽原。而有关其表达量的提高及表达产物的处理等仍需进一步研究。
参考文献:
[1]Raghuraman H,Chattopadhyay A. Melittin:a membrane-active peptide with diverse functions[J]. Bioscience Reports,2007,27(4/5):189-223.
[2]Cao L,Dai C,Li Z,et al. Antibacterial activity and mechanism of a scorpion venom peptide derivative in vitro and in vivo[J]. PLoS One,2012,7(7):e40135.
[3]Memariani H,Memariani M,Shahidi-Dadras M,et al. Melittin:from honeybees to superbugs[J]. Applied Microbiology Biotechnology,2019,103(8):3265-3276.
[4]Park J H,Kim K H,Lee W R,et al. Protective effect of melittin on inflammation and apoptosis in acute liver failure[J]. Apoptosis,2012,17(1):61-69.
[5]Rady I,Siddiqui I A,Rady M,et al. Melittin,a major peptide component of bee venom,and its conjugates in cancer therapy[J]. Cancer Letters,2017,402:16-31.
[6]Oroli c′ N. Bee venom in cancer therapy[J]. Cancer Metastasis Rev,2012,31(1/2):173-194.
[7]Lee J E,Shah V K,Lee E J,et al. Melittin-a bee venom component-enhances muscle regeneration factors expression in a mouse model of skeletal muscle contusion[J]. Journal Pharmacological Science,2019,140(1):26-32.
[8]王关林,李大力,方宏筠. 蜂毒溶血肽基因的定点诱变及其在大肠杆菌中的表达[J]. 遗传学报,2000,27(2):176-182.
[9]朱文赫,田立玲,孙妙囡,等. 蜂毒肽基因在大肠杆菌中的表达、纯化及初步鉴定[J]. 中国生化药物杂志,2010,31(1):1-5.
[10]施婉君,张素方,张传溪,等. 4种胡蜂前溶血肽原基因的克隆与序列比较[J]. 遗传学报,2003,30(6):555-559.
[11]郭新军. 蜂毒前溶血肽原及其加工产物生物信息学比较分析[J]. 陕西农业科学,2018,64(9):51-54.
[12]王关林,李大力,方宏筠. 蜂毒溶血肽前体蛋白cDNA的克隆及其融合蛋白的表达[J]. 微生物学报,2001,41(2):181-185.
[13]宋 辉,王鹏飞,马登超,等. 蒺藜苜蓿WRKY转录因子密码子使用偏好性分析[J]. 农业生物技术学报,2015,23(2):203-212.