替加环素/壳聚糖纳米粒对碱烧伤角膜新生血管的作用△
2020-09-24马高阳蔡岩李文静吴华蓉王慧娴高晓唯
马高阳 蔡岩 李文静 吴华蓉 王慧娴 高晓唯
正常角膜无血管,是由于血管生成因子和抗血管生成因子之间保持相对平衡。当角膜遭受创伤、炎症、缺氧及角膜缘干细胞缺乏等情况时[1],会打破两类因子之间的平衡,导致角膜新生血管(corneal neovascularization,CNV)的形成[2]。角膜疾病是世界第三大致盲原因,而发展中国家角膜化学烧伤的发生依然常见,CNV是致盲的主要因素之一,据统计,每年有140万人产生CNV,其中12%视力丧失[3-4]。目前临床治疗CNV的方法包括局部应用激素、非甾体类抗炎药、光动力疗法、激光光凝术、细针透热法以及结膜、角膜缘干细胞和羊膜移植。然而,所有这些方法的疗效均有限且会引起许多不良反应,尤其是使用类固醇激素后会引起眼压升高及后囊下白内障[5]。所以,抗CNV的新方法亟待研发。
纳米粒具有较大的表面积使物质能够高效、快速并持续渗透“生物膜”。壳聚糖(chitosan,CS)是甲壳素脱N-乙酰基而产生的一种多糖,不仅无过敏性和毒性,而且还具有抗菌活性、生物相容性和生物黏附性等。因此,CS在多个行业中具有潜在的应用价值[6]。本研究旨在制备和评估负载替加环素(tigecycline,TGC)CS纳米粒的特征、细胞毒性及其抗碱烧伤CNV的作用,并探究其抗新生血管的机制。
1.1 材料
1.1.1 实验动物新西兰大白兔46只,体质量(2.5±0.5)kg,购自新疆医科大学实验动物中心,实验前裂隙灯及眼底镜检查排除眼部疾病。
1.1.2 主要仪器及试剂CS(索莱宝 c8320);TGC(源叶S24031);LC-20AT型高效液相色谱仪(日本岛津);JEM-1230透射电子显微镜(日本JEOL);YB-6D 型生物组织石蜡包埋机(湖北孝感亚光电子技术公司);LEICA RM213型组织切片机(德国);GelDot-It2系列荧光及化学发光成像系统(美国UVP)。
1.2 方法
1.2.1 TGC/CS纳米粒的制备将CS粉末溶于体积分数1%冰醋酸制得1.5 g·L-1的CS溶液后用1 mol·L-1的NaOH调节pH值为5.0,恒温磁力搅拌状况下逐滴加入1.0 g·L-1的三聚磷酸钠(Tripolyphosphate,TPP),使CS与TPP的质量比分别为51、41、31、52、21,室温下10 000 r·min-1搅拌40 min,静置并观察混悬液状态,最终选定质量比为41,即可得到空白CS纳米粒。将不同质量TGC粉末加入上述1.5 g·L-1的CS溶液,TGC初始浓度分别为0.5 g·L-1、1.0 g·L-1、1.5 g·L-1、2.0 g·L-1、2.5 g·L-1,其余步骤相同,可制得不同初始浓度的TGC/CS纳米粒。使用冷冻干燥机将所有纳米粒制成冻干粉保存。
1.2.2 TGC/CS纳米粒包封率、载药量的测算精密称取一定量的冻干粉复溶后于4 ℃、12 000 r·min-1条件下离心分离30 min,取其上清液通过高效液相色谱(HPLC)法测量其浓度,并计算其包封率及载药量。进行3次实验取平均值。包封率=包封TGC的量(mg)/体系中TGC的总量(mg)×100%;载药量=包封TGC的量(mg)/(TGC/CS)纳米粒总质量(mg)×100%
1.2.3 TGC/CS纳米粒体外释药的测算将冻干粉复溶于1 mL PBS的离心管中,37 ℃水浴条件下持续振荡,每隔6 h在4 ℃、12 000 r·min-1条件下离心分离30 min,收集并更换上清液,HPLC法测定其中TGC含量。进行3次实验取平均值。
1.2.4 色谱条件色谱柱Agilent ZORBAX Eclipse XDB-C18(250.0 mm×4.6 mm),流动相0.1 mol·L-1磷酸氢二铵-三乙胺-甲醇(67132,pH 6.3),柱温30 ℃,流速1 mol·mL-1,检测波长为245 nm 。
1.2.5 TGC/CS纳米粒表征、粒径的检测将冻干粉用去离子水复溶后,滴于喷碳铜网(200孔)上,白炽灯下烤干后于透射电镜下观察纳米粒的形状、分布并测量其粒子直径。
1.2.6 TGC/CS纳米粒眼表毒性检测随机选取6只新西兰大白兔,右眼为实验眼,左眼为对照眼。将纳米粒混悬液50 μL滴于右眼结膜囊,等量生理盐水滴于左眼结膜囊。1 h、6 h、24 h后用裂隙灯观测角膜、虹膜、结膜及巩膜等情况,根据Draize兔眼刺激实验评分,即在一侧结膜囊滴入受试物后在规定的时间间隔观察兔眼的刺激及腐蚀程度,并根据量表对角膜、虹膜及结膜进行量化评分,将所有动物的刺激反应评分相加后除以动物数,即为最终分值。于24 h后戊巴比妥钠麻醉下空气栓塞处死,取两眼的角膜及结膜行HE染色观察其形态及炎症细胞的表达等。
1.2.7 建立碱烧伤模型、分组用药、裂隙灯观察并定量计算CNV面积取40只新西兰大白兔随机分为TGC/CS纳米粒组(A组)、TGC组(B组)、空白CS纳米粒组(C组)和生理盐水对照组(D组),每组均为10只。兔右眼建立碱烧伤模型,于实验兔耳缘静脉注入戊巴比妥钠并于眼表滴加盐酸奥布卡因充分麻醉,将浸泡于1 mol·L-1的NaOH溶液中且直径为6 mm圆形滤纸片置于兔右眼角膜30 s后,用足量生理盐水冲洗角膜及结膜囊5 min,左眼不作任何处理。然后A、B、C、D组分别使用TGC/CS纳米粒、TGC、CS纳米粒、生理盐水滴右眼,每日2次,共进行28 d。使用裂隙灯直接观察角膜情况,于7 d、14 d、28 d测量各组CNV长度。CNV面积的计算公式:CNV 面积(mm2)=C/12×π×[R2-(R-L)2],其中C为CNV累及的角膜的圆周钟点数,π为圆周率取3.14,L为CNV从角膜缘深入角膜的长度,兔眼的角膜半径R=7 mm。
1.2.8 组织病理切片HE染色分别于7 d、14 d及28 d时使用戊巴比妥钠麻醉,空气栓塞处死各组实验兔,对取得的角膜组织进行福尔马林溶液固定、石蜡包埋和切片等常规组织学方法处理。再对切片进行苏木精和伊红染色后封片,光镜观察角膜结构、新生血管和细胞浸润情况等。
1.2.9 Western blot检测NF-κB、VEGF、MMP-9蛋白的表达称取约0.1 mg角膜组织,液氮研磨后加入1000 μL裂解液冰上裂解2 h,检测各组蛋白含量并配平。低温高速离心后取上清液等比例加入上样缓冲液,95 ℃水浴5 min,取上清液上样,凝胶电泳,然后转印到PVDF膜上。用TBST缓冲液配置50 g·L-1牛血清蛋白(BSA)稀释抗体原液,4 ℃隔夜孵育一抗,次日室温下2 h孵育二抗。将电化学发光液(ECL)中的A液和B液等比例混合均匀滴注于膜上,分析目的条带灰度值。
1.3 统计学分析本实验数据使用SPSS 21.0 统计学软件进行统计分析,计量资料采用均数±标准差表示,组间比较使用单因素方差分析(ANOVA)。检验水准:α=0.05。
2 结果
2.1 TGC/CS纳米粒表征分析不同初始TGC浓度所得包封率及载药量的结果显示,2 g·L-1时TGC/CS纳米粒包封率(67.17±0.29)%与载药量(59.67±0.29)%最高,因此,选择该浓度作为TGC的初始浓度制备TGC/CS纳米粒。透射电镜结果显示,2 g·L-1的TGC/CS纳米粒外观为光滑球形结构,纳米粒间未见粘连,粒径大小分布均匀,粒径为(235.84±34.59)nm(见图1)。
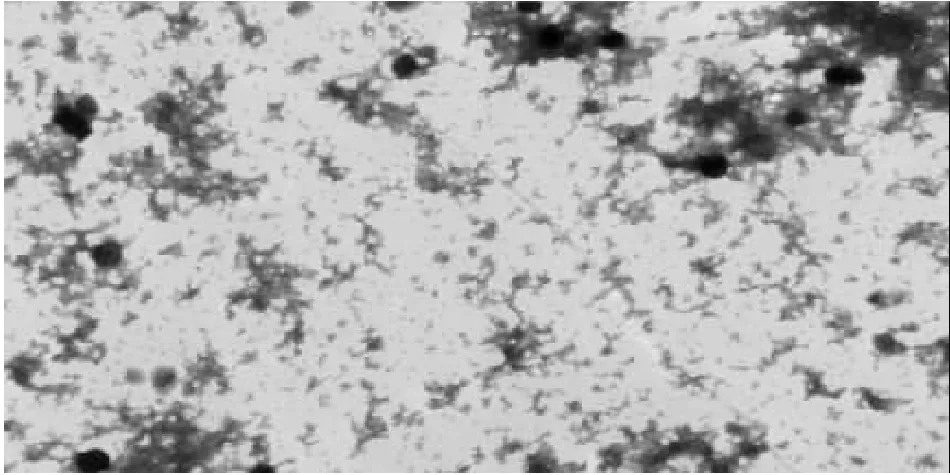
图1 透射电镜下TGC/CS纳米粒形态
2.2 TGC/CS纳米粒体外释药TGC/CS纳米粒在体外存在明显的突释现象,18 h释放量约占总量的70%,18~48 h为缓释状态,48 h后药物几乎完全释放(见图2)。
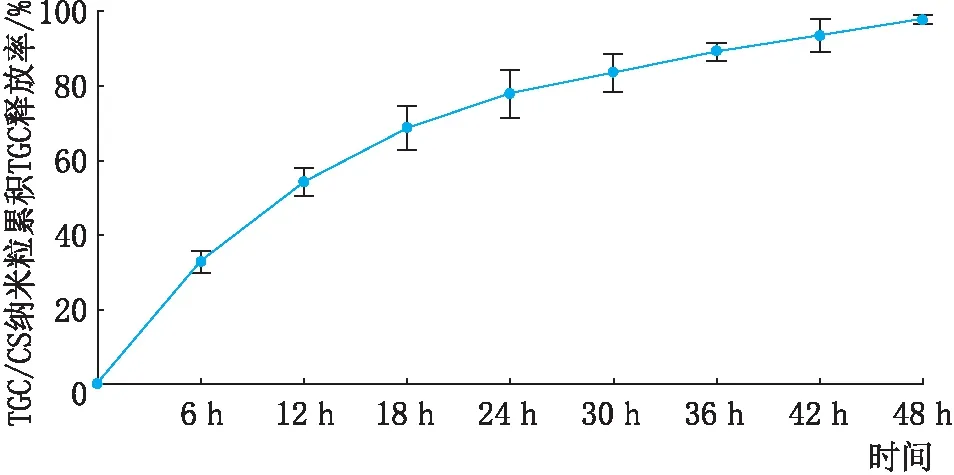
图2 TGC/CS纳米粒累积释放TGC曲线
2.3 眼表毒性检测裂隙灯显微镜观察结果显示,各时间点观察均未见角膜混浊、虹膜异常、结膜充血水肿、巩膜异常及分泌物增多等情况,Draize评分为0。HE染色结果显示,实验眼较对照眼的角膜、结膜未见明显改变,角膜、结膜上皮细胞完整且紧密连接,各层结构清晰,未见水肿及炎细胞浸润(见图3)。

图3 HE染色下兔实验眼与对照眼角膜与结膜组织病理学观察(×400)
2.4 角膜大体观察及CNV面积测量裂隙灯显微镜结果显示,碱烧伤后前3 d,烧伤区呈灰白色,边界清晰、角膜水肿、睫状充血。碱烧伤后4 d,角膜周边始见新生血管出现,此时CNV分布稀疏、管径细小,各组无明显差异。碱烧伤后7 d,CNV生长迅速,C、D组CNV分布范围广,管径较粗且顶部出现分叉,A、B组管径较小,顶部分叉较少,且角膜上皮损伤处基本愈合。碱烧伤后14 d,D组CNV形成较为致密的网状结构,分布面积进一步增大,长度已趋于角膜中央,C组管径及分布面积小于D组,B组 CNV明显小于C、D两组,尤其A组的CNV稀疏细小。碱烧伤后28 d,各组CNV管径变细、面积减小,但C、D组依然大于B组,而A组部分已萎缩消退(见图4)。角膜碱烧伤后7 d、14 d及28 d,C组CNV面积均小于D组,但差异均无统计学意义(均为P>0.05),其余各组CNV面积的差异均有统计学意义(均为P<0.05)(见表1)。
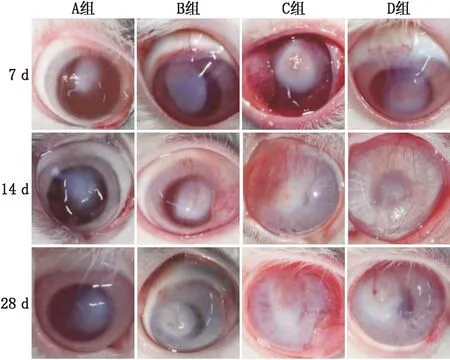
图4 各组角膜碱烧伤后7 d、14 d和28 d照片
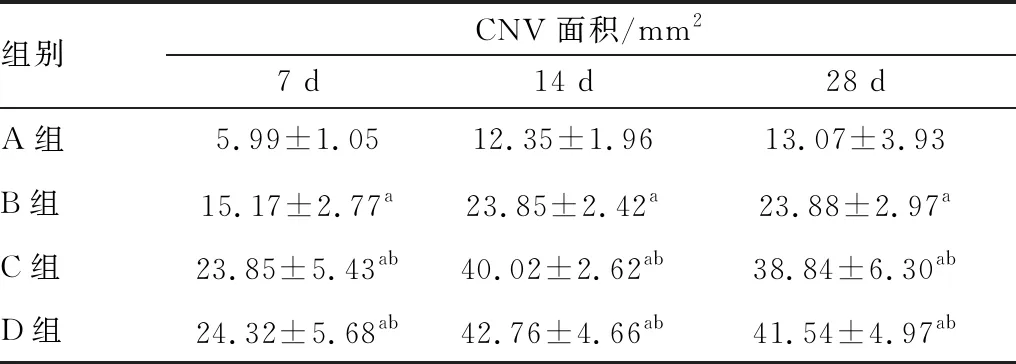
表1 各组不同时间点CNV面积
2.5 组织学检测病理切片HE染色结果显示,碱烧伤后7 d各组角膜上皮仍有不同程度缺损,基质层水肿,胶原纤维排列疏松且紊乱,炎症细胞浸润,少量新生血管生成,其中C、D两组炎症较B组严重,B组较A组严重。碱烧伤后14 d角膜上皮愈合,基质浅层溃疡形成,各层排列基本恢复正常,C、D两组见大量新生血管生成,管径较粗,管腔内见红细胞,B组炎细胞、新生血管数量及管径均较小,A组最小。碱烧伤后28 d各组角膜上皮完整,基质胶原纤维整齐排列,仅见少量炎症细胞浸润,新生血管分布减少,管径缩小,仍然是C、D两组炎症程度最重,B组居中,A组角膜结构接近正常(见图5)。
2.6 Western blot检测各组NF-κB、MMP-9、VEGF蛋白相对表达量A、B、C、D组NF-κB蛋白的相对表达量分别为0.36±0.01、0.55±0.03、0.77±0.02、0.97±0.03,MMP-9蛋白的相对表达量依次为0.29±0.02、0.40±0.02、0.53±0.02、0.68±0.01,A、B、C、D组NF-κB与MMP-9蛋白的相对表达量均依次递增,差异均有统计学有意义(均为P<0.05)。A、B、C、D组VEGF蛋白的相对表达量依次为0.38±0.02、0.45±0.01、0.76±0.02、0.77±0.02,C、D两组间差异无统计学意义(P<0.05),其余各组两两相比差异均有统计学意义(均为P<0.05)(见图6)。

图5 各组病理切片HE染色结果(×400)

图6 Western blot检测各组NF-κB、MMP-9、VEGF蛋白相对表达量与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05
3 讨论
碱烧伤的早期即可因为角膜组织的坏死及炎症反应导致角膜发生损伤,损伤的角膜组织在修复过程中,由于瘢痕化和CNV,致使角膜组织的透明度下降,视力受损[7]。迄今为止,尚未见到国内外有文献报道关于CNV的特异性治疗方式[8]。CNV是一个含有多种炎症细胞和细胞因子参与的病理修复过程,如 VEGF、MMPs、炎性细胞因子等均与之相关,因此,寻找抑制血管生成和炎症的药物是治疗CNV的重要策略之一[9]。
四环素是第二代长效非选择性抗生素,外用可抑制角膜溶解,治疗感染性角膜疾病[10],此外,四环素及其衍生制品被证明可加速角膜伤口愈合,抑制CNV形成[11]。TGC是四环素家族中较新较强效的一种制剂,Goktas等[12]首次探讨了TGC抑制CNV的疗效,发现局部应用TGC后,CNV明显减少。CS是甲壳素N-脱乙酰基而产生的一种多糖[13],壳聚糖及其衍生物具有良好的生物相容性、可溶性和可增强分子在上皮层间的渗透性等优势[14]。纳米粒可以提高药物对角膜的穿透性、可使药物在眼表的停留时间延长、延缓药物降解和代谢以增强药物的稳定性,且纳米粒的毒性和副作用低,保质期长,是适用于眼科局部给药的新剂型[15-16]。本研究使用CS纳米粒负载TGC,在发挥其载体优势的基础上,尚有如抑菌、止血、抗纤维化、辅助免疫、抗肿瘤和促进伤口愈合等CS自身优势[17]。已有研究探讨了CS纳米粒在角膜碱烧伤方面的应用,Roy等[18]合成了以α-平滑肌肌动蛋白抗体为靶点的负载曲古抑菌素A和显性负性Survivin蛋白超小壳聚糖纳米粒用于碱烧伤的治疗。CS纳米粒及其衍生物还广泛应用于其他眼科疾病,如青光眼[19]、眼部感染及炎症[20]、眼底疾病[21]等。
VEGF是影响内皮细胞生长、存活、通透性、迁移和血管重塑的最重要的促血管生成因子。该因子在组织缺氧状态下表达,并附着在内皮细胞表面的受体上,诱导上述活动的发生。VEGF可由内皮细胞、巨噬细胞、T细胞和星形胶质细胞分泌[22]。VEGF-A被认为是这个家族中最重要的成员,特别是与病理血管生成有关[5]。VEGF-A是由角膜上皮细胞、血管内皮细胞和浸润性白细胞分泌的,是炎症和血管生成的主要介质,它破坏血管壁并刺激新血管的生长,在新生血管形成的早期表达上调[23-24]。
正常情况下,MMPs、基质金属蛋白酶组织抑制剂和整合素三者处于相对平衡的状态。病理性新生血管生成始于这种平衡的破坏,细胞外基质的降解被认为是发展新血管的重要组成部分[25]。MMPs是一类重要的金属蛋白酶,其中MMP-9也被称为明胶B,在组织重组和血管生成过程中起关键作用[23]。四环素及其衍生物可通过抑制MMP-9来增加色素上皮源性生长因子的表达,从而使得VEGF的表达下调,可减少新生血管的形成降低角膜通透性;亦可改善减少睑板腺功能,从而恢复泪膜和角膜的光学质量[26]。
NF-κB参与了基因转录,有文献报道其参与免疫调节、炎症反应以及细胞凋亡等多种反应[27]。NF-κB在转录水平控制着包括VEGF在内的多种促血管生成的因子,可在上游作为靶点控制VEGF的表达[28]。同时VEGF可以反向上调NF-κB的表达从而形成闭合环路,正反馈增加新生血管的生成[29]。研究报道,MMP-9是NF-κB的基因靶点之一,NF-κB的过度激活会引起MMP-9的表达增加[30]。本研究已证实TGC可有效抑制NF-κB的表达。
CNV生成的病理过程分为两个方面,一是血管生成生长因子依赖的血管内皮细胞增殖,另一方面是细胞外基质成分的重构和细胞因子的激活[31],本实验中,TGC/CS纳米粒被证实可通过抑制NF-κB、VEGF和MMP-9的表达同时抑制上述两个方面的病理过程,且TGC/CS纳米粒组较游离TGC组抗新生血管能力明显增强,证实TGC/CS纳米粒是防治碱烧伤CNV的潜在用药。
