很可能的皮质基底节变性1例报告
2020-09-24殷康福周传彬朱永云尹蔚芳杨兴隆
殷康福,周传彬,朱永云,尹蔚芳,杨兴隆,徐 忠
皮质基底节变性(corticobasal degeneration,CBD)是一种罕见的神经退行性疾病,其病理学特征主要表现为在各种细胞类型和解剖区域中病理性tau蛋白的沉积,萎缩性大脑皮质和皮质下区域(包括黑质、纹状体)的神经元丢失、气球样变及神经胶质变性。CBD可有多种临床表型,皮质基底节综合征(corticobasal syndrome,CBS)是与CBD病理学相关的最常见临床表型,还可表现为额叶行为空间综合征(frontal behavioral-spatial syndrome,FBS)、非流利型或语法缺失型原发性进行性失语(nonfluent/agrammatic variant of primary progressive aphasia,naPPA)、进行性核上性麻痹综合征(progressive supranuclear palsy syndrome,PSPS)等相应的临床表现[1]。CBD临床罕见,临床表现复杂多变,易与其他帕金森综合征重叠,并且病理诊断获取困难,导致此病诊断率低。因此,我们报道1例我院诊治的符合临床诊断标准的CBD患者,复习国外近年来相关文献,结合典型临床表现和18F-FDG PET影像学检查,以提高对CBD临床及影像学表现的认识。
1 临床资料
患者,女性,69岁,右利手,以“语速缓慢4 y、肢体抖动2 y、行动迟缓1 y”为主诉于2018年1月15日就诊我科。患者4 y前无明显诱因出现语速减慢,表现为说长句时突发不自主停顿,停顿数秒后又能继续说话,发声无异常,语调无异常,未及时就诊。2 y前无明显诱因逐渐出现右上肢肢体僵硬,活动不灵活,伴有右上肢不自主震颤,紧张时明显,当地医院就诊诊断为“帕金森病”,予口服“多巴丝肼、普拉克索、雷沙吉兰、吡贝地尔”等治疗(具体剂量不详)后症状未见好转,并呈缓慢进行性加重。1 y前患者出现步态缓慢,走路呈小碎步,无前倾前冲步态,说话不能成句,呈单字发音,旁人能听懂,面部表情减少,瞬目减少,规律服用“多巴丝肼,每天3次,每次四分之一片”,不规律服用“金刚烷胺、普拉克索、雷沙吉兰、吡贝地尔”,近一年来“语速变慢、书写字体变小、肢体僵硬、肢体细颤、步态缓慢”等症状均未见好转,随至我院进行诊治。既往史:3 y前诊断“脑梗死”;颈椎退行性病变数年;右侧输卵管切除术史;阑尾切除术史。否认高血压、糖尿病、心脏病病史及饮酒史,否认药物、食物过敏史及阳性家族史。神经系统查体:意识清楚,发音困难,只能发单词。双侧瞳孔等大正圆,D≈3.0mm,光反应灵敏,双眼运动正常,无眼震;面部表情减少,双侧额纹及鼻唇沟对称,伸舌居中。右上肢观念运动性失用(令患者拿起手机时无法完成,但手机响铃时可自然拿起;令患者右手抓左耳无法完成),异己肢体征象(不受控制握拳、抬高),右上肢屈肌肌张力痉挛强直样增高,右手手指肌张力持续性增高,呈握拳样,不能自行活动右上肢,左上肢肌张力正常,右下肢肌张力增高,左下肢正常。右上肢肌力检查不配合,余肢体近端及远端肌力5级。右侧肢体指鼻试验及跟膝胫试验不能配合,闭目难立征不配合。右侧肢体两点间辨别觉及图形觉减退。右上肢静止、姿势和动作混合性震颤。启动困难,无前倾前冲,转身缓慢,行走缓慢,步距小。病理反射:右侧Babinski征(+)。实验室检查:血常规、肝肾功能、电解质、凝血功能、糖化血红蛋白、尿便常规、甲状腺及免疫功能、血清铜、铜蓝蛋白、脑钠肽(brain natriuretic peptide,BNP)、心梗标志物、肿瘤标志物、传染病指标均正常。简易智能精神状态检查量表(mini-mental state examination,MMSE)评分29分(文化程度:本科)。头部磁共振成像(magnetic resonance imaging,MRI)平扫:双侧额顶叶及双侧侧脑室旁多发小片状异常信号,多考虑脱髓鞘改变,左侧额叶及颞叶较对侧稍萎缩(见图1)。头部磁共振血管成像(magnetic resonance angiography,MRA)回示未见异常。头部磁共振脑功能成像回示:左侧颞叶小片状异常信号,考虑小出血灶。考虑诊断CBD,为进一步明确诊断,完善头部 18F-FDG PET 检查示:(1)双侧尾状核、壳核及左侧丘脑糖代谢较减低;(2)左侧额叶、顶叶、双侧颞叶糖代谢降低;(3)老年性脑改变(见图2)。患者入院后予抗血小板聚集、降脂、改善脑代谢、控制运动症状等治疗,症状改善不明显出院。出院诊断:很可能的CBD。出院后随访1 y,于2019年1月14日再次就诊,全身僵硬,运动迟缓明显加重,生活完全不能自理。神经系统查体:嗜睡,发音困难,只能简单哼声,高级皮质功能检查不能配合。颈部、四肢、躯体肌张力增高,双上肢屈肌肌张力痉挛强直样增高,呈握拳样,双下肢伸肌肌张力增高。双上肢腱反射(),右侧Babinski征阳性,余查体不能配合。
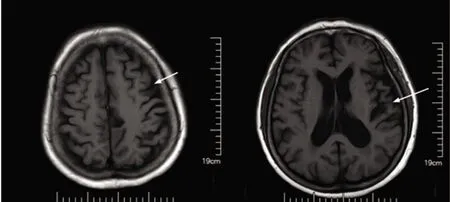
图1 患者头部MRI影像

图2 患者头部18F-FDG PET影像
2 讨 论
CBD是一种罕见疾病,多年以来缺乏统一的诊断标准,缺乏关于该病的可靠的流行病学数据。据推算,其发病率约为每年0.62~0.92/10万,占帕金森综合征的比例约为4%~6%,患病率约为4.9~7.3/10万[2]。其平均发病年龄为63.5岁,范围为45~77岁,男女无差异,预后不良,平均病程为6.6 y,范围为2~12.5 y,但通常CBD患者不会在疾病的第一年死亡,否则应考虑其他引起快速进行性痴呆的原因。疾病晚期,肺炎引起的败血症和呼吸衰竭是CBD患者最常见的死亡原因[1]。由于临床工作中病理活检较难实现,故而目前将病理学组织检查确证的诊断称为CBD,而未经过病理学活检印证仅临床诊断的称为皮质基底节综合征(CBS)[3],因此熟悉本病临床表型及相关辅助检查尤为重要。
CBD的临床表现以运动症状与高级皮质病变相关症状的不同组合为特点。运动症状主要表现为非对称的耐左旋多巴的帕金森综合征,肌张力障碍和肌阵挛[2]。肌强直(85%)和运动迟缓(76%)是最常见的运动表现[4],大多数患者对左旋多巴无反应,在极少数患者中,左旋多巴治疗后可出现轻中度缓解,但持续短暂,在先前的诊断方案中,持续性对左旋多巴敏感通常为CBD排除诊断的条件[5]。40%的CBD患者存在肌张力障碍,大约80%的患者患有上肢肌张力障碍,肌张力障碍通常最初会影响到一只手臂,躯干和腿部肌张力障碍很少见。肌张力障碍一般出现在该病程的前2 y内,并且与肌阵挛高度相关[2]。临床上55%~93%的CBS患者出现肌阵挛,通常是局灶性的,最常见的是影响上肢,也可出现于面部[6],可以是自发的,但更多是刺激或作用诱导的[1],可能是由于原发性运动皮质的异常过度兴奋引起的[2]。CBD的其他运动症状包括姿势不稳和跌倒、步态异常、震颤等。据报道,有39%的CBD病例有震颤,通常是静止、姿势和动作震颤的混合,与PD患者表现的4~6 Hz的静止性震颤不同,常发展至肌阵挛,有时肌阵挛性抽搐被错误地视为震颤[4]。本例患者单侧肢体笨拙、运动缓慢,左旋多巴治疗无效,右上肢混合性震颤及肌阵挛,与上述文献报道一致。
高级皮质病变主要表现为失用症、肢体异己征、皮质感觉缺失、认识障碍、行为改变以及失语等。失用症是CBD的核心症状之一,约57%的CBD患者有肢体失用,观念运动性失用为最常见的类型,也可表现为部分肢体运动性失用、口部失用、睁眼失用等[7]。在该疾病的后期,由于肌张力障碍、运动迟缓和僵硬的存在,可能难以评估诊断失用症[1]。肢体异己征表现为复杂无意识的肢体运动,或感觉肢体不是自己的一部分且有其自己的意志,也可仅仅表现为简单的肢体不受控制的抬高[2]。CBD患者可表现为行为障碍,起初会出现冷漠、反社会行为、性格改变、易怒、过度消费和性欲亢进,但随着疾病的发展,抑郁、冷漠和性快感丧失更为常见[1]。此外,还可表现为学习困难、言语不流利、理解困难、视空间等方面的认知障碍以及位置觉、两点辨别觉、实体感觉方面的皮质感觉障碍[8]。本例患者右上肢观念运动性失用,异己肢体征象,发音困难,言语不流利,右侧肢体两点间辨别觉及图形觉减退,与上述文献报道一致。根据2013年Armstrong等人提出的CBD新的诊断标准,依据患者的起病特点、起病年龄、症状持续时间及有无相关家族史、相关tau蛋白基因突变,分为可能的CBD及很可能的CBD[4]。本例患者发病年龄>50岁,隐匿起病,缓慢进展,症状持续5 y,否认遗传史和类似疾病家族史;临床表现为非对称的耐左旋多巴的肢体强直和运动迟缓、肌阵挛、观念运动性失用、皮质感觉缺失(图形觉与两点间辨别觉)、肢体异己征,符合很可能的CBD诊断。
CBD的重要病理特征为tau蛋白的沉积,然而在tau蛋白病谱系中,各种疾病临床表型重叠,甚至病理学检查也很难鉴别[1],故CBD患者需与进行性核上性麻痹(progressive supranuclear palsy,PSP)、阿尔茨海默病(Alzheimer disease,AD)、多系统萎缩(multiple system atrophy,MSA)等疾病鉴别。而18F-FDG PET脑代谢显像是影像学鉴别上述几种疾病的有效手段之一。CBD患者在18F-FDG PET检查中可表现为不对称大脑皮质摄取代谢减低,受累肢体对侧大脑皮质以额顶叶及基底节最为显著[2],正如在本例患者表现为右上肢失用症、肢体异己征,而PET显像提示左侧额叶局部的糖代谢降低;在PSP患者中18F-FDG PET脑代谢显像出现中脑、基底神经节、丘脑、额叶、颞叶代谢对称性降低[9];多系统萎缩患者18F-FDG PET脑代谢显像则多为小脑和基底节对称性代谢降低[10];AD患者18F-FDG PET脑代谢显像主要表现为顶叶、颞叶以及后扣带的不对称低代谢,结构MRI检查显示的颞叶、海马萎缩及脑脊液Aβ42降低有助于和CBD相鉴别[2]。普通头部MRI检查在疾病早期难以及早分辨不同的退行性病变,但18F-FDG PET脑代谢显像在疾病的早期可一定程度的进行区分,临床实用价值显著。本例患者普通头部MRI检查显示左侧额叶及颞叶较对侧稍萎缩,18F-FDG PET 脑代谢显像双侧基底节区、左侧丘脑、额顶叶及双侧颞叶糖代谢降低,与既往文献报道一致。
综上所述,CBD临床表现复杂,可有多种表型,临床上存在对该病认识不足和诊断困难,虽然2013年Armstrong 等人提出CBD新的诊断标准[4],但因CBD的临床表型及病理重叠,需要进一步研究以提高CBD的诊断准确性,尤其是在疾病早期阶段的病例识别中。18F-FDG PET显像具有无创的特点,因此在CBD的诊断以及鉴别诊断方面有着独特的优势,可以在有条件的医院进行推广。目前脑脊液生物标志物及功能成像已进入实用阶段,帮助识别及诊断CBD[2],未来期待深入对CBD生物标记物及功能成像的进一步研究。
