养殖水体Biolog Eco板培养时间对微生物多样性分析结果的影响
2020-09-24张峰峰孙海波赵玉洁谢凤行
赵 琼,张峰峰,周 可,孙海波,赵玉洁,谢凤行
(天津市农业生物技术研究中心,天津300384)
微生物具有丰富的物种和遗传多样性,在众多的微生物多样性的研究方法中,Biolog Eco法是以研究微生物群落水平生理特征(community level physiological profiling,CLPP)为主的一种方法,由美国BIOLOG公司于1989年建立[1].Biolog Eco方法的原理是微生物在利用碳源过程中产生的自由电子与四唑染料发生还原显色反应,颜色深浅可以反映微生物群落对碳源的利用程度.由于微生物对不同碳源的利用能力很大程度上取决于微生物的种类和固有性质,因而Biolog Eco板培养后测定各孔的颜色变化即可表征样品微生物群落的代谢功能多样性与活性[2].Biolog Eco方法数据量十分丰富,每一孔的吸光度均可作为样品的1个变量进行分析,且具有方便、快捷等优点,在表征细菌群落动态变化的时空尺度上具有显著优势[3-4],因此被广泛应用于土壤、水体等环境领域[5-8].由于Biolog Eco方法能提供微生物群落碳代谢潜力的相关信息,因此还可以和高通量测序方法相结合,进行微生物群落结构和代谢功能的相关研究[9-11].
Biolog Eco方法最初是被应用于土壤微生物群落的研究,近年来在海洋、湖泊、河口领域的应用逐年增多[12].Biolog Eco方法的难点在于数据分析,目前进行数据分析的方式主要有3种:①选用特定的培养时间点去分析Biolog Eco的数据[13];②采用曲线拟合的方法,兼顾Biolog Eco反应前后的变化[14];③为规避接种密度对分析结果的影响采用固定颜色平均变化率(average well color development,AWCD)时的吸光度值进行分析[15].由于选择特定培养时间点的方法更简单易行,目前被国内外学者普遍采用[13].根据不同环境下样品微生物群落菌体密度和活性的不同,常用于数据分析的培养时间有72[16]、96[17]、120[18]、168[19]和240 h[20].贾夏等[19]研究土壤样品Biolog Eco板培养时间对分析结果的影响,认为应尽量选择240 h进行连续读数全记录,再根据AWCD曲线“拐点”处或之后的时间进行分析.
养殖水体的异养菌菌体浓度比土壤环境低很多,一般在103~105cfu/mL之间[21-22].Biolog Eco方法在养殖水体中的应用研究也有少量报道,如Kurten等[23]认为,利用处于指数增长期的72 h或96 h进行结果分析较为合适,因为随着时间的延长群落底物利用特征(community substrate utilization profile,CSUP)的差异程度降低,AWCD曲线进入稳定期后提供的新信息有限.目前缺乏对养殖水体微生物群落代谢功能随时间变化的相关研究.因此,本研究以鲢鱼单养池塘和对虾精养池塘水样为研究对象,考察水样微生物群落的AWCD值、6类碳源利用情况、多样性指数和主成分分析达到没有显著差异的时间点,以及不同时间点对5种水样的区分情况.本研究可为利用Biolog Eco板开展养殖水体微生物群落功能多样性研究提供依据,也为Biolog Eco板在其他水体环境中的应用提供参考.
1 材料与方法
1.1 养殖池塘的选择及管理
本研究共采集了5个水样.WS1和WS2水样取自天津市西青区津静公路北侧鱼塘,东经117°05′,北纬39°10′,取样时间为2018年5月31日.WS1池塘为鲢鱼单养池塘,WS2池塘为南美白对虾精养池塘,2个池塘面积均为4 hm2.2018年5月20日WS1池塘放养鲢鱼4 500尾/hm2,WS2池塘放养虾苗60万尾/hm2.养殖期间WS1池塘不投喂饲料,WS2池塘投喂虾饲料.WS3、WS4和WS5水样均取自天津市西青区畜牧水产局养殖基地南美白对虾精养池塘,东经117°04′,北纬39°11′,取样时间为2018年9月10日.3个池塘面积均为0.5 hm2,2018年6月20日每个池塘放养虾苗30万尾,养殖期间投喂虾饲料.表1为5种水样池塘水质的基本情况和异养菌菌落总数.
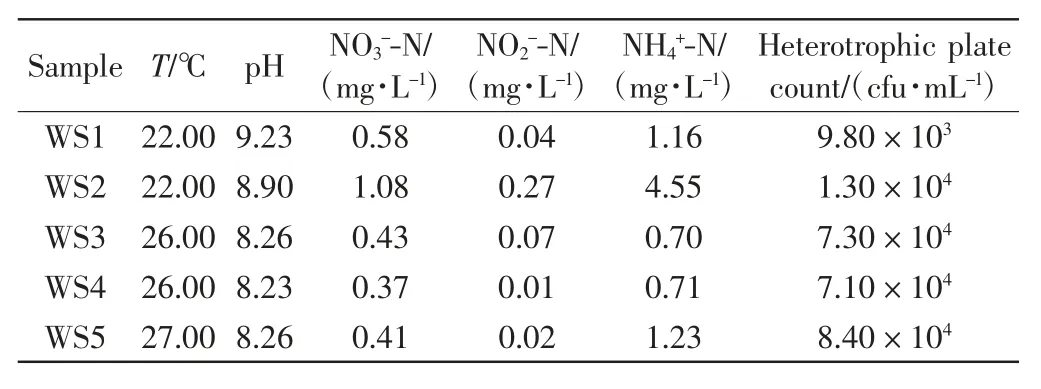
表1 池塘水体理化性质和异养菌菌数Tab.1 Physical chemical characteristics and heterotrophic plate count of the water sample in ponds
1.2 样品采集
用有机玻璃采水器在池塘四周和中心分别采集等量表层水样(水面以下0.5 m),混和后装入无菌取样瓶,每个池塘取2份水样,低温保存,带回实验室立即开展实验.
1.3 测定方法
异养菌总数的测定:将所取池塘水样混和,利用0.85%灭菌生理盐水进行梯度稀释,取合适稀释度的0.1 mL稀释液涂布营养琼脂平板,28℃倒置培养3 d计算菌落总数.
Biolog Eco板操作:用0.85%的生理盐水对水样进行稀释,用八道移液器将样液加入预热的Biolog Eco板中,每孔加150μL.将加好样的Biolog Eco板加盖放入保鲜盒中,25℃培养,每隔24 h利用酶标仪(Elx808,美国Bio Tek公司)读取各孔在750 nm和590 nm下的吸光度值[24].每个池塘的2份水样分别加入到Biolog Eco板中,每个Biolog Eco板3个重复,共6个重复.
Biolog Eco板培养时间的优化:将所取水样以原液加入Biolog Eco板中,记录24~192 h的吸光度值,计算不同时间点微生物群落的AWCD值、6类碳源利用情况、多样性指数并进行主成分分析,确定各项指标达到没有显著差异的时间点,同时研究不同时间点对5种水样的区分.
1.4 计算方法
1.4.1 水样微生物群落平均活性
Biolog Eco板具有96个孔31种碳源,每种碳源设3个重复.用(OD590-OD750)的值表示微生物代谢活性,OD590和OD750的值为加样孔吸光度值减去相应对照孔的吸光度值,当上述差值为负或小于0.06时修正为0[24].微生物的平均活性采用Biolog Eco孔的AWCD来描述,计算公式如下:
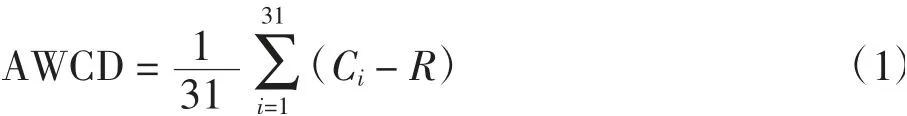
式(1)中:Ci为每个碳源孔测定的两波段吸光度值的差值;R为对照孔的吸光度值;31为碳源种类数.
1.4.2 多样性指数分析
采用Shannon-Wiener指数(H′)、Pielou均匀度指数(J)、Simpson指数(D)、McIntosh指数(Dmc)和McIntosh均匀度(E)来描述微生物群落的功能多样性,计算公式如下[25-26]:
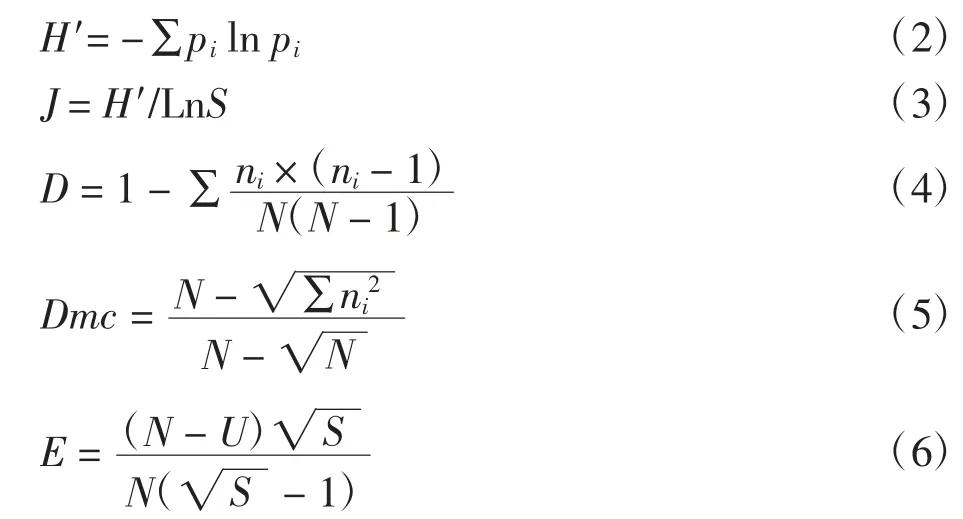
式(2)~式(6)中:ni为每个孔的相对吸光度值即(Ci-R);N为Biolog Eco板上每个重复区域(32个孔)相对吸光度值的总和即∑(Ci-R);pi为第i孔相对吸光度值与其相应重复的相对吸光度值总和的比值,即pi=为颜色变化的孔的数目,即Ci-R>0的孔的数目;在计算Simpson指数时,数据扩大了1 000倍以防止出现负数[25].
1.4.3 碳源利用情况分析
Biolog Eco板含有的31种碳源可以分为6大类,其中氨基酸(amino acids)6种、碳水化合物类(carbohydrates)12种(D-葡萄糖胺酸和D-半乳糖醛酸列入碳水化合物类)、羧酸(carboxyl acids)5种、聚合物(polymers)4种、胺类(amines)2种和酚类2种[5],计算每类碳源对应孔(OD590-OD750)的平均值,以此表征微生物群落对此类碳源的利用情况.
1.4.4 主成分分析
对5个池塘水样72~192 h微生物群落的底物利用特征进行主成分分析(principal components analysis,PCA),同时利用主成分分析比较72~192 h时间点对5种水样的区分.采用协方差矩阵进行主成分分析[27-28].
1.4.5 统计分析
用Excel 2016和SPSS19.0进行数据统计,每种水样的6组吸光度值数据互为平行[24].AWCD值、6类碳源的利用和多样性指数均采用单因子方差分析进行差异统计学意义检验,P<0.05为差异具有统计学意义.ANOSIM方法(analysis of similarities)用于主成分分析后微生物群落底物利用特征的差异统计学意义检验,SIMPER分析(similarity percentages)用于不同时间群落底物利用特征的差异度分析,2种方法通过PAST Version 3软件完成[29],应用Bray-Curtis距离指数.
2 结果与分析
2.1 不同培养时间微生物群落的AWCD值
5种水样微生物群落AWCD值随培养时间的变化如图1所示.
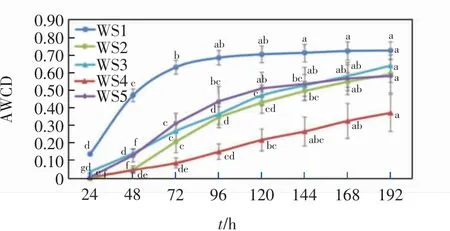
图1 微生物群落AWCD值的变化曲线Fig.1 Change curve of AWCD value of microbial community
AWCD曲线在经过一定时间的延迟后迅速升高,进入指数增长期,随着培养时间的延长趋于稳定.其中,WS1水样最早进入稳定期,96 h后各时间点AWCD值没有显著差异.WS2、WS3和WS5水样进入指数增长的时间比WS1水样延迟,AWCD值趋于稳定的时间分别为168、168和120 h.WS4水样AWCD值显著低于其他水样,在144 h后各时间点的AWCD值没有显著差异.
2.2 不同培养时间6类碳源利用情况
5种水样72~192 h的碳源利用情况如图2所示.由图2可以看出,WS1水样微生物群落对氨基酸类碳源的利用在96 h后没有显著差异,而其他各类碳源的利用在72 h后没有显著差异,即6类碳源在96 h后没有显著差异;WS2水样微生物群落对碳水化合物类、氨基酸类、羧酸类、多聚物类、酚酸类和胺类的利用没有显著差异的时间点分别为96、120、120、192、144、120 h,即6类碳源的利用在192 h后没有显著差异;WS3水样微生物群落对6类碳源的利用没有显著差异的时间点分别为144、168、144、144、120、120 h,即6类碳源的利用在168 h后没有显著差异;WS4水样微生物群落对6类碳源的利用没有显著差异的时间点分别为120、144、120、144、144、168 h,即6类碳源的利用在168 h后没有显著差异;WS5水样微生物群落对6类碳源的利用没有显著差异的时间点分别为96、72、72、120、72、72 h,即6类碳源的利用在120 h后没有显著差异.
对比不同时间点水样碳源利用的大小顺序,发现144 h后WS1水样碳源利用顺序稳定为胺类>羧酸类>多聚物类>碳水化合物类>氨基酸类>酚酸类;192 h后WS2水样稳定为多聚物类>氨基酸类>酚酸类>碳水化合物类>羧酸类>胺类;WS3、WS4和WS5水样6类碳源的利用顺序相同,分别在144 h、168 h和120 h稳定为多聚物类>碳水化合物类>羧酸类>氨基酸类>酚酸类>羟酸类胺类.即除WS1水样外其他4种水样6类碳源的利用达到没有显著性差异之后,6类碳源的利用顺序都趋于稳定.
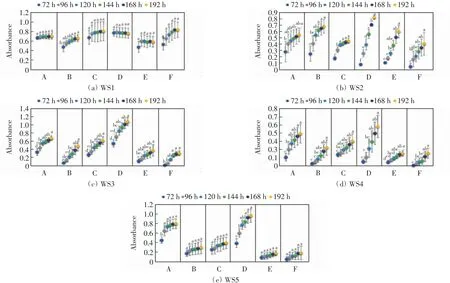
图2 不同培养时间下微生物群落的6类碳源利用情况Fig.2 Utilization of six grouped carbon sources by microbial communities at different incubation time
2.3 不同培养时间多样性指数的变化
5种水样72~192 h微生物群落的多样性指数如表2所示.由表2可以看出,WS1水样微生物群落的Shannon-Wiener指数、Pielou均匀度指数、Simpson指数、McIntosh指数和McIntosh均匀度分别在144、72、120、72、72 h后没有显著差异,即5个多样性指数在144 h后没有显著差异;WS2水样微生物群落的各项多样性指数分别在144、96、120、96、96 h后没有显著差异,即5个多样性指数在144 h后没有显著差异;WS3水样微生物群落5个多样性指数均在120 h后没有显著差异;WS4水样微生物群落的5个多样性指数分别在120、72、120、96、72 h后没有显著差异,即5个多样性指数在120 h后没有显著差异;WS5水样微生物群落除McIntosh指数在120 h后没有显著差异外,其他各项指数均在72 h后没有显著差异.
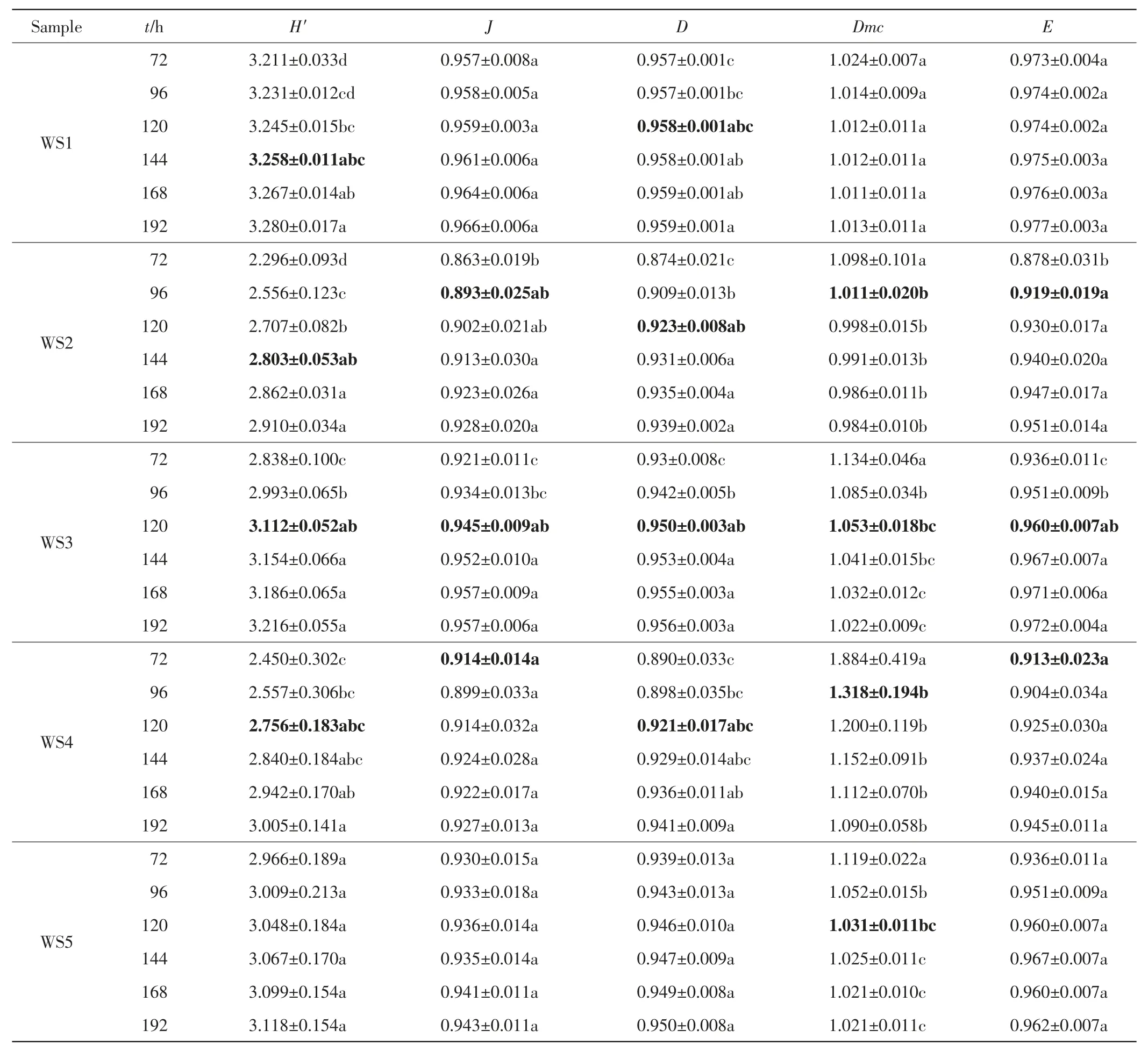
表2 不同培养时间下微生物群落的多样性指数Tab.2 Diversity indices for microbial communities at different incubation time
2.4 不同培养时间水样主成分的变化
对5种水样不同培养时间的数据进行主成分分析,分析不同培养时间微生物群落底物利用特征的差异,结果如图3所示.图3中展示了每一水样6个平行样从72~192 h各时间点的排序情况,从图3中可以看出每个样品72 h、96 h的各点分布与120、144、168和192 h的各点分布距离较远,反映出样品微生物群落培养前期CSUP与培养后期差别较大.通过ANOSIM方法分析5种水样微生物群落不同时间点CSUP的差异显著性,结果发现5种水样微生物群落的CSUP分别在96、120、144、120和96 h后没有显著差异,各水样ANOSIM分析的R值和P值如表3所示.
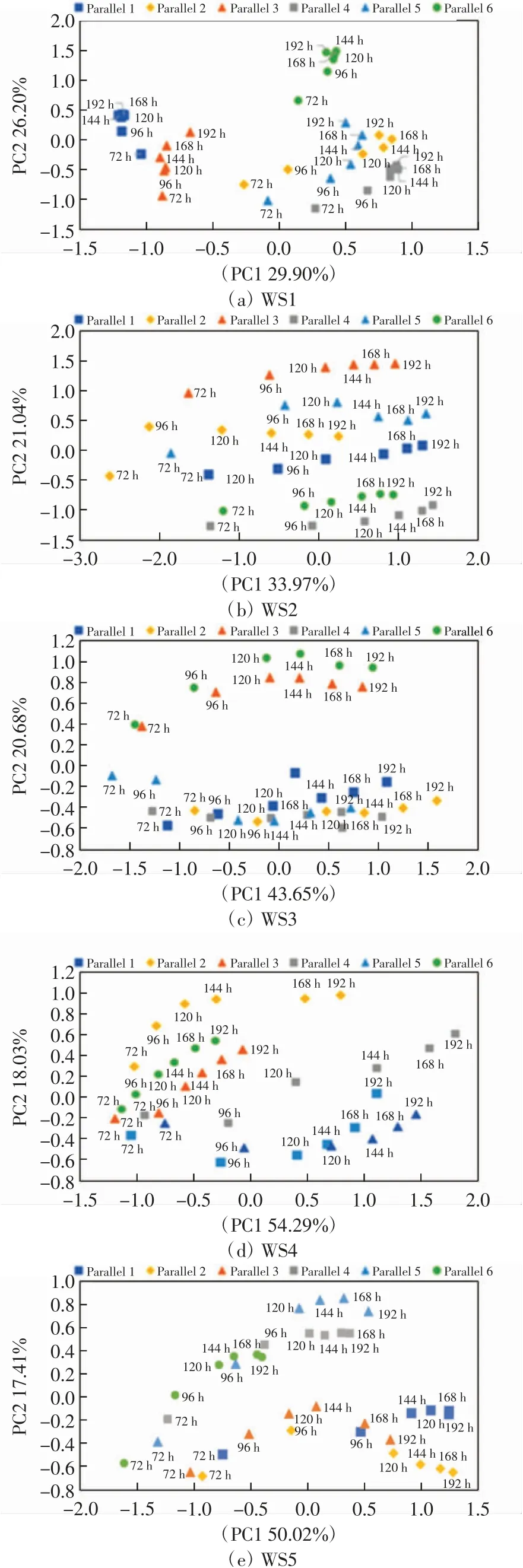
图3 水样不同培养时间下微生物群落底物利用特征的主成分分析Fig.3 Community substrate utilization profile at different incubationtimebyprincipalcomponentanalysis(PCA)
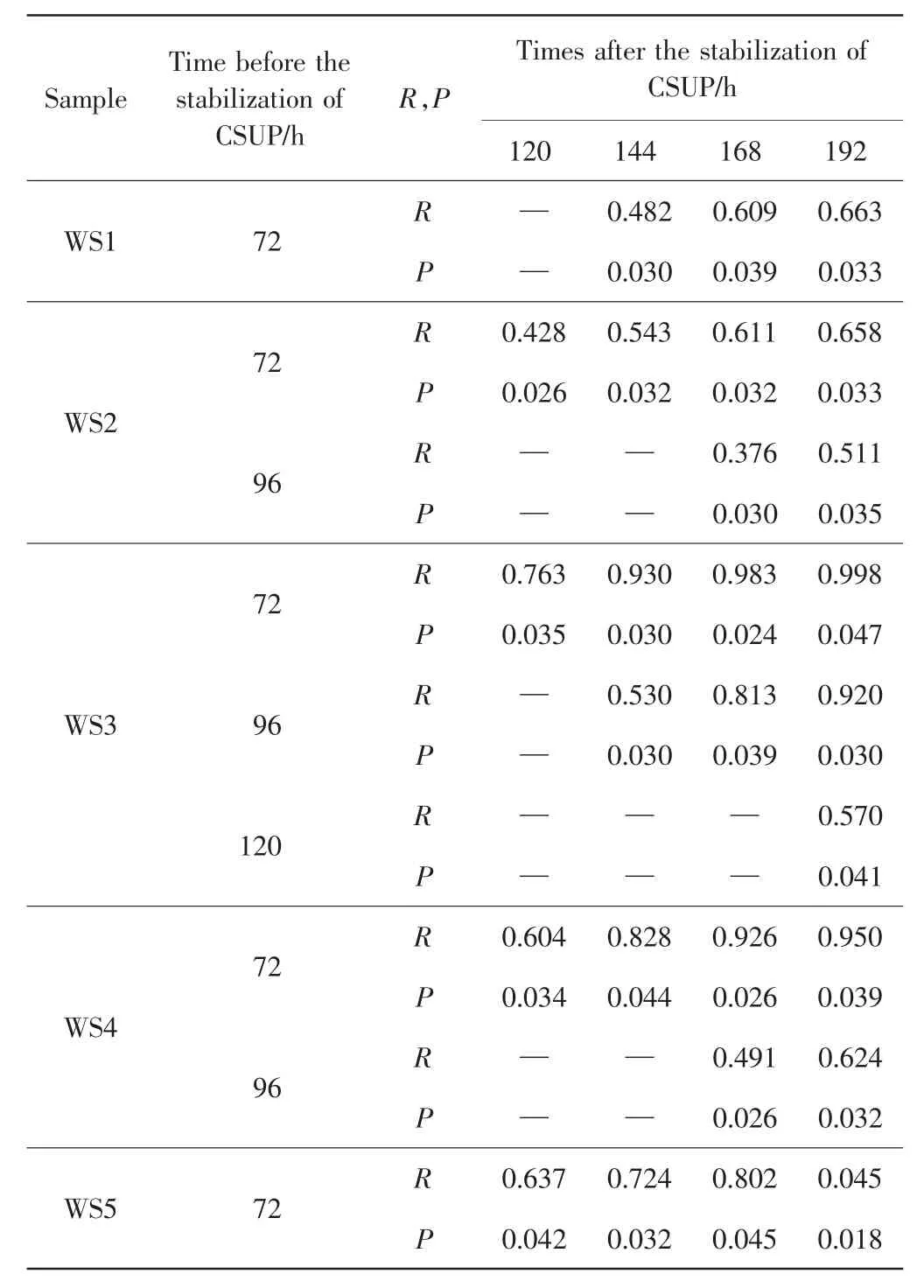
表3 不同培养时间下微生物群落底物利用特征的ANOSIM分析Tab.3 ANOSIM analysis between CSUPs of microbial communities at different incubation time
2.5 不同时间点对5种水样的区分
为了解不同时间点对5种水样的区分情况,利用5种水样在72~192 h的吸光度值数据进行主成分分析,结果如图4所示.由图4可以看出,72、96和120 h时间点5种水样在第一和第二主成分上的距离和分布可见明显变化,144、168和192 h时间点5种水样在第一和第二主成分上的分布基本一致,说明144 h后微生物群落的底物利用特征趋于稳定.ANOSIM分析的R值和P值如表4所示.通过ANOSIM方法分析发现各时间点5种水样微生物群的CSUP均存在显著差异(P<0.05),即各时间点数据均能区分5种水样.对不同时间点5种水样微生物群落的CSUP进行SIMPER相似度分析,结果如表5所示.由表5可以看出,在72~192 h内随着培养时间的延长两两水样之间的差异百分比逐步降低.
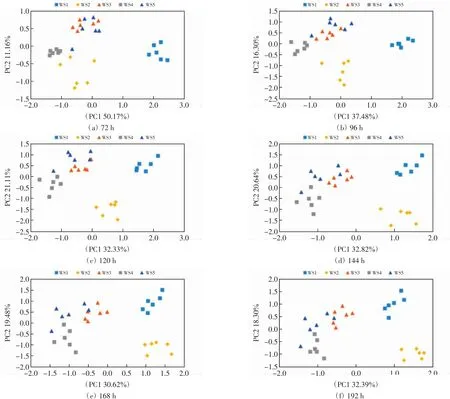
图4 不同培养时间对5种水样的区分Fig.4 Differentiation of the five water samples by different incubation time
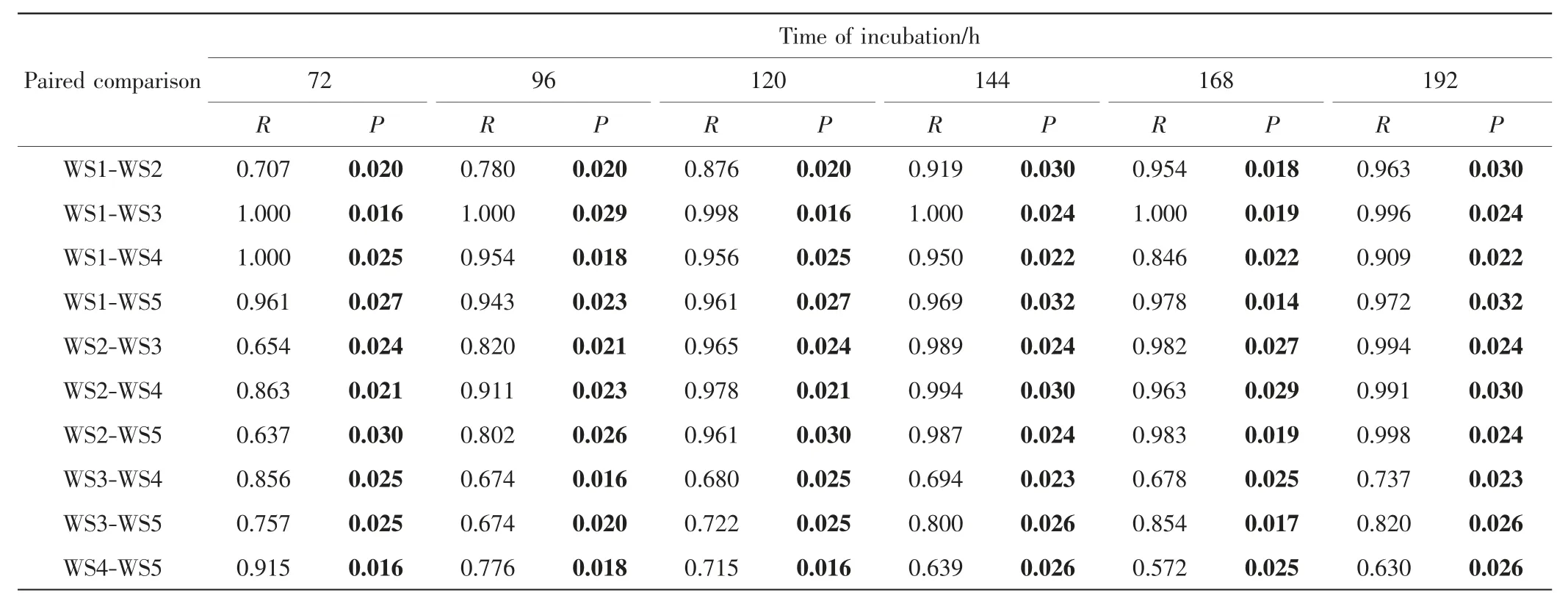
表4 不同培养时间5种水样两两比较的ANOSIM分析Tab.4 ANOSIM analysis of paired comparison between the five water samples at different incubation time
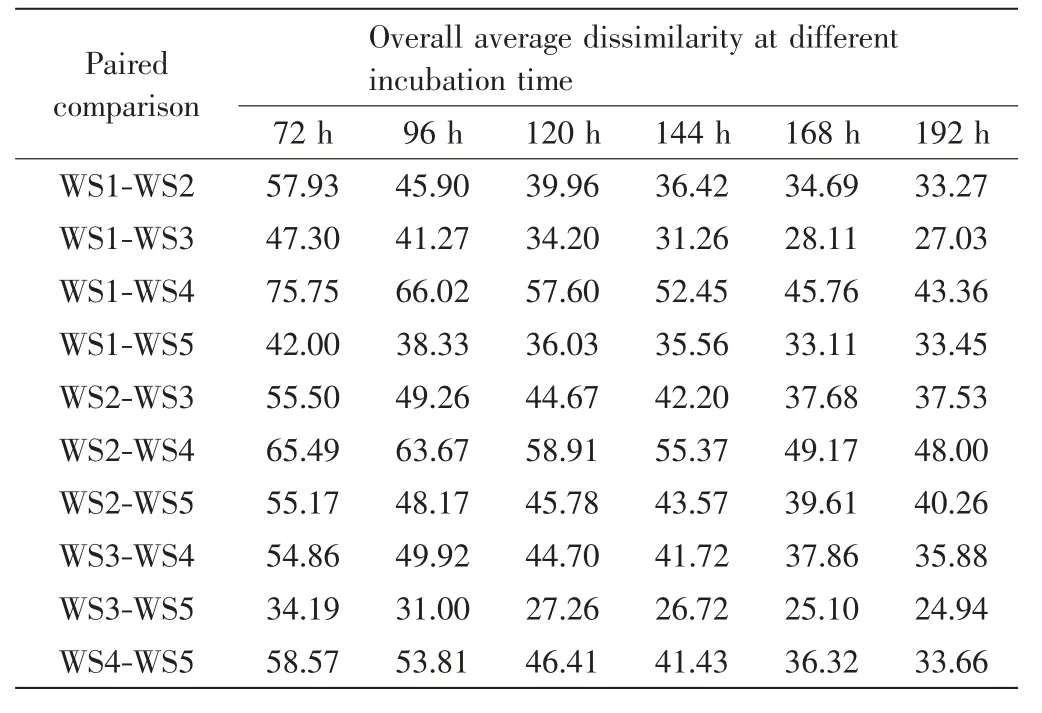
表5 不同培养时间5种水样两两比较的SIMPER分析Tab.5 SIMPER analysis of paired comparison between the five water samples at different incubation time%
3 讨论
在研究微生物多样性时,由于环境样品的复杂性,在利用Biolog Eco板分析时要选择众多参数包括AWCD值、6类碳源利用情况、多样性指数及主成分分析等进行描述和比较不同样品间的差异[30-31].本研究发现养殖水体微生物群落的上述指标达到没有显著差异的时间不同,其中WS1水样AWCD值、6类碳源利用情况、多样性指数及主成分分析达到没有显著差异的时间点分别为96、96、144和96 h;WS2水样为168、192、144和120 h;WS3水样为168、168、120和144 h;WS4水样为144、168、120和120 h;WS5水样为120、120、120和96 h.这是因为同一样品各指标达到稳定的时间不同与各指标对时间的敏感度不同相关.AWCD作为颜色平均变化率反映的是Biolog Eco板的平均活性,AWCD值稳定后,各孔的颜色还可能不断变化,因此各类碳源利用情况和多样性指数还会发生变化.
本实验中养殖水体微生物群落各功能指标达到稳定的时间不同,但是各时间点都在AWCD曲线的达到没有显著差异的时间点(即拐点)附近.其中除WS1水样多样性指数在拐点之后48 h,WS2和WS4水样6类碳源的利用在拐点之后的24 h外,5种水样其他各项指标达到稳定的时间都在拐点之前.说明当水样AWCD曲线达到拐点时,微生物群落的各项代谢功能指标都趋于稳定.这与贾夏等[19]研究土壤样品Biolog Eco板培养时间对分析结果的影响时的结论相一致.
本研究同时讨论了不同时间点对5种水样的区分,ANOSIM分析发现72~192 h各个时间点都可以很好地区分5种水样,但是SIMPER分析表明水样之间的差异程度随培养时间的延长而降低.可能因为随着培养时间的延长,Biolog Eco板上很多孔的颜色处于饱和,只能通过显色较小或者没有颜色变化的孔进行样品的区分,所以导致水样之间差异程度减小.如果要充分研究水样微生物群落CLPP各相关指标,可以利用AWCD值达到没有显著差异的时间点进行分析,这时可以兼顾生长较慢的微生物,能够全面地反映环境中的微生物群落[19].但建议不过多延长培养时间,因为随着培养时间的延长存在平行样品标准差增大和光孔反应饱和的问题[13].
如果为最大程度地区分样品微生物群落CLPP各项指标的差异,可以选择AWCD值指数增长期的时间点进行分析,此时可以较好地反映出环境样品中生长较快的细菌种类.但是利用指数增长期数据进行分析,一般要求大致相同的接种密度[1].本实验中WS1水样在接入Biolog Eco板后快速进入指数增长期,而WS2~WS5水样的指数增长较缓慢.目前养殖水体富营养化问题突出,池塘水样成分复杂,养殖水体理化指标是否会对Biolog Eco板的显色产生影响还有待于进一步研究.
综上所述,养殖池塘水样接入Biolog Eco板的培养时间对分析微生物群落的功能多样性具有显著影响,微生物群落的各项功能指标均在AWCD值达到没有显著差异的时间点趋于稳定.为了更好地区分样品,可以选择指数增长期的时间点,此时水样之间的差异度高于稳定期.
