东方百合转化探究
2020-09-24冯慧敏
冯慧敏 张 伟 洪 波
(大兴安岭职业学院 黑龙江大兴安岭 165099)
百合花姿优美,色彩丰富,位列四大鲜切花,深受人们的喜爱。百合花粉颜色较深,附着性强,一般使用前需要人工摘除,以防止污染花瓣和衣物等。如何解决花粉污染问题一直是百合育种的研究热点之一。文章应用转基因技术,对东方百合进行转化改造,将外源基因ZM401 导入东方百合基因组,促使花药特异性表达,花药不能正常发育形成,也就不能形成花粉,从而解决花粉污染问题,为培育百合无花粉新品种进行探索研究。
1 实验材料
应用东方百合的组培苗生长的小鳞茎鳞片为植物实验材料。目标基因借助根癌农杆菌菌株LBA4404 进行转化,菌株含携带ZOM401 基因的质粒pBI121,目标片断大小为702 个bp。
2 实验方法
2.1 建立东方百合鳞片外植体的高频再生体系
取组培苗直径约1.5 cm 小鳞茎的鳞片,切成四周都有伤口约0.5 cm2的小块,注意切掉鳞片基部可能存在潜伏芽的部位,将处理好的外植体接种在含生长素0.2 mg/L NAA的基础培养基(单位符号为mg/L,以下无特殊说明均省略),细胞分裂素BA 设5 个浓度梯度,依次为0.5、1.0、1.5、2.0、2.5。每种浓度处理接种30 个外植体,30 d 继代一次。45 d 后统计鳞片分化情况。
再生苗生长至2~3 cm 高时转入1/2MS 生根培养基,设2 个NAA 浓度梯度,分别为NAA0.2 和NAA0.5。生根培养45 d 统计生根结果。苗高5~6 cm、根长3~5 cm 时进行移栽驯化,最后栽植到蛭石∶草炭土=1∶1 的基质中。
2.2 潮霉素选择浓度试验
鳞片高频再生培养基(MS + NAA 0.2 + BA 1.5)中添加潮霉素,浓度梯度为0、10、20、30、40、50,每种浓度接种鳞片40 个,培养一个月后统计结果。
2.3 农杆菌介导的遗传转化
2.3.1 培养基组成
通过再生实验结果分析,确定东方百合鳞片再生培养基为MS + NAA0.2 + BA1.5。选择培养基在此基础上添加Hy40 和Cb300。为了促进鳞片芽的形态建成降低BA浓度,即发育培养基为MS + NAA0.2 + BA0.5 + Hy40 + Cb300。生根培养基为1/2MS + NAA0.5+ Hy40 + Cb300。
2.3.2 转化实验步骤
把东方百合鳞片外植体接入分化培养基诱导3 d 后放入OD600 =0.4~0.6 的菌液中侵染5 min,取出后用无菌滤纸吸干菌液,接种在预培养基中,暗培养2~4 d,温度控制在26 左右。然后将鳞片外植体转入选择培养基培养,30 d 继代转接一次,培养60 d 后转入发育培养基继续培养。当抗性再生苗高约2 cm 时转入生根培养基。
3 结果与分析
3.1 东方百合鳞片外植体高频再生体系的建立
3.1.1 不同浓度BA 对鳞片不定芽诱导的影响
鳞片接种7 d 左右颜色加深,体积膨大,10 d 后开始出现淡黄色或白色芽点,14 d 后开始分化不定芽。30 d 后除含BA2.0 的培养基外其他各BA 浓度培养基诱导的鳞片外植体都分化出芽,并形成小植株。培养45 d,含BA1.5 的培养基中再生芽长1.2 cm 左右。不同BA 浓度梯度培养基中,再生芽增殖系数分别为2.25、2.41、3.08、2.25、1.58,所有鳞片外植体都可分化出芽,其中含BA1.5培养基中的外植体分化芽数最多,增殖系数最高,可作为鳞片外植体诱导分化培养基。试验结果见表1。
3.1.2 不同浓度NAA 和MS 或1/2MS 组合对东方百合再生苗生根的影响
再生苗高2~3 cm 时转入生根培养基,生根培养基为MS 和1/2MS 培养基中添加NAA(0.2 和0.5),培养8 d 左右再生苗开始生根,根黄绿色,生长健壮,并有大量白色根毛。
生根培养45 d 结果如下:1/2MS+NAA0.5 培养基中的幼苗叶丛基部多数形成小鳞茎,每株叶4~6 片,具长柄,叶披针形,绿色。根黄绿色,根毛长约2 mm,根径约1.5 mm以上根长3~4 cm,平均每株生根11.2 根。该培养基诱导根的质量最高,根较长且粗壮,而且平均每株生根数量11条以上,能够保证正常的营养供应,盆栽成活率和大田移栽成活率都是最高的。
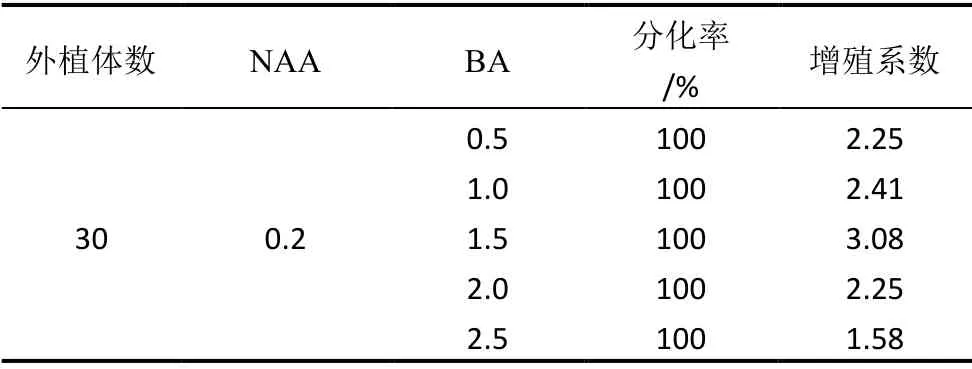
表1 鳞片外植体不定芽诱导分化的情况
3.2 潮霉素对鳞片外植体再生的影响
将百合鳞片外植体接种到含潮霉素的再生培养基中诱导培养7 d 后,鳞片褪绿变白,潮霉素浓度越高白化现象愈严重。接种Hy40 中的鳞片外植体87.5%褐化死亡,可选择Hy40 为亚致死浓度。当Hy 浓度达到50,所有外植体都死亡,为致死浓度。选择鳞片潮霉素抗选择压为40 mg/L,能抑制或杀死非转化细胞,又不抑制转化细胞正常生长。
3.3 鳞片遗传转化的结果
东方百合鳞片外植体侵染培养4 d 后转接到选择培养基中继续诱导,生长13 d 后多数外植体切口出现褐化的现象,培养时间越长,外植体褐化死亡越多,仅有少数的外植体膨胀变大。培养30 d 后有3~7 个的外植体(接种100个/重复)出现淡黄色芽点,大部分外植体死亡或失去再生能力。培养50 d 获得2~4 抗性芽,培养60 d 抗性芽1 cm左右,转入发育培养基。再培养至芽长2 cm 左右,转入生根培养基。18 d 后抗性芽生根,(对照10 d 开始生根),培养45 d 根长1~3 cm(对照2~5 cm),再生芽叶片伸长,植株基部开始形成小鳞茎。
东方百合鳞片外植体遗传转化试验共获得23 个抗性芽,占侵染总数3 000 块的0.76%。
3.4 转基因植株的PCR 检测
对东方百合转化筛选出的23 株苗进行PCR检测,其中9 株显示为阳性,初步确认ZM401 基因整合到东方百合基因组中。东方百合共侵染3000 块鳞片外植体,获得阳性转基因株系9 个,遗传转化率0.3%。
4 讨论
百合鳞片培养可直接形成不定芽和愈伤组织,是良好的遗传转化材料[4]。用组培无菌苗作转化受体材料,取材不受季节的限制,还能避免消毒剂的影响,较适合作为受体外植体材料。而且直接分化成苗,变异率小,分化率较高。鳞片外植体再生苗主要分布在鳞片的伤口处,鳞片的底部较多,上部稍少,两侧切口形成的最少,有可能是鳞片内部的激素分布不均造成的。所以外植体材料应尽可能选择鳞片底部部位。而且再生芽多是从切口处诱导形成的,有利于农杆菌侵染,可提高转化率。[5~7]菌液侵染浓度对百合转化效率影响较大,实验过程中菌液稀释20 倍以上时进行侵染实验,侵染几百个鳞片外植体,仅获得1 个抗性芽,经PCR 检测还是假阳性的。虽然侵染菌液浓度低,抗生素应用量少,对外植体影响小,但是极难成功转化,可见菌液浓度不能太低。
