高铁酸盐-亚硫酸盐体系氧化降解水中污染物阿特拉津
2020-09-23袁光明皮若冰吴钊成孙旭辉
袁光明,皮若冰,吴钊成,孙旭辉
(1 东北电力大学化学工程学院,吉林吉林132012;2 中国石油吉林石化公司污水处理厂,吉林吉林132002)
阿特拉津(atrazine,ATZ)是一种三氮苯类除草剂,由于其除草效果好、成本低廉等原因,被广泛应用于农业,是世界上应用最广泛的除草剂之一[1]。由于ATZ 的高迁移率和较长的半衰期以及一定的水溶性,很容易就能通过淋溶和地表径流等方式进入到水环境中[2-4]。目前在许多国家和地区的地表水和地下水中都可以频繁检测到ATZ 的存在[5],是地下水和地表水中检出率最高的农药之一[6]。ATZ 具有分子结构稳定、难降解等特点,传统的生物处理技术对ATZ 的处理效果不太理想[7-8];此外,吸附法和氧化法等方法在处理ATZ 时也存在如吸附效率低、处理成本高、降解时间长、处理效果不理想等问题[9-11]。因此,探索一种高效、环保的处理水中ATZ的方法具有重要的实际意义。
近些年来,基于硫酸根自由基(SO·-4)的高级氧化技术受到越来越多的关注。在水环境体系中,与羟基自由基(·OH,氧化还原电位1.9~2.7V,半衰期<1µs)相比,SO·-4 具有更强的选择性、更高的氧化还原电位(2.5~3.1V)以及更长的半衰期(30~40µs),在处理一些难降解有机物时表现出更好的处理效果[12-14]。研究发现,SO·-4 的产生可以通过活化过硫酸盐或亚硫酸盐等方式产生[15]。与过硫酸盐相比,亚硫酸盐价格更便宜,性价比高[16]。常用于活化亚硫酸盐的方法有用Fe2+/Fe3+、Cu2+、Co2+等过度金属离子、紫外光(UV)以及重铬酸钾、高锰酸盐、高铁酸盐等强氧化剂[15]。采用Cu2+、Co2+等金属离子、高锰酸盐和重铬酸钾活化亚硫酸盐会产生二次污染,紫外光活化亚硫酸盐的成本过高[17-19]。尽管Fe2+/Fe3+环境友好、廉价易得,但Fe2+/Fe3+活化亚硫酸盐只有在酸性条件下才表现出较好的处理效果,在中性和碱性条件下处理效果很不理想[20-21]。与上述活化方式相比,高铁酸盐分解后的产物为Fe3+,不会产生二次污染;此外,与Fe2+/Fe3+活化方式不同的是,高铁酸盐活化亚硫酸盐在中性和碱性条件下也表现出良好的去除效果[22]。
基于上述分析,本文采用高铁酸盐活化亚硫酸盐,以ATZ为目标污染物,系统研究了高铁酸盐-亚硫酸盐体系降解ATZ的效能,为高铁酸盐-亚硫酸盐体系的实际水处理应用提供数据和理论支持。
1 实验部分
1.1 实验材料
本实验所用的高铁酸盐晶体为自制产品,先采用电解法制得高铁酸盐溶液后,经过结晶、脱水、脱碱、真空干燥后制成高铁酸盐晶体(纯度≥92%)。阿特拉津(ATZ,纯度≥97%)购自上海源叶生物科技有限公司。甲醇(色谱纯)购自上海Sigma-Aldrich 化学品有限公司。其他试剂包括亚硫酸钠、硫酸、磷酸、氢氧化钠、磷酸氢二钾、四硼酸钠、乙醇、叔丁醇、丙酮、盐酸羟胺等均为分析纯,购自中国国药集团化学试剂有限公司。
1.2 分析方法
利用岛津LC-2010型高效液相色谱对水样中的ATZ浓度进行测定。测定条件如下:采用的色谱柱为Thermo Fisher Scientific Symmetry C18柱(4.6mm×150mm×5µm);流动相为甲醇和水,其体积比为甲醇∶水=70%∶30%;流动相的流速0.8mL/min,柱温30℃,检测波长223nm,进样体积20µL。溶液中高铁酸盐的浓度是通过直接紫外光谱法进行测定,测定波长为510nm。
1.3 实验方法
ATZ 储备液的浓度为100µmol/L,该溶液每周配制一次,在4℃的条件下避光保存。配置方法:先将所需量的ATZ 溶解在5mL 丙酮中,随后用去离子水将其定容至1000mL。高铁酸盐储备液是用5mmol/L 的磷酸盐缓冲溶液和1mmol/L 的硼酸盐缓冲溶液配制所得,实验所用的高铁酸盐溶液和亚硫酸盐溶液均在实验开始之前新鲜配制。
ATZ降解实验均在室温下进行,本实验所用水样中ATZ 的浓度设定为20µmol/L。由于高铁酸盐自身分解会产生大量氢氧根离子(OH-)提高受纳水体碱度,为稳定体系的pH,本实验均在磷酸盐缓冲溶液中进行。在反应开始之前,先将所需浓度亚硫酸盐溶液加入到含有100mL ATZ(40µmol/L)的缓冲盐溶液中,并用0.1mol/L 的磷酸和0.1mol/L的氢氧化钠溶液将溶液酸度分别调至低于目标pH,再加入相同体积的高铁酸盐储备液(200µmol/L)后,溶液的pH 达到反应所需的pH(5.0、7.0、9.0),反应随即开始。在设定的时间下,用移液枪从各烧杯中取出5mL 样品,立刻加入到含有10µL盐酸羟胺溶液(500mmol/L)的小烧杯中终止反应,然后用孔径0.45µm 的乙酸纤维素滤膜过滤,将过滤后的样品注入到液相色谱小瓶中,用于后续的液相色谱检测。
2 结果与讨论
2.1 可行性研究
为了探究高铁酸盐-亚硫酸盐体系降解ATZ 的可行性,本实验选择ATZ 作为目标污染物,在高铁酸盐浓度为100µmol/L,亚硫酸盐浓度为400µmol/L,pH=7.0 的条件下进行实验,实验结果如图1 所示。100µmol/L 的高铁酸盐对ATZ 的去除率只有不到4%,400µmol/L 的亚硫酸盐几乎不能去除ATZ;当二者联合作用后,高铁酸盐-亚硫酸盐体系中的ATZ在不到10s的时间里就去除了大约47%,此后随着反应时间的增加,ATZ的去除率几乎不变。这一结果表明,高铁酸盐-亚硫酸盐体系具有可行性且能对污染物实现快速去除。基于这一结果,为便于后续实验的进行,除特殊说明外,实验的反应时间均定为1min。

图1 高铁酸盐-亚硫酸盐体系降解ATZ的可行性
2.2 活性自由基的鉴别
研究发现,乙醇(EtOH)与·OH 和SO·-4 的反应速率常数分别是(1.2~2.8)×109L·mol-1·s-1、(1.6~7.7)×107L·mol-1·s-1;而叔丁醇(TBA)与·OH和SO·-
4的反应速率常数分别为(3.8~7.6)×108L·mol-1·s-1、(4~9.1)×105L·mol-1·s-1[23]。从与两种不同自由基之间反应速率常数的差异可以发现,EtOH 的加入不仅会淬灭体系中的也会淬灭其中的·OH;与之相比不同的是,由于TBA 对两种自由基的巨大差异(>103倍),TBA 的加入主要是淬灭体系中的·OH,对的影响可以忽略。除和·OH的作用外,体系中可能存在的其他活性物质有亚硫酸根自由基和过一硫酸根自由基以及中间价态铁[Fe(Ⅳ)/Fe(Ⅴ)]。和都是自由基链反应中的重要成分,但二者的反应活性都很低[24],其对ATZ降解的影响可以忽略不计。相较于和中间价态铁的反应活性更强,且其与醇类的反应速率常数较低k=2.51×103L·mol-1·s-1[25],加入的醇类很难抑制中间价态铁对ATZ 的降解,EtOH 和TBA 对中间价态铁[Fe(Ⅳ)/Fe(Ⅴ)]都没有抑制作用,对实验影响可以消除(对比实验)。因此,通过对比加入等量的EtOH和TBA之后,体系中ATZ 去除率之间的差异,可以鉴定体系中存在的活性自由基,并估算二者对体系中ATZ 去除上所做出的贡献。
体系中的活性自由基主要是与体系中的目标污染物ATZ发生反应,所加入的EtOH 和TBA主要是与体系中的ATZ 竞争反应,消耗体系中的活性自由基。因此为了更好的体现出EtOH 和TBA对自由基的淬灭作用,将加入的EtOH和TBA的浓度设定为目标污染物的1000 倍,即20mmol/L。其他实验条件分别为高铁酸盐浓度为100µmol/L,亚硫酸盐浓度为400µmol/L,pH=7.0。实验结果如图2所示,EtOH 和TBA 的加入不同程度的抑制了高铁酸盐-亚硫酸盐体系中ATZ 的去除。在加入20mmol/L 的EtOH 后,体系中ATZ 的去除率从47%降低至不到5%,在加入同样浓度的TBA 之后,体系中ATZ 的去除率降低至30%,这一结果表明,在高铁酸盐-亚硫酸盐体系中,对于目标污染物ATZ 的去除起主要作用的是计算后发现,的贡献约为53%;·OH的贡献约为36%。由于反应是在磷酸盐缓冲体系中,没有氢氧化铁絮体生成,不存在吸附去除,故认为对去除率其余的贡献应该是由于中间价态铁[Fe(Ⅳ)/Fe(Ⅴ)]所致。

图2 EtOH和TBA对高铁酸盐-亚硫酸盐体系去除ATZ的影响
2.3 影响因素
2.3.1 亚硫酸盐浓度的影响
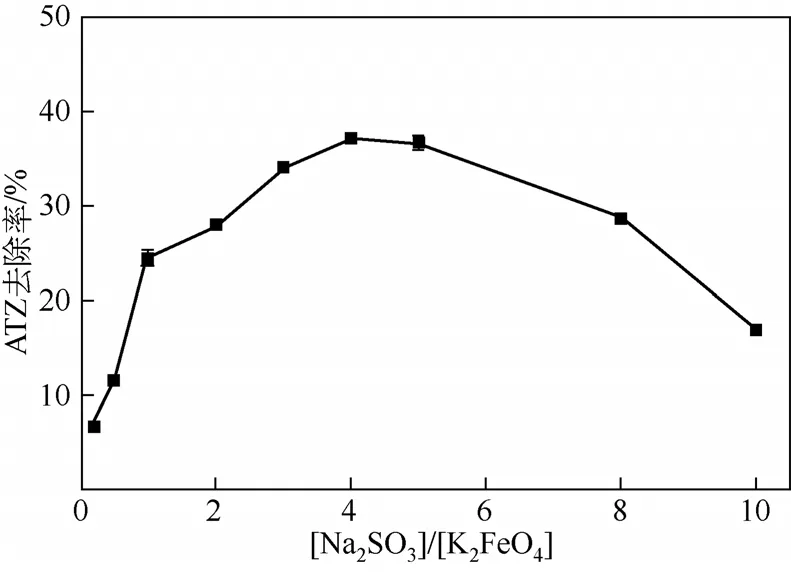
图3 亚硫酸盐浓度对高铁酸盐-亚硫酸盐体系去除ATZ的影响

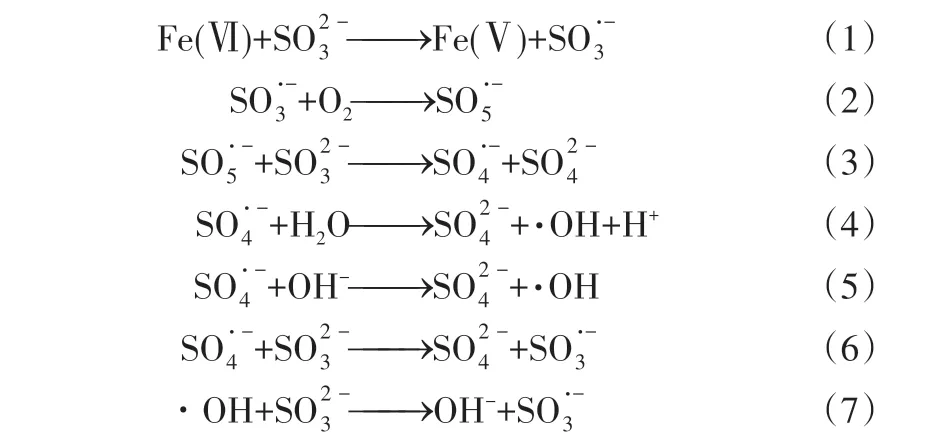
2.3.2 pH的影响
通过设定pH=5.0、7.0、9.0,探究酸度对高铁酸盐亚硫酸盐体系降解ATZ的影响,其他实验条件分别是高铁酸钾的浓度为100µmol/L,ATZ 的浓度为20µmol/L,亚硫酸盐的浓度为400µmol/L。实验结果如图4 所示,随着pH 的升高,体系中ATZ 的去除率先随之升高,在pH=7.0时达到最大值47%;此后继续提高体系的pH,体系中ATZ 的去除率反而随之降低了。
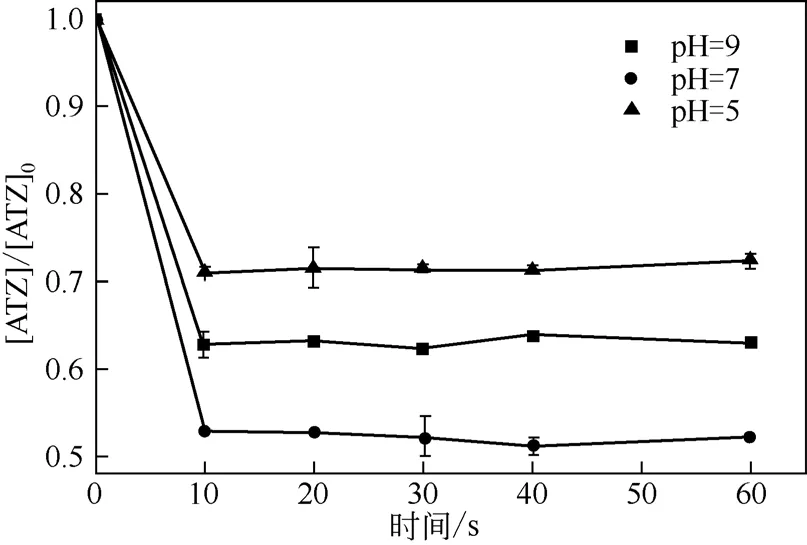
图4 pH对高铁酸盐-亚硫酸盐体系去除ATZ的影响
高铁酸盐作为一种强氧化剂,其在强酸性条件下的氧化还原电势为E0=2.20V,在强碱性条件下为E0=0.72V[29]。尽管高铁酸盐的氧化能力是随着pH的降低而增强,但是随着pH 的降低,高铁酸盐的稳定性也随之急剧下降。当pH=9.0 时,高铁酸盐的稳定性较强,但其氧化能力较弱,活化亚硫酸盐的能力也较弱,而当pH=5.0 时,高铁酸盐的氧化能力很强,但其自身分解速率也因为pH 的降低而大大提高了,大量的高铁酸盐没有参与到亚硫酸盐的活化过程中,而是自身分解了[30]。此外,pH 的改变不单单只是影响高铁酸盐的氧化性和稳定性,同样会对体系中的活性自由基造成一定的影响。随着pH的升高,体系中存在的SO·-4 会与体系中逐渐增多的OH-发生反应,生成·OH[式(5)][31]。因此平衡各种因素,中性条件最有利。
2.3.3 ATZ浓度的影响


图5 ATZ浓度对高铁酸盐-亚硫酸盐体系去除ATZ的影响

2.3.4 高铁酸盐浓度的影响
从图1可知,体系中存在的亚硫酸盐只有在被高铁酸盐活化后,才能生成活性自由基来降解体系中的目标污染物ATZ。由2.3.1 节可知,最佳的高铁酸盐与亚硫酸盐的投加比为1:4,接下来在固定这一投加比的条件下,提高高铁酸盐的浓度进行测试,实验结果如图6所示。随着高铁酸盐浓度的提高,体系中ATZ 的去除率反而随之降低了。高铁酸盐浓度为100µmol/L时,体系中ATZ的去除率为37%,随着高铁酸盐浓度的提高,ATZ的去除率也随之降低至34%、29%。

图6 高铁酸盐浓度对高铁酸盐-亚硫酸盐体系去除ATZ的影响
同样需要注意的是,在固定投加比后,体系中的亚硫酸盐的浓度也随着高铁酸盐浓度的提高而提高了。一种可能的原因是,在提高高铁酸盐和亚硫酸盐浓度后,体系中的高铁酸盐更多地活化了体系中的亚硫酸盐,产生的活性自由基的量随之大大增加了,然而高浓度的SO·-4 的自我淬灭消耗也被大大加剧了,参与到降解ATZ 的活性自由基的浓度反而降低了。另一种可能的原因是,高铁酸盐对亚硫酸盐的活化作用只有在亚硫酸盐浓度较低时才能发生,即使同样提高高铁酸盐和亚硫酸盐的浓度,高铁酸盐也只能活化一定浓度的亚硫酸盐,而体系中过量的亚硫酸盐反而消耗了产生的活性自由基,导致ATZ去除率的降低。
为了进一步探究高铁酸盐浓度对高铁酸盐-亚硫酸盐体系降解ATZ 的影响,在不同的高铁酸盐的浓度下改变亚硫酸盐浓度进行实验。实验条件为高 铁 酸 盐 浓 度 设 定 为100µmol/L、200µmol/L、400µmol/L,亚硫酸盐的浓度为10~2000µmol/L,ATZ 的浓度为20µmol/L,pH=9.0。实验结果如图7所示,不同的高铁酸盐浓度下,体系中ATZ 的去除率都是随着亚硫酸盐浓度的增加而先提高后降低,这与我们前面实验所得的结果一致。此外,同样可以发现,随着高铁酸盐浓度的增加,体系中可以达到的最高的ATZ去除率也随之增加。

图7 不同高铁酸盐浓度下亚硫酸盐与高铁酸盐浓度比值对ATZ去除的影响

2.3.5 亚硫酸盐投加方式的影响
由2.3.4 节可知,不同浓度的高铁酸盐对应的最佳亚硫酸盐浓度是400µmol/L。而单纯提高高铁酸盐浓度对高铁酸盐-亚硫酸盐体系中ATZ去除率的提升很小。可以认为,在高铁酸浓度>100µmol/时,400µmol/L 的亚硫酸盐并不能完全利用体系中的高铁酸盐。提高体系中的高铁酸盐浓度所导致的ATZ 去除率的提升可能是过量高铁酸盐的造成的,其中并没有亚硫酸盐的参与,也没有SO·-4 的产生和作用。为了提高高铁酸盐-亚硫酸盐体系中高铁酸盐的利用率,进而提高目标污染物ATZ 的去除率,固定高铁酸盐与亚硫酸盐的浓度比为1∶4,改变亚硫酸盐的投加方式为1∶(1+1+1+1),即将亚硫酸盐分成与高铁酸盐浓度相等的4 份,每隔30s往体系中加一份亚硫酸盐,加完最后一次亚硫酸盐溶液后继续反应1min(总反应时间为3min),其他实验条件保持不变。实验结果如图8 所示,在100µmol/L、200µmol/L、400µmol/L 三种高铁酸盐浓度下,改变亚硫酸盐的投加方式都不同程度的提高了ATZ 的去除率。100µmol/L 的高铁酸盐下,改变亚硫酸盐的投加方式后,ATZ的去除率从37%提升至41%;200µmol/L 的高铁酸盐,改变亚硫酸盐的投加方式后,ATZ 的去除率从34%提升至57%;400µmol/L 的高铁酸盐,改变亚硫酸盐的投加方式后,ATZ的去除率从29%提升至64%。

图8 不同亚硫酸盐投加方式对高铁酸盐-亚硫酸盐体系去除ATZ的影响
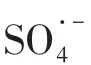
3 结论
(1)本实验系统探究了亚硫酸盐浓度、高铁酸盐浓度、ATZ 浓度、pH 以及亚硫酸盐投加方式对高铁酸盐-亚硫酸盐体系降解ATZ 的影响。在pH=7.0、高铁酸盐浓度为100µmol/L、亚硫酸盐浓度为400µmol/L 时,目标污染物ATZ 的浓度为5µmol/L的实验条件下,不到10s的时间里就可以去除95%的ATZ。
(2)通过自由基鉴别实验可知,高铁酸盐-亚硫酸盐体系中,起主要作用的是约占53%;其次是·OH,其作用约占36%
