胃饥饿素在缺血再灌注损伤介导肝纤维化中对基质金属蛋白酶/基质金属蛋白酶组织抑制因子的调控
2020-09-23屈豫花刘仁贵秦燕
屈豫花 刘仁贵 秦燕
1大理大学基础医学院病理学与病理生理学教研室(云南大理671000);2大理大学第一附属医院普外二科(云南大理671000)
肝缺血再灌注损伤(hepatic ischemia-reperfusion injury,HIRI)是肝移植、肝大部切除等肝脏外科手术的必然并发症,严重影响术后患者的肝功能恢复和预后[1-3]。当缺血时间到达阈值会导致肝纤维化,目前尚无有效的药物和治疗方案[4]。流行病学资料表明,肝纤维化评分越高,病死率也越高[5]。目前肝纤维化的机制尚不完全明确,也尚未发现逆转肝纤维化的特效药物和治疗方式[6]。因此进一步探讨肝纤维化早期启动及发生发展机制,有利于对肝纤维化进行有效的干预,提高慢性肝病患者的生存质量。
国内外最新研究提示基质金属蛋白酶(MMPs)和基质金属蛋白酶组织抑制因子(TIMPs)相互作用可以调节细胞外基质(extra cellular matrix,ECM)的降解[7]。MMPs 是一类可以降解胶原的酶系,并对ECM 的重塑起着关键的作用[8]。MMPs 在啮齿类动物肝脏组织中主要发挥作用的分型是MMP-13,可以切割天然纤维Ⅰ、Ⅱ和Ⅲ型胶原,在早期纤维化阶段,MMP-13 可以将原纤维胶原蛋白裂解为片段,逆转肝纤维化[9]。TIMPs 特异抑制MMP-13 的活性,在纤维化的进展期,大多数情况下TIMP-2 显著升高[8]。研究表明在HIRI诱导肝纤维化的形成中,MMP-13 与TIMP-2 不仅参与了早期肝纤维化的启动,还促进其后期的进一步发展[10]。
胃饥饿素(Ghrelin)是体内产生的一种肽类激素,具有多种生理作用[11-13]。近年来研究表明其对器官缺血再灌注损伤及肝纤维化具有较好的保护作用[14-16]。但Ghrelin 逆转或减轻HIRI 介导肝纤维化的作用机制尚未明确。本研究建立HIRI 介导肝纤维化的小鼠模型,探讨Ghrelin 在HIRI 介导肝纤维化中对MMP-13 与TIMP-2 的动态调控作用,为HIRI 介导肝纤维化的治疗拓展新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物C57 小鼠,雄性,SPF 级,体质量20 ~25 g,购自昆明医科大学实验动物中心(SCXK(滇)K2015-0002)。
1.1.2 药物与试剂Ghrelin 多肽(Phoenix Pharmaceuticals Inc.);Masson 三色染色试剂盒、Hyp 检测试剂盒、ALT 试剂盒(南京建成);引物合成(金斯瑞);总RNA 提取试剂盒、TIANScript cDNA 试剂盒以及SuperReal PreMix Plus(天根)。
1.2.3 主要仪器PCR 扩增仪(美国应用生物系统公司);酶标仪(奥地利安图斯公司);T6 紫外分光光度计(北京普析);正置荧光显微镜成像系统(日本OLYMPUS公司);ROBOZ血管夹(湖南远湘)。
1.2 方法
1.2.1 分组与模型制备、取材108 只C57 小鼠随机平均分为假手术组(Sham 组)、肝缺血再灌注组(H/R 组)及Ghrelin 干预组(G-H/R 组),每组分0、3、6、72 h 及7、15 d 共6 个时间点。Sham 组沿腹白线于剑突下开口1 cm 左右,骚扰肝蒂部,90 min 后关腹。H/R 组手术开口同Sham 组,用血管夹夹闭肝门静脉、入肝左叶和中叶的肝动脉90 min,打开血管夹后关腹。Ghrelin 组分别在血管夹夹闭之前15 min 和打开血管夹之前20 min 给与小鼠尾静脉注射Ghrelin 溶液(25 μg/kg),余手术方式与H/R 组相同,每24 h 给术后小鼠尾静脉注射Ghrelin 溶液(50 μg/kg)。取材时,达到各组模型相对应时间点给与心脏采血处死的方式,肝左叶置于4%多聚甲醛,肝中叶及肝左外侧叶立即置于液氮冻存。
1.2.2 指标检测采用比色法检测血浆中ALT 水平,按说明书操作,绘制标准曲线,得出OD值,计算出ALT 酶活性。制备10%的肝组织匀浆,按说明书操作,用紫外分光光度计检测OD值,依公式计算出Hyp 含量。
1.2.3 肝组织苏木精-伊红(HE)染色4%多聚甲醛固定肝左叶,梯度组织脱水,透明,浸蜡后包埋为蜡块。切片后置于60 ℃烘箱40 min 左右,切片梯度脱蜡。苏木精5 min,盐酸酒精30 s,氨水5 s,伊红5 min,梯度脱水,透明,封片。
1.2.4 肝组织Masson 染色染色前同HE 染色前处理,脱蜡后苏木素8 min,酸性乙醇10 s,水洗。Masson 蓝化液5 min,水洗。丽春红品红8 min,弱酸工作液1 min,磷钼酸2 min,弱酸工作液1 min。苯胺蓝2 min,弱酸工作液1 min。梯度脱水,透明,封片。
光学显微镜观察,按照第十次全国病毒性肝炎及肝病学术会议中《病毒性肝炎防治方案》中的规定对每个样本的HE 染色结果和Masson 染色结果进行肝纤维化程度分期。
1.2.5 实时荧光定量PCR 检测肝组织中α-SMA、Ⅰ型胶原、Ⅲ型胶原、MMP-13 和TIMP-2mRNA 表达水平严格按照说明书提取总RNA,检测浓度及完整性后逆转录为cDNA。以cDNA 为模板进行荧光定量检测扩增值。94 ℃变性5 min,退火温度分别为:54 ℃、57 ℃、60 ℃、57 ℃和60 ℃、内参60 ℃,时间1 min,延伸温度72 ℃,3 min。40个循环。各个引物序列由Primer Premier5软件设计,见表1。

表1 引物序列Tab.1 Primer sequence
1.3 统计学方法应用SPSS 20.0 软件进行统计分析。计量资料用(±s)表示,采用完全随机设计两独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠血浆ALT 含量的变化与Sham 组相比,H/R 组血浆ALT 水平明显升高,差异有统计学意义(P<0.05);G-H/R 组与H/R 组相比,血浆ALT 水平均降低明显,差异有统计学意义(P<0.05)。见表2。
2.2 各组小鼠肝组织Hyp 含量的变化H/R 组肝组织中Hyp 的含量随着再灌注时间的延长逐渐升高,与Sham 组比较差异有统计学意义(P<0.05)。与H/R 组相比,G-H/R 各组Hyp 含量下降,72 h 之后差异有统计学意义(P<0.05)。见表2。
表2 小鼠血浆ALT 水平、肝组织Hyp 的含量Tab.2 Plasma ALT level of mice,expression level of Hyp in mouse liver ±s

表2 小鼠血浆ALT 水平、肝组织Hyp 的含量Tab.2 Plasma ALT level of mice,expression level of Hyp in mouse liver ±s
注:H/R 组与Sham 组相比较,*P <0.05;G-H/R 组与H/R 组相比较,**P <0.05
时间ALT(U/L)Sham 组H/R 组G-H/R 组Hyp(μg/g)Sham 组H/R 组G-H/R 组0 h 3 h 6 h 72 h 7 d 15 d 14.85±3.45 16.03±2.82 16.81±1.80 19.87±2.15 18.54±1.35 17.84±1.07 102.95±15.83*174.76±12.88*171.43±13.64*22.52±2.22 26.25±2.54*26.33±2.25*56.29±12.95**65.12±10.68**75.87±11.57**17.81±1.77**19.15±2.08**16.83±2.24**132.77±8.13 133.42±9.03 129.71±5.85 136.52±12.83 136.00±12.01 129.84±10.95 159.18±23.39*153.59±24.45 157.53±16.94*222.95±15.57*260.91±8.92*244.82±21.45*141.93±16.96 146.35±14.35 135.89±13.69 133.03±13.71**139.94±9.32**145.64±7.18**
2.3 各组小鼠肝组织中α-SMA mRNA 表达水平RT-PCR 结果显示:H/R 组α-SMA mRNA 表达水平与Sham 组相比明显增加(P<0.05)。而G-H/R 组与H/R 组相比,α-SMA mRNA 表达水平显著下降(P<0.05)。见表3。
2.4 各组小鼠肝组织中Ⅰ、Ⅲ型胶原mRNA 表达水平H/R 组Ⅰ、Ⅲ型胶原mRNA 表达水平与Sham 组相比明显增加(P<0.05)。与H/R 组相比,G-H/R 各组Ⅰ、Ⅲ型胶原的mRNA 表达水平显著下降(P<0.05)。见表4。
2.5 肝组织病理形态学变化H/R 组小鼠肝脏在0、3、6 h 出现不同程度的肝细胞气球样变性、脂肪变性、细胞核碎裂,72 h 出现细胞坏死、核溶解的现象,7、15 d 出现不同程度肝小叶间隔增宽、中央静脉退化、肝窦毛细血管化等现象(图1)。Masson染色结果显示H/R 组肝组织与Sham 组相比7、15 d胶原纤维明显扩大(图2)。而G-H/R 组与相应时间点H/R 组比较,HE、Masson 染色的病理观察结果均有所改善,趋向于Sham 组形态(图1、2)。根据病理学观察(图1、2),对各组小鼠的纤维化程度进行分期,见表5。
表3 α-SMA mRNA 表达水平Tab.3 mRNA expression level of α-SMA±s

表3 α-SMA mRNA 表达水平Tab.3 mRNA expression level of α-SMA±s
注:H/R 组与Sham 组相比较,*P <0.05;G-H/R 组与H/R 组相比较,**P <0.05
α-SMA 0 h 3 h 6 h 72 h 7 d 15 d Sham 组0.98±0.08 1.01±0.16 0.99±0.14 1.03±0.23 1.00±0.18 1.02±0.15 H/R 组1.96±0.18*2.16±0.24*2.19±0.42*6.98±0.66*10.43±0.91*15.08±1.21*G-H/R 组0.81±0.07**0.83±0.09**0.67±0.06**0.63±0.07**0.65±0.09**0.70±0.08**
2.6 各组小鼠肝组织中MMP-13、TIMP-2 mRNA 表达水平与Sham 组相比,H/R 组MMP-13 的mRNA 表达水平在H/R 0、3 h 增加,随后其表达水平逐渐下降,于7、15 d 降低至一个较低的水平(P<0.05),TIMP-2 mRNA 表达水平均明显增加(P<0.05),MMP-13/TIMP-2 mRNA 比值在H/R 0、3 h 显著升高(P<0.05),随后逐渐下降,于7 d 及15 d 显著降低(P<0.05)。与H/R 组相比,G-H/R 0、3、6、72 h 组MMP-13 mRNA 表达水平降低,7、15 d 组则升高(P<0.05),TIMP-2 mRNA 表达水平均显著下降(P<0.05),MMP-13/TIMP-2 mRNA 比值在G-H/R 0、3、6、72 h 组降低,而G-H/R 7、15 d 组则升高(P<0.05)。见表6。
表4 Ⅰ、Ⅲ型胶原mRNA 表达水平Tab.4 mRNA expression level of Col-I,Col-Ⅲ ±s

表4 Ⅰ、Ⅲ型胶原mRNA 表达水平Tab.4 mRNA expression level of Col-I,Col-Ⅲ ±s
注:H/R 组与Sham 组相比较,*P <0.05;G-H/R 组与H/R 组相比较,**P <0.05
时间Collagen ⅠSham 组H/R 组G-H/R 组Collagen ⅢSham 组H/R 组G-H/R 组0 h 3 h 6 h 72 h 7 d 15 d 1.02±0.12 1.03±0.08 0.97±0.18 0.95±0.16 0.90±0.18 0.98±0.16 1.30±0.19*1.30±0.27*2.11±0.39*2.32±0.28*4.00±0.31*5.48±0.68*0.90±0.11**0.96±0.18**1.00±0.18**0.10±0.17**0.97±0.18**1.12±0.19**1.01±0.17 0.97±0.26 1.00±0.22 0.98±0.19 1.11±0.17 1.02±0.24 1.63±0.32*2.14±0.25*2.53±0.56*3.71±0.80*5.00±0.51*5.28±0.28*0.88±0.25**1.30±0.31**1.12±0.42**1.17±0.15**1.12±0.22**1.02±0.17**
3 讨论
肝纤维化是各种慢性刺激(包括病毒感染、中毒、代谢、自身免疫性等)作用于肝脏引起的一种可逆性肝损伤[17-18]。肝纤维化中异常沉积的ECM主要来源于活化的肝星状细胞(hepatic stellate cell,HSC)。HSC 活化后,转变为具有分泌α-SMA能力的成纤维细胞,可以分泌大量Ⅰ、Ⅲ型胶原,以及MMPs 与TIMPs。导致ECM 中的微环境发生紊乱,在这个过程中MMPs/TIMPs 的比值下降会导致ECM 沉积的量大于降解的量,形成肝纤维化[19]。目前尚无有效的逆转肝纤维化的治疗方案,因此研究靶向MMPs/TIMPs 的调控可以为逆转肝纤维化提供理论基础。Ghrelin 作为一种新的内源性脑肠肽,研究表明Ghrelin 在肝损伤中可以减缓肝纤维化进程[20]。然而Ghrelin 在HIRI 诱导肝纤维化中的研究较少,本实验探讨Ghrelin 在HIRI诱导肝纤维化发生发展过程中对MMPs/TIMPs 的调控作用。
本实验结果表明在HIRI 介导肝纤维化的过程中,损伤后0、3、6 h 肝细胞变性、坏死,HSC 活化,分泌大量的胶原成分,同时,由于肝脏对损伤产生的自然修复反应,使肝脏分泌MMP-13 的能力增强,打破了MMP-13/TIMP-2 的平衡。在缺血再灌注后的15 d,肝细胞显著减少,HSC 持续活化,构成ECM 的胶原成分持续增多,同时MMP-13/TIMP-2 的比值下降,ECM 中的胶原在肝实质中沉积,形成了肝纤维化。而Ghrelin 干预后,发挥稳定肝细胞膜的作用,对肝细胞具有保护作用,抑制受损肝脏中活化的HSC,减少胶原生成,同时影响肝组织MMP-13 的分泌,MMP-13/TIMP-2 的比值在后期上升,使ECM 降解大于合成,逆转了HIRI 介导的肝纤维化。然而Ghrelin 发挥抑制HSC 的机制以及Ghrelin 调控MMP-13/TIMP-2 逆转肝纤维化的最佳时间点在本研究中尚不具体,需要进一步探究完善。
综上所述,Ghrelin 在HIRI 介导的肝纤维化早期及进展期对MMP-13/TIMP-2 均有调控作用,使MMP-13 的分泌发生动态变化,持续下调TIMP-2 的分泌,在新的水平调控MMP-13/TIMP-2 二者的关系,进而使ECM 的合成小于降解,抑制肝纤维化的发生和进一步发展,为临床上减缓肝纤维化发展进程提供新的治疗思路。

图1 小鼠肝组织HE 染色(×400)Fig.1 HE staining of mouse liver(×400)
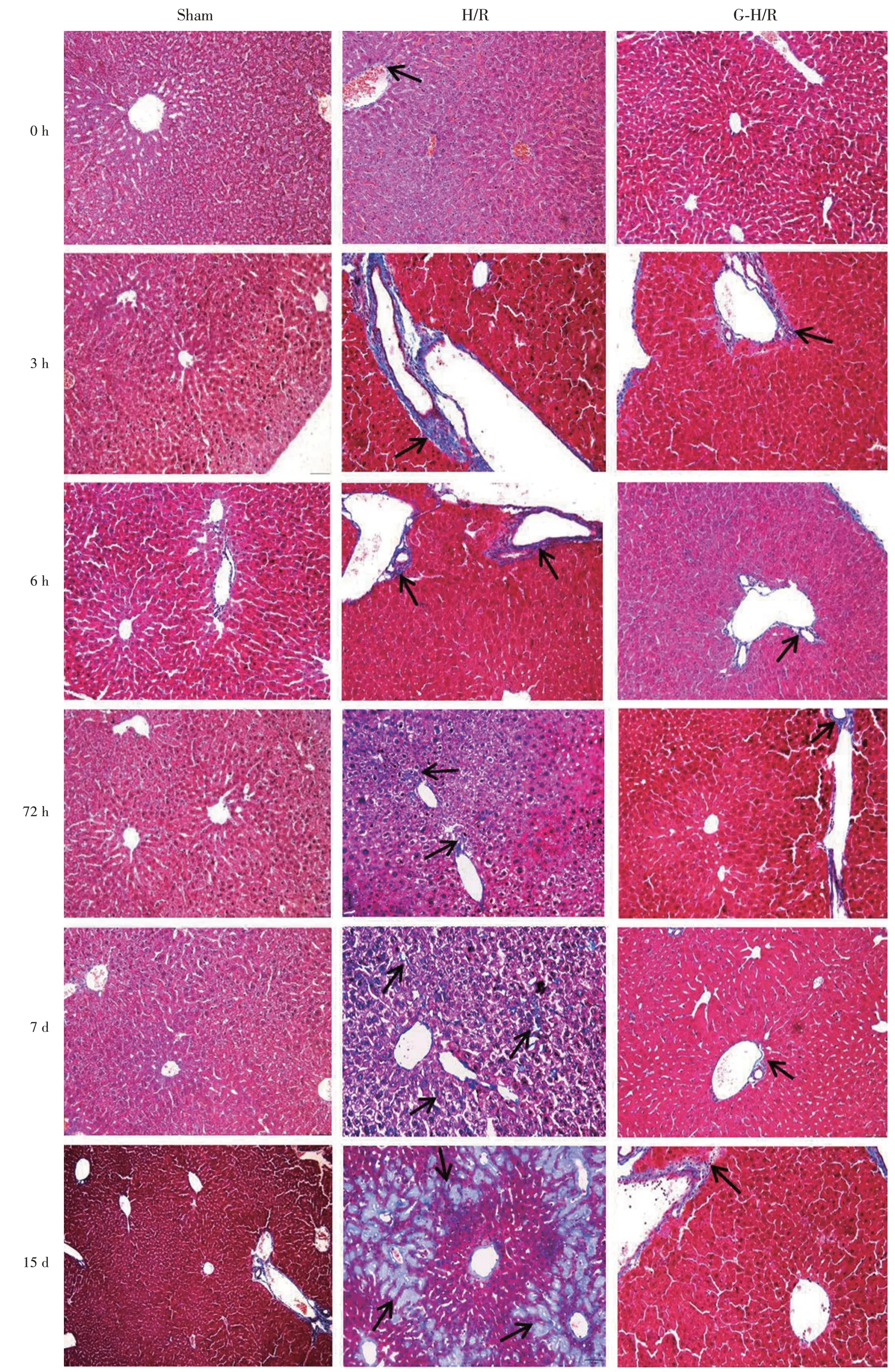
图2 小鼠肝组织Masson 染色(×200)Fig.2 Masson staining of mouse liver(×200)

表5 各组肝纤维化程度分级Tab.5 Grade of liver fibrosis in each group
表6 MMP-13、TIMP-2 mRNA 表达水平Tab.6 mRNA expression level of MMP-13,TIMP-2±s
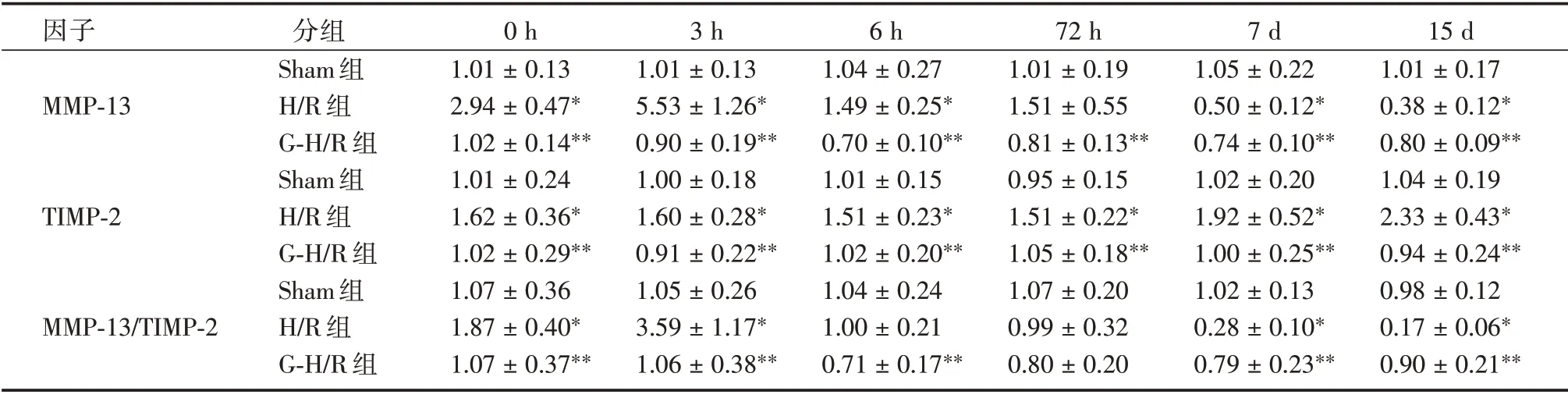
表6 MMP-13、TIMP-2 mRNA 表达水平Tab.6 mRNA expression level of MMP-13,TIMP-2±s
注:H/R 组与Sham 组相比较,*P <0.05;G-H/R 组与H/R 组相比较,**P <0.05
因子MMP-13 TIMP-2 MMP-13/TIMP-2分组Sham 组H/R 组G-H/R 组Sham 组H/R 组G-H/R 组Sham 组H/R 组G-H/R 组0 h 1.01±0.13 2.94±0.47*1.02±0.14**1.01±0.24 1.62±0.36*1.02±0.29**1.07±0.36 1.87±0.40*1.07±0.37**3 h 1.01±0.13 5.53±1.26*0.90±0.19**1.00±0.18 1.60±0.28*0.91±0.22**1.05±0.26 3.59±1.17*1.06±0.38**6 h 1.04±0.27 1.49±0.25*0.70±0.10**1.01±0.15 1.51±0.23*1.02±0.20**1.04±0.24 1.00±0.21 0.71±0.17**72 h 1.01±0.19 1.51±0.55 0.81±0.13**0.95±0.15 1.51±0.22*1.05±0.18**1.07±0.20 0.99±0.32 0.80±0.20 7 d 1.05±0.22 0.50±0.12*0.74±0.10**1.02±0.20 1.92±0.52*1.00±0.25**1.02±0.13 0.28±0.10*0.79±0.23**15 d 1.01±0.17 0.38±0.12*0.80±0.09**1.04±0.19 2.33±0.43*0.94±0.24**0.98±0.12 0.17±0.06*0.90±0.21**
