Ⅰ A 期肺腺癌气道播散临床病理因素分析
2020-09-23王喆歆
陈 亮,王喆歆,姚 烽
上海交通大学附属胸科医院胸外科,上海 200030
肺癌是全球常见的恶性肿瘤之一。据国际癌症研究机构(international agency for research on cancer,IARC)统计数据[1]显示,2018 年全球癌症发病人数中肺癌占比11.6%,死亡人数中占比18.4%,同时其也是两性发病率及死亡率最高的恶性肿瘤。根据病理组织学的不同,肺癌被分为非小细胞肺癌及小细胞肺癌2 类;其中,肺腺癌是最为常见且发病较多的非小细胞肺癌。按照2015 年世界卫生组织(WHO)有关肺腺癌的分类标准,其被分为原位腺癌(adenocarcinomain situ,AIS)、微浸润腺癌(minimally invasive adenocarcinoma,MIA) 以 及 浸润性腺癌。其中,浸润性腺癌又可分为以下亚型:伏壁样腺癌、腺泡样腺癌、乳头状腺癌、微乳头状腺癌、实体性腺癌[2]。随着低剂量螺旋计算机断层扫描(low-dose computed tomography,LDCT)在肺癌筛查中的普及,早期肺癌的检出率得到了一定的提升[3]。针对早期肺癌,首选的治疗方式是手术切除肿瘤病灶[4]。而目前,病理类型、肿瘤大小及淋巴结是否转移是被公认的肺癌预后影响因素。近年来,除淋巴结转移外,肺癌气道播散(spread through air spaces,STAS)被认为是影响预后的又一危险因素[5-7]。2015 年,WHO 将STAS 定义为腺癌的一种新的侵袭方式,即以病理性的微乳头状细胞簇、肿瘤边缘以外的实巢或单个细胞的形式进入肿瘤周围的肺实质空隙中,实现与主要肿瘤组织的分离。研究[8]显示,STAS 被认为可能是肺腺癌的一种新的浸润方式,影响患者术后的复发率及生存率。目前,关于早期肺腺癌STAS 的研究相对较少。基于此,本研究着重对Ⅰ A 期肺腺癌(早期肺腺癌中的主要形式)的临床及病理结果进行分析,探究其发生STAS 的危险因素。
1 对象与方法
1.1 研究对象
回顾性分析2018 年1 月—2019 年10 月于上海交通大学附属胸科医院接受肺部手术的患者资料。
入组标准:①病理诊断明确为肺腺癌。②根据国际肺癌研究协会(International Association for the Study of Lung Cancer,IASLC)第八版TNM 分期,明确术后病理为ⅠA 期。排除标准:①临床资料不全。②同侧肺叶多发浸润性腺癌。③主要腺癌亚型有2 种及2 种以上。
本研究已通过上海交通大学附属胸科医院伦理委员会审批[审批号:KS(Y)1960]。患者已签署使用其临床资料用于本研究的知情同意书。
1.2 临床及病理资料收集
收集患者的临床资料包括性别、年龄、肿瘤位置、手术方式、术后淋巴结切除程度,以及病理资料包括肿瘤大小、肺腺癌亚型、是否脉管浸润等。依据2015 年WHO肺癌分类标准,由2 位专业的病理科医师对患者术后的病理资料进行诊断、记录,并将肺腺癌中比例最高的亚型定义为主要亚型[2]。依据2015 年WHO 的STAS 定义,对患者发生STAS 的镜下手术切除标本进行诊断[5]。
1.3 统计学分析
采用SPSS 22.0 软件对研究数据进行统计分析。定量资料以x—±s表示,采用t检验或Wilcoxon 秩和检验进行分析。定性资料以频数和百分率表示,采用χ2检验或Fisher 确切概率法进行分析。采用二分类Logistic 回归模型进行多因素分析。P<0.05 表示差异具有统计学意义。
2 结果
本研究共计纳入Ⅰ A 期肺腺癌患者1 365 例,其中男性594 例、女性771 例,平均年龄(60.2±10.1)岁。根据术后病理结果即是否存在STAS,将患者分为有STAS组(53 例)和无STAS 组(1 312 例)。通过对患者的临床资料统计分析,结果(表1)显示2 组患者仅在性别上的差异具有统计学意义(P=0.000)。对患者的病理资料进行分析,结果(表2)显示2 组患者仅在肺腺癌主要亚型上差异具有统计学意义(P=0.000)。
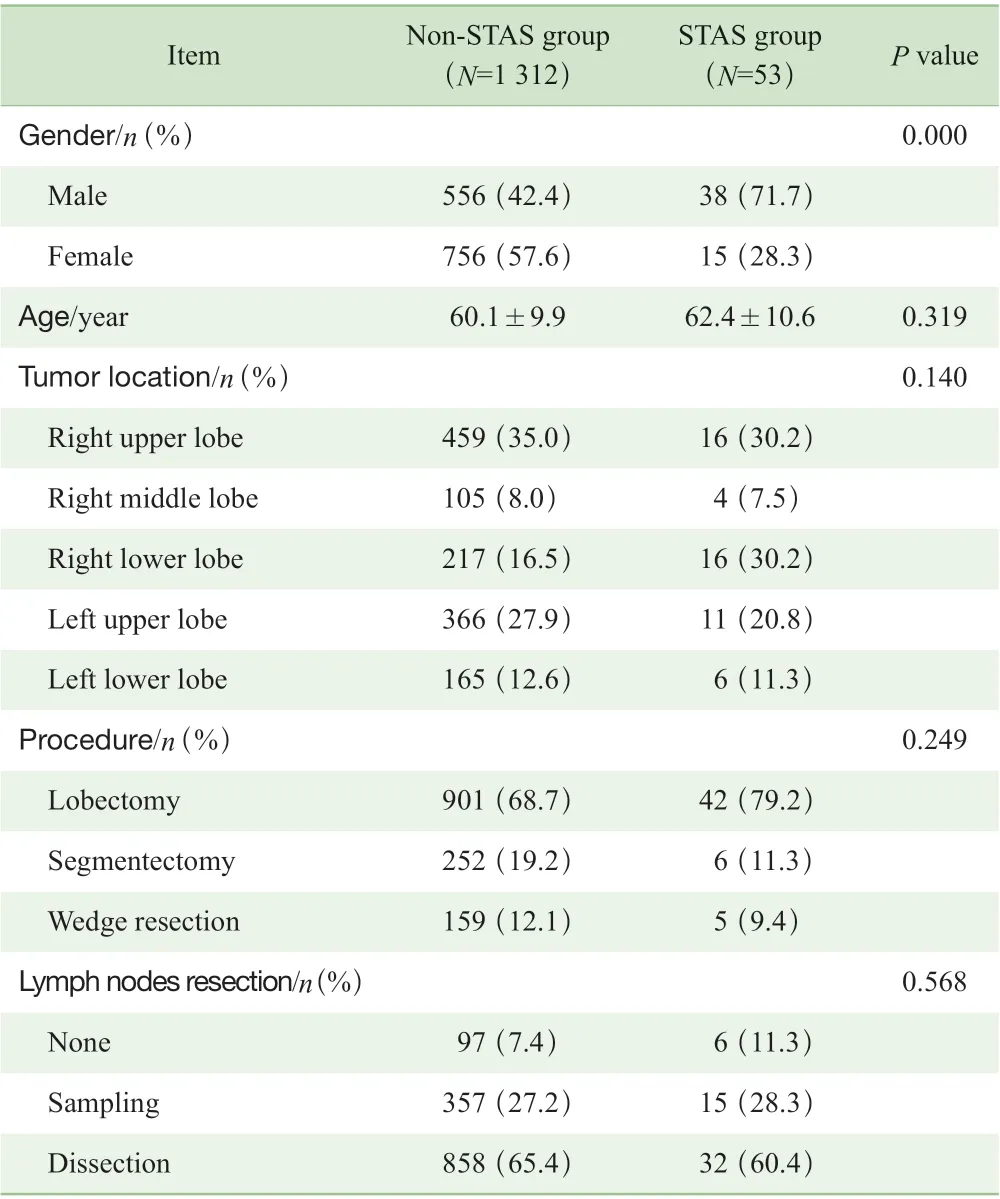
表1 2 组肺腺癌患者的临床资料比较Tab 1 Comparison of clinical data between the two groups of patients with lung adenocarcinoma

表2 2 组肺腺癌患者的病理资料比较Tab 2 Comparison of pathological data between the two groups of patients with lung adenocarcinoma
将性别、肿瘤位置、肿瘤大小、T 分期、肺腺癌主要亚型及是否存在脉管浸润纳入二分类Logistic 回归模型进行多因素分析,结果(表3)显示性别、肺腺癌主要亚型均与STAS 的发生相关。
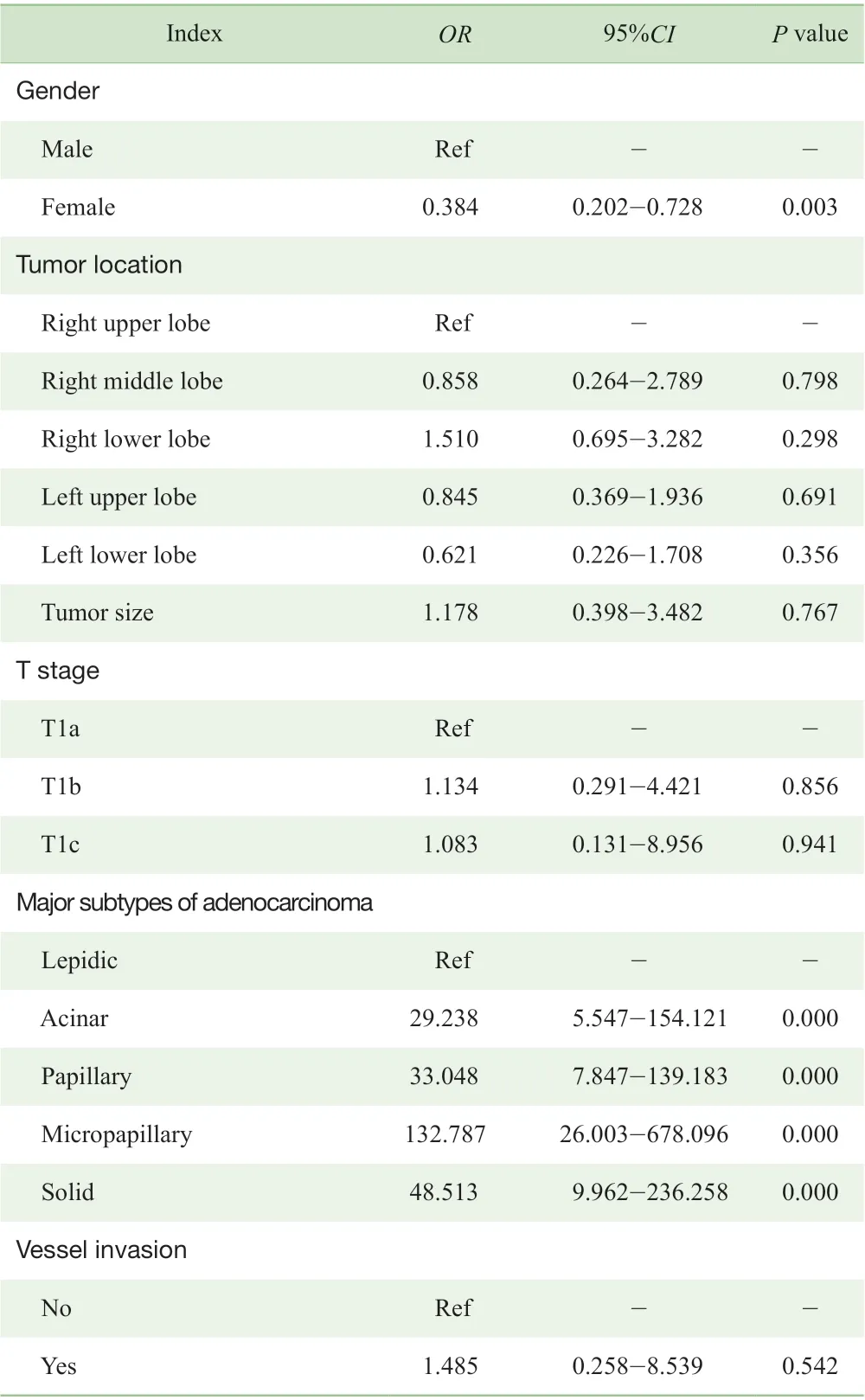
表3 肺腺癌患者STAS 发生的多因素分析Tab 3 Multivariate analysis of STAS in patients with lung adenocarcinoma
随后,进一步分析肺腺癌包含的亚型比例的不同对STAS 发生的影响,各种肺腺癌亚型的受试者工作特征 曲线(receiver operator characteristic curve,ROC curve,ROC 曲线)见图1。以伏壁型为主的肺腺癌的ROC 曲线 下 面 积(area under curve,AUC) 为0.148(95%CI0.116 ~0.179,P=0.000),腺泡型为主的AUC 为0.376(95%CI0.295 ~0.457,P=0.002),乳头型为主的AUC为0.661(95%CI0.589 ~0.733,P=0.000),微乳头型为主 的AUC 为0.884(95%CI0.830 ~0.938,P=0.000),实 体 型 为 主 的AUC 为0.624(95%CI0.537 ~0.712,P=0.045)。由此可见,微乳头型腺癌的ROC 曲线的可信度较高,根据微乳头型比例计算出其截断值为0.744。

图1 肺腺癌不同亚型比例与STAS 发生的ROC 曲线Fig 1 ROC curve between the proportion of different subtypes of lung adenocarcinoma and the occurrence of STAS
3 讨论
在全球肿瘤发病率及其相关死亡率排名中,肺癌位居首位。随着影像学技术在肺癌筛查中的不断推广及应用,早期肺癌检出率及治愈率得到了有效提升。NCCN 指南(National Comprehensive Cancer Network Guidelines)[9]推荐,早期肺癌行手术治疗可达到较好的治愈效果。然而在临床上发现,即使早期肺癌患者在满足了切缘足够安全的情况下施行手术,其仍会发生复发或病灶转移。因此,病理结果成为了影响预后的关键因素之一[10-13]。同时,亦有文献[5-7]报道STAS 可能是预后的另一危险因素。
既往研究[14]指出STAS 是肺癌复发的危险因素之一,且有研究[5,15-16]报道STAS 与患者性别、肺腺癌亚型(微乳头型及实体型)均相关。Toyokawa 等[17]对276 例Ⅰ期肺腺癌患者的临床信息及术后病理类型进行分析,结果发现STAS 的发生与肿瘤大小、更高的实性成分/肿瘤大小比 值、高SUVmax 值(maximum standard uptake value)、组织学外侵类型、胸膜侵犯均相关。Lee 等[18]回顾性分析了316 例肺腺癌患者发现,肿瘤缺少伏壁型亚型或存在微乳头型亚型与STAS 的发生显著相关。Hu 等[19]回顾性收集500 例不同病理分期的肺腺癌患者并对其进行多因素分析,结果显示STAS 的发生与更高的T 分期及N 分期、更差的肿瘤分化显著相关。目前有关STAS 的研究相对较少,且多集中在不同病理分期的肺腺癌STAS 方面,因此关于早期肺腺癌发生STAS 的研究则更为稀少。
本研究回顾性收集上海交通大学附属胸科医院1 365例术后病理为ⅠA 期肺腺癌患者,就该腺癌发生STAS 的危险因素进行分析。经单因素发现,ⅠA 期肺腺癌的肿瘤T 分期与STAS 发生无显著相关性,即T1a、T1b、T1c肿瘤的增长并不会增加STAS 的发生风险,而患者的性别、肺腺癌主要亚型与STAS 的发生均存在相关性;而后,经二分类Logistic 回归分析提示,男性及非伏壁型为主的腺癌均是STAS 发生的危险因素。同时,本研究还进一步针对肺腺癌所含不同亚型的比例与STAS 的发生进行ROC 曲线分析,结果显示以微乳头型亚型比例评估STAS 发生的可行性较高(AUC=0.884),截断值为0.744,即当微乳头型亚型比例高于75%时,STAS 的发生率则较高。此外,有文献[5]报道吸烟患者STAS 的发生率高于非吸烟患者,而吸烟患者以男性居多,因此该结论可能是本研究中男性患者STAS 发生率高于女性的 原因。
本研究尚存在一定的局限性:①为回顾性研究且纳入的临床信息类别较少,所获研究结果可能存在一定的偏倚,后续将进一步纳入患者的吸烟史、合并症、自结节发现至手术的随访时间等临床信息。②未研究STAS 的发生是否影响ⅠA 期肺癌患者术后复发或生存。未来或将对相关肿瘤学预后进行随访研究。
综上所述,本研究针对ⅠA 期肺腺癌患者发生STAS的临床及病理因素进行分析,结果显示肿瘤T 分期与ⅠA期肺腺癌发生STAS 无显著相关性,而肺腺癌亚型尤其是微乳头型与STAS 的发生显著相关。因此,在针对ⅠA 期肺腺癌尤其是包含微乳头型的治疗过程中,临床医师需关注STAS 的发生。
参·考·文·献
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[2] van Schil PE, Sihoe ADL, Travis WD. Pathologic classification of adenocarcinoma of lung[J]. J Surg Oncol, 2013, 108(5): 320-326.
[3] The National Lung Screening Trial Research Team. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409.
[4] Monirul Islam KM, Shostrom V, Kessinger A, et al. Outcomes following surgical treatment compared to radiation for stage Ⅰ NSCLC: a SEER database analysis[J]. Lung Cancer, 2013, 82(1): 90-94.
[5] Kadota K, Nitadori JI, Sima CS, et al. Tumor spread through air spaces is an important pattern of invasion and impacts the frequency and location of recurrences after limited resection for small stage Ⅰ lung adenocarcinomas[J]. J Thorac Oncol, 2015, 10(5): 806-814.
[6] Eguchi T, Kameda K, Lu SH, et al. Lobectomy is associated with better outcomes than sublobar resection in spread through air spaces (STAS)-positive T1 lung adenocarcinoma: a propensity score-matched analysis[J]. J Thorac Oncol, 2019, 14(1): 87-98.
[7] Bains S, Eguchi T, Warth A, et al. Procedure-specific risk prediction for recurrence in patients undergoing lobectomy or sublobar resection for small ( ≤2 cm) lung adenocarcinoma: an international cohort analysis[J]. J Thorac Oncol, 2019, 14(1): 72-86.
[8] Travis WD, Brambilla E, Nicholson AG, et al. The 2015 world health organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243-1260.
[9] Ginsberg RJ, Rubinstein LV. Randomized trial of lobectomyversuslimited resection for T1 N0 non-small cell lung cancer[J]. Ann Thorac Surg, 1995, 60(3): 615-623.
[10] Kim D, Kim HK, Kim S, et al. Prognostic significance of histologic classification and tumor disappearance rate by computed tomography in lung cancer[J]. J Thorac Dis, 2018, 10(1): 388-397.
[11] Qian FF, Yang WJ, Wang R, et al. Prognostic significance and adjuvant chemotherapy survival benefits of a solid or micropapillary pattern in patients with resected stage Ⅰ B lung adenocarcinoma[J]. J Thorac Cardiovasc Surg, 2018, 155(3): 1227-1235. E2.
[12] van Schil PE, Asamura H, Rusch VW, et al. Surgical implications of the new IASLC/ATS/ERS adenocarcinoma classification[J]. Eur Respir J, 2012, 39(2): 478-486.
[13] Zhang J, Wu J, Tan Q, et al. Why do pathological stage Ⅰ A lung adenocarcinomas vary from prognosis? A clinicopathologic study of 176 patients with pathological stage Ⅰ A lung adenocarcinoma based on the IASLC/ATS/ERS classification[J]. J Thorac Oncol, 2013, 8(9): 1196-1202.
[14] Shiono S, Endo M, Suzuki K, et al. Spread through air spaces is a prognostic factor in sublobar resection of non-small cell lung cancer[J]. Ann Thorac Surg, 2018, 106(2): 354-360.
[15] Shiono S, Yanagawa N. Spread through air spaces is a predictive factor of recurrence and a prognostic factor in stage Ⅰ lung adenocarcinoma[J]. Interact CardioVasc Thorac Surg, 2016, 23(4): 567-572.
[16] Masai K, Sakurai H, Sukeda A, et al. Prognostic impact of margin distance and tumor spread through air spaces in limited resection for primary lung cancer[J]. J Thorac Oncol, 2017, 12(12): 1788-1797.
[17] Toyokawa G, Yamada Y, Tagawa T, et al. Significance of spread through air spaces in resected pathological stage Ⅰ lung adenocarcinoma[J]. Ann Thorac Surg, 2018, 105(6): 1655-1663.
[18] Lee JS, Kim EK, Kim M, et al. Genetic and clinicopathologic characteristics of lung adenocarcinoma with tumor spread through air spaces[J]. Lung Cancer, 2018, 123: 121-126.
[19] Hu SY, Hsieh MS, Hsu HH, et al. Correlation of tumor spread through air spaces and clinicopathological characteristics in surgically resected lung adenocarcinomas[J]. Lung Cancer, 2018, 126: 189-193.
