定量血流分数指导冠状动脉外科血运重建的研究
2020-09-23朱云鹏朱嘉希陈安清叶晓峰涂圣贤
朱云鹏,朱嘉希,张 嵬,陈安清,王 哲,刘 俊,周 密,叶晓峰,涂圣贤,赵 强#
1. 上海交通大学医学院附属瑞金医院心血管外科,上海 200025;2. 复旦大学公共卫生学院生物统计学教研室,上海 200032;3. 上海交通大学生物医学工程学院Med-X 研究院,上海 200240
冠状动脉粥样硬化性心脏病(冠心病)是当今欧美国家死亡原因占比最高的疾病。国家心血管病中心发布的《2018 年中国心血管病报告》指出,我国冠心病现患人数约1 100 万,死亡率为城市113.5/10 万,农村118.7/10万,居死亡原因占比的第二位(仅次于脑血管病)[1]。此外,冠心病常合并于其他结构性心脏病出现。《2017 欧洲心血管协会/欧洲心胸外科协会瓣膜病管理指南》[2]指出,40%的瓣膜性心脏病患者合并有冠心病。既往指南指出,结构性心脏病一旦需要手术干预治疗,其合并的冠状动脉病变往往需要术中同期处理,行冠状动脉旁路移 植 术(coronary artery bypass grafting,CABG),以 保证手术的整体围术期安全性和远期疗效[2-3]。但是,这一经典认知多是基于回顾性研究或专家经验,循证证据等级低(C 级证据),且这些合并的冠状动脉病变程度评估均为单纯的解剖学评价,即采用冠状动脉造影(coronary angiography,CAG)目测法来评价冠状动脉的狭窄程度。
近年来,随着心肌血流储备分数(fractional flow reserve,FFR)概念的提出和引入,对冠状动脉病变的评估已从单纯解剖学狭窄评价逐渐转向针对心肌灌注改变的生理学、功能学评价[4-6]。在冠状动脉介入治疗领域,FFR 已被视为有创评估狭窄病变是否存在生理性缺血的金标准,其指导的冠状动脉介入治疗有效改善了患者预后并降低了医疗成本[7]。显而易见,FFR 在CABG 外科血运重建领域的应用必然令人期待。欧美专家近年来在该领域有了一些新的探索[8-11],显示出初步的价值,然而国内尚未见相关报道。目前,有国内学者提出一种基于三维定量冠状动脉造影计算FFR 的新方法,即定量血流分数(quantitative flow ratio,QFR)技术,经过多项临床验证[12-14]显示出该技术具有精确、无创、便捷、低成本等优点,得到了国内外相关注册部门的批准后应用于临床。
上海交通大学医学院附属瑞金医院心血管外科自2017年起,在国际上首次建立并应用QFR 技术指导心脏外科手术中冠状动脉血运重建策略,随后进行了一系列的探索性临床实践,并应用于拟行各类心脏外科手术的患者。本研究回顾总结相关患者的基线资料、手术数据及初步临床结果,以探索QFR 指导外科血运重建的可行性与安全性。
1 对象与方法
1.1 研究对象
纳入2018 年1 月—2019 年6 月于上海交通大学医学院附属瑞金医院心血管外科行各类择期心脏外科手术的患者,术前CAG 提示存在冠状动脉中度以上狭窄病变(目测直径狭窄≥50%),并根据造影数据资料进一步完成QFR 分析。研究获上海交通大学医学院附属瑞金医院伦理委员会审批。
病例筛选流程见图1,由临床医师根据临床需要提出分析请求,上传造影数据至上海交通大学-博动医学影像联合实验室进行分析。临床共提出124 例分析要求,其中82 例成功完成分析。

图1 择期心脏外科手术患者筛选流程图Fig 1 Flow chart of selected cardiac surgery patients
1.2 CAG 和QFR 分析方法
1.2.1 CAG 采用Jenkins 法对患者进行CAG 检查。冠状动脉血管狭窄解剖学评价采用目测法,记录该血管段狭窄最严重处的程度。为保证QFR 的分析质量,目标CAG 体位的推荐见表1。
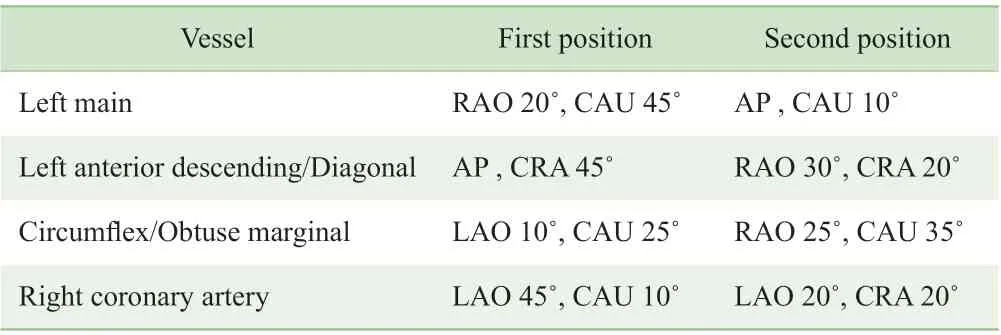
表1 目标CAG 体位推荐表Tab 1 Optimal projection position for coronary angiography
1.2.2 QFR 分析 QFR 计算在上海交通大学-博动医学影像联合实验室进行,使用博动医学影像科技(上海)有限公司自主研发的定量血流分数测量AngioPlus 系统,实现快速血管三维重建与QFR 计算。该系统用于测量目标血管的尺寸与狭窄程度,计算出目标血管每个位置处的QFR 数值。本研究以潜在CABG 靶点处的血管QFR 值为最终分析结果。
参照目前学界通用的经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)标准和国外学界对CABG 的同类研究结果[7-11],沿用QFR 值0.8 为临床决策的界值。QFR ≤0.8 判断为阳性,提示存在冠状动脉病变导致的心肌缺血;QFR>0.8 判断为阴性,提示不存在冠状动脉病变导致的心肌缺血。
1.3 手术决策
以QFR 值为依据判断是否同期行CABG。QFR 为阳性,建议对靶血管进行CABG 血运重建;QFR 为阴性,则不建议进行CABG 血运重建。最终由外科医师根据QFR的分析结果,综合考虑患者基线特征、手术复杂程度和风险来制定手术方案。
1.4 观察终点
本研究观察终点主要包括术后30 d 内出现全因死亡、心肌梗死、脑卒中、非计划冠状动脉血运重建和新发肾功能衰竭需要血液透析。
1.5 统计学分析
采用统计软件SPSS 23.0 进行描述性统计分析。定量资料采用±s表示,定性资料用n(%)表示。
2 结果
2.1 患者基本资料
82 例 患 者 年 龄 范 围 为41 ~82 岁, 平 均 年 龄(65.0±7.1)岁,其中38 例(46.3%)为女性。患者共计有174 支冠状动脉纳入统计分析。患者基线特征见表2。

表2 接受QFR 分析的患者基线特征Tab 2 Baseline characteristics of QFR-analyzed patients
2.2 QFR 分析结果
124 例尝试进行QFR 分析的患者中42 例无法完成分析,失败的原因主要为CAG 资料不符合QFR 分析要求,包括造影体位不规范26 例,造影剂充盈不充分16 例。纳入QFR 分析的82 例患者共计174 支经造影后提示直径狭窄≥50%(目测法),病变冠状动脉均接受了QFR 分析。174 支病变冠状动脉血管中,有53 支血管(30.5%)为 阳 性(QFR ≤0.8), 其 余121 支(69.5%) 为 阴 性(QFR>0.8)。病变冠状动脉血管目测狭窄程度与QFR 值之间的关联分析见表3。直径狭窄50%~69%的病变冠状动脉血管中,6.7%为阳性;直径狭窄70%~89%的病变冠状动脉血管中,44.9%为阳性;而直径狭窄≥90%的病变冠状动脉血管中,100%为阳性。病变冠状动脉血管分布区域与对应的QFR 值见表3。可见,前降支(left anterior descending coronary artery,LAD)区域的病变冠状动脉血管中,39.5%为阳性;回旋支(left circumflex artery,LCX)区域的病变冠状动脉血管中,28.6%为阳性;而右冠状动脉(right coronary artery,RCA)区域的病变冠状动脉血管中,17.6%为阳性。本组研究的病变冠状动脉血管无左主干病变。
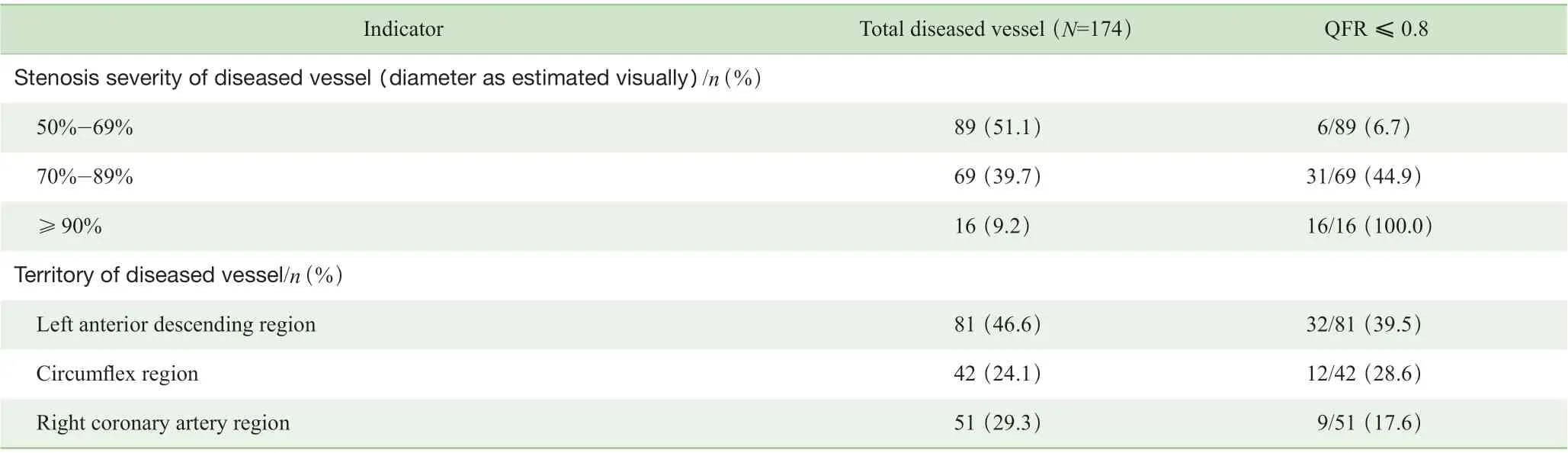
表3 病变冠状动脉血管狭窄程度、分布与QFR 值Tab 3 Severity or territory of diseased coronary artery and QFR results
2.3 手术策略结果
在53 支QFR ≤0.8 的阳性病变冠状动脉血管中,有52 支进行了CABG 血运重建,而1 支未行CABG 血运重建,与QFR 分析结果相符率98.1%;在121 支QFR>0.8的阴性病变冠状动脉血管中,有12 支进行了CABG 血运重建,而109 支未行CABG 血运重建,与QFR 分析结果相符率90.1%。82 例患者原计划均需行单纯CABG 或原发病心脏手术同期合并CABG,但血运重建策略经过QRF 指导后,39 例(47.6%)依然遵循原手术计划,43例(52.4%)改变了计划未行CABG。33 例原计划单纯CABG 的患者中,15 例(15/33,45.5%)免于手术,行药物保守治疗并出院随访。37 例涉及瓣膜病手术中, 17 例(17/37,45.9%)进行了瓣膜+CABG 复合手术,而其余20 例(20/37,54.1%)改变计划进行了单纯瓣膜手术。经过QFR 分析后术式改变情况见表4。

表4 QFR 分析对手术术式选择的影响Tab 4 Influence of QFR results on choice of surgical procedure
2.4 围术期临床结果
15 例免于手术的患者在30 d 内未见终点事件。接受手术的67 例患者中术后30 d 内全因死亡2 例(2/67,3.0%),其中1 例QFR 阳性,进行了瓣膜+CABG 复合手术,主要死因为术后脑卒中;另1 例QFR 阴性,但仍进行了瓣膜+CABG 复合手术,主要死因为术后呼吸衰竭(低氧血症)。围术期心肌梗死1 例(1.5%),QFR 阳性,进行了瓣膜+CABG 复合手术,心肌梗死未致死,康复出院。脑卒中1 例(1.5%),即前述死亡病例之一。新发肾功能衰竭行血透治疗4 例(6.0%),3 例未致死(1 例为QFR 阳性行单纯CABG,2 例为QFR 阴性行单纯瓣膜手术),另1 例最终死亡,即前述死亡病例之一。未观察到非计划再次血运重建。综上累计发生复合主要不良临床事件6 例(6/67,9.0%)。
3 讨论
冠心病日益成为我国卫生健康的最大负担之一,生活方式的改变和规范药物治疗是治疗的基石,存在心肌缺血时血运重建是有效的治疗手段。作为冠状动脉血运重建的经典方式之一,CABG 术可以改善患者远期生存和生活质量,是复杂冠状动脉病变血运重建治疗的金标准,但手术伴随着创伤和相对较高的经济负担。如何精准地识别真正存在缺血干预临床价值的冠状动脉病变,选择合适靶血管、桥血管来完成外科CABG 血运重建,在临床实践中尤其重要。
FFR 已被证实是评价冠状动脉功能性狭窄的可靠指标。经典的FFR 定义是指通过腺苷或三磷酸腺苷诱导冠状动脉最大充血状态时,计算压力导丝测得冠状动脉某狭窄远端的压力(Pd)与主动脉根部压力(Pa)的比值,其正常值均为1.0。通常认为FFR ≤0.8 提示该病变引起明显心肌缺血,具有血运重建干预意义;而FFR>0.8则提示该病变不引起明显心肌缺血,尚无需血运重建干预[7-11]。多项大型国际多中心临床研究[15-18]证实,与常规CAG 指导的PCI 相比,FFR 指导的PCI 可减少不必要的支架植入且显著改善临床预后。因此,FFR 被视为评估冠状动脉狭窄病变是否存在生理性缺血的金标准而被指南推荐(Ⅰ类)。尽管如此,用冠状动脉导管/压力导丝法测量FFR 这项有创的功能学评估技术目前在我国的临床应用尚未普及(使用比例<1%)。该技术的有创伤害、昂贵的压力导丝成本、部分弯曲成角的病变操作难度,以及较长的测量时间等因素在很大程度上制约了其临床推广。在这样的背景下,国内学者提出一种无创的,基于三维定量冠状动脉造影计算FFR 的新方法,即QFR。前期系列临床研究已验证了该方法判断中度狭窄的冠状动脉脉病变是否导致功能性心肌缺血的准确度[12-14],并已得到了国内外相关注册部门的批准应用于临床。本研究借助QFR 技术,无创、经济地评估FFR,提出“精准化外科CABG 血运重建策略”的概念,以期在完成确实必要的CABG 同时,减少不必要的CABG干预,从而进一步改善近期和远期疗效,同时节约医疗 资源。
本组82 例患者中,入院主要诊断“冠心病”33 例(占40.2%),“原发性瓣膜性心脏病”37 例(占45.1%),基本与本中心日常收治病种的比例一致。在FFR 指导单纯CABG 领域,目前已有研究[19](美国国立卫生研究院临床研究注册号:NCT02477371)报道了FFR 指导与传统造影指导的比较结果,但2 种策略在术后6 个月时桥血管与临床结局均未见显著差异。于是,学界将FFR 指导的研究探索扩展到了其他病种和术式,如最常见的瓣膜病合并冠状动脉病变,以期FFR 指导减少不必要的CABG,简化术式,改善临床结局。目前有国外发起的SAVE-IT(美国国立卫生研究院临床研究注册号:NCT02173860)和本中心发起的FAVOR IV-QVAS 研究(美国国立卫生研究院临床研究注册号:NCT03977129)2 项随机对照试验正在这个领域进行探索。
本组病例174 支病变冠状动脉血管,整体QFR 分析结果显示约30%为阳性(QFR ≤0.8),70%为阴性(QFR>0.8)。其中狭窄50%~69%的病变血管中,阳性率约为7%;狭窄70%~89%的病变血管中,阳性率约为45%;而狭窄≥90%的病变血管中,阳性率为100%。这些数据与既往的研究报道[12-14]基本一致,一方面提示临床上确实存在相当比例的冠状动脉“临界病变”(狭窄50%~89%),其功能学结果值得进一步探究,以避免过度血运重建治疗;另一方面,狭窄≥90%的“重度病变”血管似乎均为阳性,提示全部需要血运重建,这也与目前的欧美指南推荐一致[16]。同时值得注意,本组病例中前降支区域的病变血管阳性率最高,这也与FFR 理论一致,即相同程度的狭窄病变,病变血管的供血范围越大 (前降支供应区域最大),相应的FFR 值越低。
本组病例为非干预性研究,故并非按照QFR 分析结果机械制定并强制执行手术策略方案,而是由临床医师综合考虑患者基线特征(术前风险模型预测是中低危手术,还是高危手术)、同期手术术式(是简单的单纯CABG,还是合并同期复杂手术)、QFR 分析结果(以界值0.8 判断)等因素,最终制定手术方案。总体是否行CABG 的手术干预方案与QFR 分析结果相符率为92.5%(阳性病变干预相符率98.1%,阴性病变干预相符率90.1%)。可见,手术医师的临床决策极大程度地参考了QFR 分析结果,对阳性病变尤甚。121 支阴性病变血管中,109 支未行CABG 血运重建,对应82 例患者中减少了43 例原本计划的CABG,可见QFR 分析对手术方案的改变是相当大的(43/82,52.4%)。出于临床医师的综合考虑,依然有12 支阴性病变血管接受了CABG,符合现指南推荐的解剖血运重建原则。值得注意的是有15 例患者最终因QFR 分析结果为阴性而免于任何心脏手术(均为原计划CABG),经药物保守治疗出院,节约了医疗资源,对这些患者的随访观察正在继续。
本组病例围术期临床结果初步表明QFR 指导策略是可行的。由于缺乏平行对照组数据,我们将国内外大型数据库中常见术式的数据列举参照。接受手术的67 例患者中单纯行CABG 18 例,30 d 内全因死亡为0;中国心血管外科注册登记研究(Chinese Cardiac Surgery Registry,CCSR)数据库报道死亡率为1.9%~2.5%[20];北美胸外科医师协会(Society of Thoracic Surgeons,STS)数据库报道死亡率为1.8%~2.3%[21]。涉及瓣膜合并CABG 可能的手术37 例,30 d 内全因死亡率为5.4%;STS 数据库报道死亡率为3.0%~9.4%[21]。由于样本量较小且缺乏基线可比的对照组,本研究未进行统计学检验和推论。
本研究为回顾性、描述性的病例报道,存在方法学上的不足:①为单中心的病例报道,尚未推广至多中心实践。②没有设置平行对照组进行分析性研究。③数据来源于临床真实资料,而非前瞻性设计,存在未遵循QFR 分析结果指导的情形。④研究病例的选择性较高,限于QFR分析对造影质量的要求和非强制的临床实践要求,仅部分潜在符合研究适应范围的病例最终完成了QFR 分析并纳入了本研究。
综上所述,本组病例中QFR 技术的应用,改变了手术策略,减少了冠状动脉血运重建,简化了手术方式。与CCSR 和STS 数据库结果相比,初步临床结果满意,其临床应用价值有待进一步随访和前瞻性随机证据的验证。
参·考·文·献
[1] 胡盛寿,高润霖,刘力生,等.《中国心血管病报告2018》概要[J]. 中国循环杂志,2019,34(3): 209-220.
[2] Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease[J]. Eur Heart J, 2017, 38(36): 2739-2791.
[3] Nishimura RA, Otto CM, Bonow RO, et al. 2014Aha/ACC guideline for the management of patients with valvular heart disease[J]. J Am Coll Cardiol, 2014, 63(22): e57-e185.
[4] Berry C, Corcoran D, Hennigan B, et al. Fractional flow reserve-guided management in stable coronary disease and acute myocardial infarction: recent developments[J]. Eur Heart J, 2015, 36(45): 3155-3164.
[5] Pijls NH, van Schaardenburgh P, Manoharan G, et al. Percutaneous coronary intervention of functionally nonsignificant Stenosis: 5-year follow-up of the DEFER Study[J]. J Am Coll Cardiol, 2007, 49(21): 2105-2111.
[6] Pijls NH, Fearon WF, Tonino PA, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention inpatients with multivessel coronary artery disease: 2-year follow-up of the FAME (Fractional Flow Reserve Versus Angiography for Multivessel Evaluation) study[J]. J Am Coll Cardiol, 2010, 56(3): 177-184.
[7] Levine GN, Bates ER, Blankenship JC, et al. 2011 ACCF/Aha/SCAI guideline for percutaneous coronary intervention[J]. J Am Coll Cardiol, 2011, 58(24): e44-e122.
[8] Thuesen AL, Riber LP, Veien KT, et al. Fractional flow reserve versus angiographically-guided coronary artery bypass grafting[J]. J Am Coll Cardiol, 2018, 72(22): 2732-2743.
[9] Glineur D, Grau JB, Etienne PY, et al. Impact of preoperative fractional flow reserve on arterial bypass graft anastomotic function: the IMPAG trial[J]. Eur Heart J, 2019, 40(29): 2421-2428.
[10] Pellicano M, De Bruyne B, Toth GG, et al. Fractional flow reserve to guide and to assess coronary artery bypass grafting[J]. Eur Heart J, 2017, 38(25): 1959-1968.
[11] Baibhav B, Gedela M, Moulton M, et al. Role of invasive functional assessment in surgical revascularization of coronary artery disease[J]. Circulation, 2018, 137(16): 1731-1739.
[12] Tu SX, Westra J, Adjedj J, et al. Fractional flow reserve in clinical practice: from wire-based invasive measurement to image-based computation[J]. Eur Heart J, 2019: ehz918.
[13] Xu B, Tu SX, Qiao SB, et al. Diagnostic accuracy of angiography-based quantitative flow ratio measurements for online assessment of coronaryStenosis[J]. J Am Coll Cardiol, 2017, 70(25): 3077-3087.
[14] Tu SX, Westra J, Yang JQ, et al. Diagnostic accuracy of fast computational approaches to derive fractional flow reserve from diagnostic coronary angiography: the international multicenter FAVOR pilot study[J]. JACC Cardiovasc Interv, 2016, 9(19): 2024-2035.
[15] Tonino PA, De Bruyne B, Pijls NH, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention[J]. N Engl J Med, 2009, 360(3): 213-224.
[16] De Bruyne B, Pijls NH, Kalesan B, et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease[J]. N Engl J Med, 2012, 367(11): 991-1001.
[17] Johnson NP, Tóth GG, Lai DJ, et al. Prognostic value of fractional flow reserve: linking physiologic severity to clinical outcomes[J]. J Am Coll Cardiol, 2014, 64(16): 1641-1654.
[18] Pijls NH, van Schaardenburgh P, Manoharan G, et al. Percutaneous coronary intervention of functionally nonsignificantStenosis: 5-year follow-up of the DEFER Study[J]. J Am Coll Cardiol, 2007, 49(21): 2105-2111.
[19] Thuesen AL, Riber LP, Veien KT, et al. Fractional flow reserve versus angiographically-guided coronary artery bypass grafting[J]. J Am Coll Cardiol, 2018, 72(22): 2732-2743.
[20] Hu SS, Zheng Z, Yuan X, et al. Coronary artery bypass graft: contemporary heart surgery center performance in China[J]. Circ Cardiovasc Qual Outcomes, 2012, 5(2): 214-221.
[21] D'Agostino RS, Jacobs JP, Badhwar V, et al. The society of thoracic surgeons adult cardiac surgery database: 2019 update on outcomes and quality[J]. Ann Thorac Surg, 2019, 107(1): 24-32.
