14株鸭疫里默氏杆菌的部分生物学特性分析
2020-09-22左春生李迎晓徐光科
左春生 李迎晓 徐光科


摘要:为了解鸭疫里默氏杆菌的流行情况,对信阳地区疑似鸭疫里默氏杆菌感染病料进行病原分离和鉴定。结果显示,共鉴定到14株鸭疫里默氏杆菌,其中血清1型、2型和10型菌株依次为3、4、2株,未定血清型菌株5株;动物致病性试验结果显示,分离菌对雏鸭均具有致病性。对11种抗菌药物敏感性检测结果表明,分离菌株对阿米卡星、链霉素和头孢曲松较为敏感,对氟苯尼考、阿莫西林、磺胺异唑、多黏菌素B和多西环素耐药性较高;生物被膜检测结果表明,14株菌株中有8株为强生物被膜形成株,2株为弱生物被膜形成株。
关键词:鸭疫里默氏杆菌;分离鉴定;血清型;药敏试验;生物被膜
中图分类号: S855.1 文献标志码: A 文章编号:1002-1302(2020)15-0221-05
鸭疫里默氏杆菌(Riemerella anatipestifer,RA)可感染鸭、鹅、火鸡等多种禽类,是目前规模化水禽养殖多发的细菌性疾病,常造成严重的经济损失。鸭疫里默氏杆菌主要侵害2~7周龄的雏鸭和仔鹅,特征性病变为纤维素性心包炎、肝周炎、气囊炎、关节炎、输卵管炎和脑膜炎等[1]。
我国郭玉璞等在1982年首次报道北京地区商品鸭发生鸭传染性浆膜炎后[2],其他主要水禽养殖区域陆续报道发现该病。鸭疫里默氏杆菌血清型众多,至少有21个血清型,且各型之间几乎无交叉保护性,已成为危害养鸭生产的主要疾病[3]。信阳市是河南省主要的水禽集散地,部分养殖户使用血清1型和血清2型RA灭活疫苗免疫后,预防效果不佳。因此,本研究通过对实验室送检的疑似鸭疫里默氏杆菌感染病料进行细菌分离和血清型鉴定,旨在为河南省信阳市水禽鸭疫里默氏杆菌病的防治提供参考。
1 材料与方法
1.1 樣品
样品为养殖户送检的发病雏鸭。
1.2 主要试剂与试验动物
胰蛋白胨大豆(TSA)琼脂培养基、胰酪胨大豆肉汤(TSB)培养基,购自杭州天和微生物试剂有限公司;即用型SanPfu PCR试剂盒、细菌基因组DNA快速抽提试剂盒,购自生工生物工程(上海)股份有限公司;胎牛血清,购自杭州四季青生物工程材料有限公司;鸭疫里氏杆菌1型、2型菌株和RA标准血清由上海兽医研究所胡青海博士惠赠;1日龄健康非免疫樱桃谷鸭,购自河南华英农业发展股份有限公司,隔离饲养至15日龄后用于细菌致病性试验测定。
1.3 细菌学检查
无菌采集病死雏鸭肝脏、脑等病料,划线接种于TSA平板,置于烛缸中37 ℃培养36~48 h,挑取可疑菌落转接种TSA培养基(含5%胎牛血清)纯培养后,革兰氏染色和瑞氏染色后检查细菌形态。挑取TSA培养基纯化后的单菌落转接种TSB培养基(含5%胎牛血清)增菌培养后待用。
1.4 生化试验
参照文献[4]方法,取TSA培养基上纯化的单菌落接种细菌生化反应管,37 ℃培养规定时间后观察并记录结果。
1.5 PCR鉴定
1.5.1 细菌基因组的提取 挑取单菌落接种5 mL TSB培养基,37 ℃、200 r/min振摇培养过夜。取 500~1 000 μL进行细菌基因组提取,操作步骤按照细菌基因组DNA快速抽提试剂盒说明书进行。
1.5.2 16S rRNA基因和dan B基因PCR检测 根据文献[5]方法,设计检测RA 16S rRNA基因和dan B基因的2对引物,扩增片段长度分别为364、627 bp。引物由生工生物工程(上海)股份有限公司合成。引物详情见表1。
PCR反应体系50 μL:2×Taq Master Mix 25 μL,上下游引物(10 μmol/L)各2 μL,模板2 μL,超纯水19 μL。扩增条件:94 ℃预变性5 min;94 ℃ 30 s,54 ℃ 45 s,72 ℃ 1 min,35个循环;72 ℃延伸 5 min。
PCR产物用1.5%琼脂糖电泳进行检测后,送生工生物工程(上海)股份有限公司测序。测序结果在GenBank数据库中进行Blast分析比对。
1.6 血清型鉴定
参照程安春等的方法[6],将各RA分离株菌液和RA1、RA2、RA10型标准血清进行平板凝集试验,观察记录结果。
1.7 动物致病性试验
参照任小梅等的方法[4],将鉴定后的14株RA分离株分别腿部肌肉注射进15日龄的樱桃谷鸭或麻鸭,注射剂量为0.5 mL/羽(约1×108 CFU),每组3羽,同时设立对照组,腹腔注射0.5 mL灭菌生理盐水。攻毒后每天观察并记录各组发病、死亡情况。
1.8 药敏试验
以大肠埃希菌(ATCC 25922)作为质控菌株,参照CLSI推荐的药敏试验纸片扩散法测定14株供试菌株对11种抗菌药物的耐药表型。结果依据CLSI标准判定各分离菌株的敏感性,以敏感、中介、耐药3种形式记录[7]。
1.9 鸭疫里默氏杆菌的生物被膜检测
参照文献的方法[8]将14株鸭疫里默氏杆菌和大肠杆菌DH5a的新鲜菌液(D600 nm=1.0)采用TSB进行1 ∶ 100稀释后,加入96孔板,200 μL/孔,每株细菌设3个重复,然后置于37 ℃、5% CO2恒温培养箱中静置培养24 h后采用结晶紫染色法检测其生物被膜形成情况。最后采用酶标仪检测各孔D595 nm值。生物被膜形成能力的判定标准为D595 nm≤0.31为无生物被膜形成菌株;0.31
2 结果与分析
2.1 细菌分离与染色
从58份病料中分离出14株RA,分离株在TSA培养基上,于烛缸中37 ℃培养24~36 h后,可形成圆形、略微突起、表面光滑的奶油状小菌落(对着光线观察菌落呈现淡蓝色)。革兰氏染色镜检可见散在或少数成对出现的革兰阴性短杆(球杆)菌;瑞氏染色呈两极浓染,符合RA的形态特征。
2.2 生化试验结果
14株RA乳糖发酵试验、半乳糖发酵试验、甲基红试验、VP试验、硫化氢产生试验、硝酸盐还原试验和枸橼酸盐试验均为阴性,不产生硫化氢,氧化酶试验、触酶试验均为阳性,基本符合RA的生化特性。
2.3 16S rRNA基因和dan B基因PCR检测结果
14株RA均能PCR扩增出约364、627 bp大小的条带,与预期相符(图1、图2)。将阳性条带切胶回收后测序,结果表明,扩增条带的序列与目的基因序列高度一致。
2.4 血清型鉴定结果
将分离到的14株细菌分别与标准阳性血清进行平板凝集试验。由表2可知,血清1型菌株3株、血清2型菌株4株、血清10型菌株2株, 其他菌株为未定血清型。
2.5 动物致病性试验结果
试验组樱桃谷雏鸭接菌后18~24 h出现精神委顿、呆立,逐渐排出白色、黄白色、黄绿色稀粪,2~3 d后开始出现死亡,并在死亡前表现出阵发性摇头、勾头扭颈等临床症状。剖检死鸭有轻或重的纤维素性心包炎、气囊炎、肝周炎和脑膜炎。对死亡鸭进行细菌分离和PCR鉴定,结果能够重新分离鉴定出接种菌。
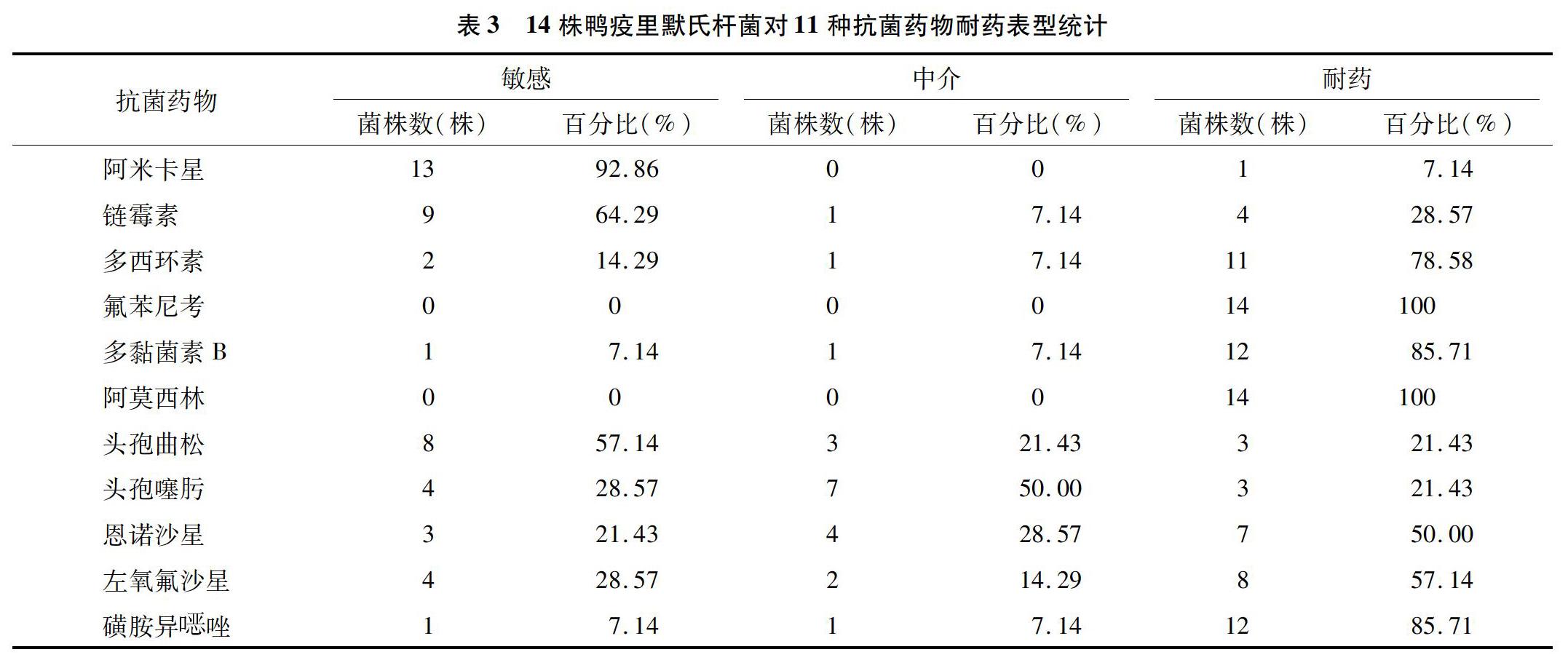
2.6 14株鸭疫里默氏杆菌对11种抗菌药物的耐药表型
由表3可知,14株鸭疫里默氏杆菌对11种抗菌药物表现出不同程度的耐药,其中对氟苯尼考、阿莫西林、磺胺异唑、多黏菌素B、多西环素耐药率较高,分别为100%(14/14)、100%(14/14)、85.72%(12/14)、85.72%(12/14)和78.58%(11/14);对阿米卡星、链霉素和头孢曲松敏感性较高,分别为92.86%(13/14)、64.28%(9/14)和57.14%(8/14);多数菌株呈现多重耐药现象(表2)。
2.7 分离株的生物被膜检测
生物被膜检测结果显示,8株(PQJ4、PQY2、PQH5、LSG1、GSX6、HY8、HB1和HCH7)具有强生物被膜形成能力;GSP5和HY1为弱生物被膜形成能力,具体结果见表2。
3 结论与讨论
信阳市水资源丰富,除采用标准化养殖体系的樱桃谷肉鸭养殖龙头——河南华英农业发展股份有限公司外,还有众多小型养殖户和散养户。这些小型养殖户和散养户的鸭(鹅)苗来源比较杂,除本地的孵化场外,其他大多来源于江苏、安徽、四川和广东(狮头鹅)等地,使得信阳地区鸭疫里默氏杆菌血清型分布较为多样,再加上呼肠孤病毒感染的普遍存在[9-10],使得鸭疫里默氏杆菌病的防控形势更加严峻。
鸭疫里默氏杆菌血清型众多,并且存在明显的区域性特征。任晓梅等从广东、山东、江苏等地区疑似鸭疫里默氏杆菌病病料中分离鉴定出46株鸭疫里默氏杆菌,其中血清1型、2型、10型和15型菌株依次为9株、25株、1株和1株,未定血清型菌株10株[4]。云水丽等从江苏省某免疫鸭场的病死鸭中分离到了血清11型的鸭疫里默氏杆菌[11]。袁小远等2015—2016年间从山东及河北等地的商品鸭场病料中共分离出18株鸭疫里默氏杆菌,均为血清1型RA[12]。本研究分离的14株鸭疫里默氏杆菌中血清1型菌株3株,血清2型菌株4株,血清10型2株,其他菌株为未定血清型,这与焦凤超等的早期研究结果部分吻合[13],这也解释了为什么当前信阳地区很多养殖户虽然实施了鸭疫里默氏杆菌病疫苗(主要是血清1型和2型)的免疫接种,但该病仍频繁发生的原因。
由于鸭疫里默氏杆菌病疫苗免疫预防效果不佳,所以很多养殖户往往采用抗菌药物进行防治,而鸭疫里默氏杆菌又经常和大肠杆菌发生混合感染,这给该菌的分离鉴定带来一定的难度。本研究参考丁云竹等建立的PCR方法辅助开展鸭疫里默氏杆菌的分离鉴定,提高了工作效率[5]。另外Hu等建立的针对大肠杆菌phoA、沙门菌invA、鸭疫里默氏杆菌dna B基因的三重PCR方法,其检测下限为1×103 CFU/mL[14]。Wei等建立的大肠杆菌、沙门菌、鸭疫里默氏杆菌、巴氏杆菌、多重PCR检测方法,其检测下限为10 pg基因组DNA[15]。以上这些方法有助于对临床病料中的鸭疫里默氏杆菌进行鉴别检测。
报道表明,RA对多种抗生素表现出耐药现象[16]。荆雅玮等对分离自安徽省的8株RA菌株药物敏感性检测结果表明,RA对阿莫西林、头孢他啶和头孢吡啶敏感,对洛美沙星和阿奇霉素、阿米卡星耐药[17]。Zhong等对国内分离的224株RA进行耐药性检测的结果表明,50%的分离株对β-内酰胺类抗生素、利福平等多种抗生素耐药,其中有4株对29种抗生素耐药[18]。本次分离的14株RA对氟苯尼考、阿莫西林、磺胺异唑、多黏菌素B和多西环素表现出较高的耐药率以及多重耐药现象,但对阿米卡星敏感性较好,为92.86%(13/14),与上述结果有较大出入,这可能与各地用药习惯有关。调查发现,信阳地区使用抗菌药物防治鸭疫里默氏杆菌病和大肠杆菌病时,主要采用拌料或饮水给药,且常使用氟苯尼考、强力霉素、阿莫西林、多黏菌素B和磺胺类等药物,很少用阿米卡星和头孢类药物,这与14株RA的耐药性检测结果基本相符。
生物膜是一個微生物群落,由细胞外聚合物基质包围的微生物组成。研究报道鸭疫里默氏杆菌形成生物被膜能力可能和该菌在养殖环境中的持续存在和细菌耐药性存在一定的关系[8,19]。荆雅玮等分离的8株菌株中有7株为强生物被膜形成株,且表明强生物被膜形成株AH-1对17种抗菌药物耐药[17]。本研究分离的14株RA中有8株为强生物被膜形成株,并且8株均表现出了多种耐药现象,具体的机制有待于进一步研究确定。
综上所述,本研究从58份临床送检病料中分离到14株疑似鸭疫里默氏杆菌,通过细菌生物学特性和16S rRNA基因、dan B基因PCR鉴定,确定分离菌株为鸭疫里默氏杆菌,并对其部分生物特性如血清型、耐药表型和生物被膜形成能力进行了鉴定,为河南省信阳市的水禽鸭疫里默氏杆菌病的综合防控提供参考。
参考文献:
[1]苏敬良,黄 瑜,胡薛英. 鸭病学[M]. 北京:中国农业大学出版社,2016:243-245.
[2]郭玉璞,陈德威,范国雄,等. 北京鸭小鸭传染性浆膜炎的调查研究[J]. 畜牧獸医学报,1982,13(2):35-41.
[3]吴彩艳,程淑琴,张建峰,等. 我国鸭疫里氏杆菌病流行概述[J]. 动物医学进展,2017,38(6):86-90.
[4]任晓梅,王小兰,韩文龙,等. 鸭疫里默氏杆菌的分离鉴定与生物学特性研究[J]. 中国动物传染病学报,2018,26(4):47-51.
[5]丁云竹,孙冰清,姜 盼,等. 鸭疫里默氏杆菌16S rRNA和dna B基因的双重PCR检测方法的建立[J]. 中国预防兽医学报,2017,39(1):50-53.
[6]程安春,汪铭书,陈孝跃,等. 我国鸭疫里默氏杆菌血清型调查及新血清型的发现和病原特性[J]. 中国兽医学报,2003,23(4):320-323.
[7]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing:twenty fourth informational supplement[S]. CLSI documents M100-S24,CLSI,2014.
[8]Hu Q H,Han X G,Zhou X J,et al. Characterization of biofilm formation by riemerella anatipestifer[J]. Vet Microbiol,2010,144(3/4):429-436.
[9]黄 瑜,苏敬良,施少华,等. 我国鸭呼肠孤病毒感染相关的疫病[J]. 中国兽医杂志,2009,45(7):57-58,92.
[10]高绪慧,吴海洋,孙吉谦,等. 山东地区新型鸭呼肠孤病毒的分离与鉴定[J]. 中国家禽,2018,40(20):61-63.
[11]云水丽,杨 勇,王小波,等. 11型鸭疫里默氏杆菌分离鉴定及致病性研究[J]. 中国预防兽医学报,2009,31(8):605-609.
[12]袁小远,王友令,王晓丽,等. 2015—2016年山东、河北地区鸭疫里默氏杆菌流行病学调查[J]. 中国家禽,2017,39(4):70-72.
[13]焦凤超,李迎晓,陈宏智,等. 河南省信阳市鸭疫里默氏杆菌的分离鉴定和血清型分析[J]. 江苏农业科学,2014,42(1):166-167.
[14]Hu Q H,Tu J,Han X G,et al. Development of multiplex PCR assay for rapid detection of Riemerella anatipestifer,Escherichia coli,and Salmonella enterica simultaneously from ducks[J]. Journal of Microbiological Methods,2011,87(1):64-69.
[15]Wei B,Cha S Y,Kang M,et al. Development and application of a multiplex PCR assay for rapid detection of 4 major bacterial pathogens in ducks[J]. Poultry Science,2013,92(5):1164-1170.
[16]刘马峰,田 琇,程安春. 鸭疫里默氏杆菌毒力及耐药机制研究进展[J]. 微生物学报,2019(7):1222-1231.
[17]荆雅玮,陈芳芳,左佳坤,等. 8株鸭疫里默氏杆菌安徽分离株的生物学特性分析[J]. 中国动物传染病学报,2018,26(2):34-39.
[18]Zhong C Y,Cheng A C,Wang M S,et al. Antibiotic susceptibility of riemerella anatipestifer field isolates[J]. Avian Diseases,2009,53(4):601-607.
[19]Burmolle M,Webb J S,Rao D,et al. Enhanced biofilm formation and increased resistance to antimicrobial agents and bacterial invasion are caused by synergistic interactions in multispecies biofilms[J]. Applied and Environmental Microbiology,2006,72(6):3916-3923.
