氟比洛芬酯预先给药对胸腔镜下肺叶切除患者术后镇痛和胃肠激素的影响*
2020-09-22黎翠胡翠纹张军龙王红军
黎翠,胡翠纹,张军龙,王红军
(1.徐州医科大学 江苏 徐州 221004;2.连云港市第二人民医院 麻醉科,江苏 连云港 222000)
肺癌是临床治疗常见疾病,患者发病后可表现出明显的咳嗽、胸痛、胸闷症状,疾病发生、发展后可能引发诸多严重并发症,最终危害生命安全[1-2]。目前肺癌多采用胸腔镜下肺叶切除治疗。然而疾病疼痛、手术创伤、胸管刺激胸膜、术后炎症痛及异位神经活动,可诱发下丘脑-垂体-肾上腺皮质系统和交感肾上腺髓质系统大量异常释放儿茶酚胺类、前列腺素等介质,造成患者异常疼痛[3];同时围手术期机体灌注不足、镇痛药物的使用,以及手术操作的刺激作用可使交感神经兴奋性升高,并反射性抑制迷走神经的传出纤维,使胃肠道运动能力减弱,胃肠平滑肌收缩幅度减小,延迟胃肠功能的恢复,进而影响术后恢复。因此在手术治疗过程中需制定安全、合理的镇痛方案,在缓解患者术后疼痛的同时改善其胃肠激素水平,进而促进胃肠道功能尽早恢复。非甾体类消炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)辅助术后镇痛已经有诸多研究报道,本研究主要明确氟比洛芬酯预先给药对肺叶切除患者术后镇痛和胃肠激素的影响,为临床完善围手术期疼痛管理,提高术后恢复质量提供参考。
1 资料与方法
1.1 一般资料
根据预实验结果及查阅文献估计各组目标值和标准差,定义检验水准α=0.05,β=0.2,检验效度为80%,利用PASS 15.0 统计软件计算,并考虑允许10%脱落率,估计样本含量为每组30 例。
选取2018年1月—2018年12月连云港市第二人民医院收治的60 例行胸腔镜下肺叶切除患者作为研究对象。所有患者参考《中国晚期原发性肺癌诊治专家共识》[4]诊断为肺癌。性别不限,年龄40 ~80 岁,美国麻醉师协会(American Society of Anesthesiologists,ASA)分级Ⅰ、Ⅱ级,体重指数18 ~25 kg/m2。本研究通过医院伦理委员会审批(201612068)。所有患者签署知情同意书,无意识不清及沟通障碍者,均能正确理解视觉模拟评分规则。排除标准: ①合并其他恶性肿瘤疾病或全身性系统性感染疾病;②心、肝、肾等器官严重功能障碍;③术中出血>400 ml 或者改变术式;④既往有消化道溃疡病史或手术史;⑤近期接受NSAIDs 治疗或既往有过敏史或已知与NSAIDs 有交互作用的药物治疗。
1.2 分组
所有患者采用随机数字表法分为观察组和对照组,每组30 例。观察组麻醉诱导前15 min 静脉注射氟比洛芬酯50 mg;对照组相同时间静脉输注等容量脂肪乳5 ml。所有操作均由同一位麻醉医师实施,受试者、术后随访者及外科医生均不知情。
1.3 麻醉方法
患者手术治疗前常规禁食8 h、禁饮4 h。进入手术室后开放非手术侧上肢静脉通道,静脉输注乳酸钠林格液10 ml/kg。非手术侧桡动脉穿刺置管监测有创动脉血压,同时记录心率、呼吸及脉搏氧饱和度。患者麻醉处理过程中采用面罩吸氧,吸氧速率6 L/min,给予咪达唑仑0.05 mg/kg,丙泊酚1 ~2 mg/kg,芬太尼5μg/kg,顺式阿曲库铵0.2 mg/kg,5 min 后在纤维支气管镜定位下行双腔气管导管插管。术中维持麻醉采用瑞芬太尼0.5 ~2μg/(kg·min),丙泊酚2 ~4 mg/(kg·h),顺式阿曲库铵1 ~2μg/(kg·min)。双肺机械通气时潮气量(VT)8 ~10 ml/kg,呼吸频率(RR)10 ~12 次/min,吸呼比(I ∶E)=1 ∶1.5 ~2.0,吸入氧浓度(FiO2)为100%。单肺机械通气时VT 6 ~8 ml/kg,RR 12 ~16 次/min,I ∶E=1 ∶1.5 ~2.0,FiO2为100%。术中维持脑电双频指数40 ~60,呼气末二氧化碳分压35~45 mmHg。术毕前30 min停止泵注顺式阿曲库铵。缝皮结束停止泵注丙泊酚和瑞芬太尼。患者恢复自主呼吸,给予阿托品0.02 mg/kg 和新斯的明0.04 mg/kg拮抗非去极化肌松药,拔除气管导管。术毕即刻连接镇痛泵行自控静脉镇痛(patient-controlled intravenous analgesia, PCIA),采用芬太尼1.0 mg+生理盐水稀释至100 ml,持续输注2 ml/h,单次剂量1.5 ml/次,锁时15 min,持续镇痛至术后48 h。
1.4 观察项目
1.4.1 生命体征评价出手术室时(T2)、术后6 h(T3)、术后12 h(T4)、术后24 h(T5)一般生命体征,静息、运动视觉模拟评分(VAS),镇静评分(Ramsay)。
1.4.2 实验室检查分别于入室时(T0)、术毕时(T1)、术后12 h(T4)抽取静脉血5 ml,3 000 r/min 离心,采用酶联免疫吸附试验检测肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(Interleukin-6, IL-6)、胃泌素(Gastrin, GAS)及胃动素(Motilin, MTL)含量。其中针对GAS、MTL 水平的检测需采用荧光放射免疫测定,相关试剂盒均由江莱生物科技有限公司提供,具体操作步骤严格按照试剂盒说明书进行。
1.4.3 并发症记录病房镇痛药物补救的种类和剂量,以及48 h 内副作用和并发症,如恶心、呕吐、头晕、嗜睡、面色潮红、瘙痒、呼吸抑制(呼吸频率<10 次/min 和/或氧饱和度≤90%)及异常出血等。
1.5 统计学方法
数据分析采用SPSS 20.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析;计数资料以构成比或率(%)表示,比较用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
本研究中60 例患者均完成手术,两组性别构成、年龄、ASA 分级构成及体重比较,差异无统计学意义(P>0.05),具有可比性。见表1。
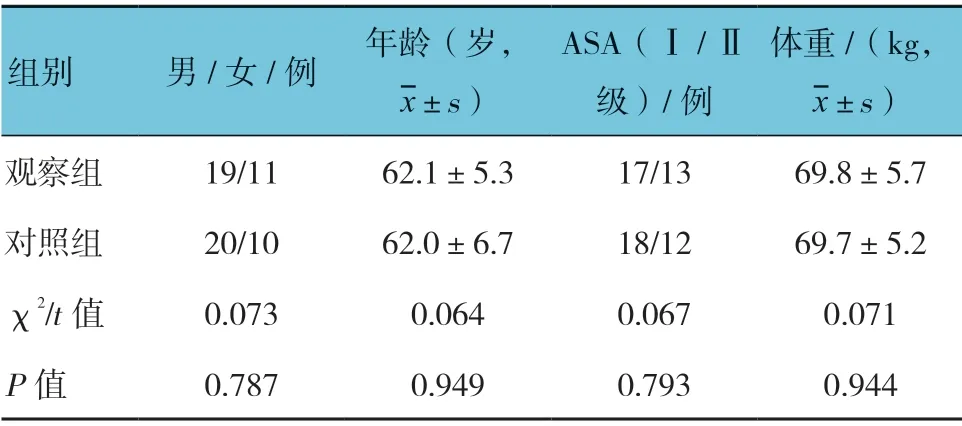
表1 两组一般资料比较 (n =30)
2.2 两组术后不同时间点静息和运动VAS 评分
观察组与对照组T2、T3、T4、T5时静息和运动状态下VAS 评分比较,采用重复测量设计的方差分析,结果: ①不同时间点的静息和运动状态VAS 评分有差别(F=16.754 和18.965,均P=0.000);②两组静息和运动状态VAS 评分有差别(F=6.854 和9.865,均P=0.000);③观察组与对照组静息和运动状态下VAS 评分变化趋势有差别(F=14.965 和15.698,均P=0.000)。见表2。
表2 两组不同时间点静息和运动VAS 评分比较 (n =30,分,±s)

表2 两组不同时间点静息和运动VAS 评分比较 (n =30,分,±s)
注: †与对照组比较,P <0.05。
组别 T2 T3 T4 T5静息VAS 评分观察组 5.6±0.9 4.5±0.7† 3.6±0.5† 2.6±0.7对照组 5.7±0.9 5.0±0.4 4.2±0.6 2.6±0.3运动VAS 评分观察组 6.4±0.7 4.8±0.6† 4.2±0.6† 3.4±0.5对照组 6.4±0.6 5.4±0.3 4.6±0.5 3.4±0.4
2.3 两组术后不同时间点镇静评分
观察组与对照组T2、T3、T4、T5时的镇静评分比较,采用重复测量设计的方差分析,结果: ①不同时间点的镇静评分无差别(F=0.369,P=0.821);②两组的镇静评分无差别(F=0.495,P=0.769);③观察组与对照组的镇静评分变化趋势无差别(F=0.532,P=0.456)。见表3。
表3 两组术后不同时间点镇静评分比较 (n =30,分,±s)

表3 两组术后不同时间点镇静评分比较 (n =30,分,±s)
组别 T2 T3 T4 T5观察组 2.93±0.42 2.52±0.24 2.85±0.38 3.12±0.37对照组 2.90±0.40 2.51±0.25 2.83±0.42 3.10±0.35
2.4 两组血清炎症因子与胃肠激素水平
观察组与对照组T0、T1、T2时TNF-α、IL-6、GAS、MTL 表达水平比较,采用重复测量设计的方差分析,结果: ①不同时间点TNF-α、IL-6、GAS、MTL表达水平有差别(F=8.852、9.865、9.452 和10.252,均P=0.000);②两组TNF-α、IL-6、GAS、MTL 表达水平有差别(F=8.651、10.582、15.965 和12.521,均P=0.000),观察组炎症因子表达水平低于对照组,胃肠激素表达水平高于对照组,说明观察组患者术后炎性痛及胃肠道恢复较好;③观察组与对照组TNF-α、IL-6、GAS、MTL 表达水平变化趋势有差别(F=8.652、12.526、13.621 和13.965,均P=0.000)。见表4、5。
2.5 两组不良反应发生情况
两组患者术后均出现恶心呕吐、头晕、嗜睡、面部潮红等反应。两组恶心呕吐发生率比较,经χ2检验,差异有统计学意义(P<0.05),观察组较低。两组头晕、嗜睡、面部潮红发生率比较,经χ2检验,差异无统计学意义(P>0.05)。见表6。
表4 两组炎症因子表达水平比较 (n =30,pg/ml,±s)
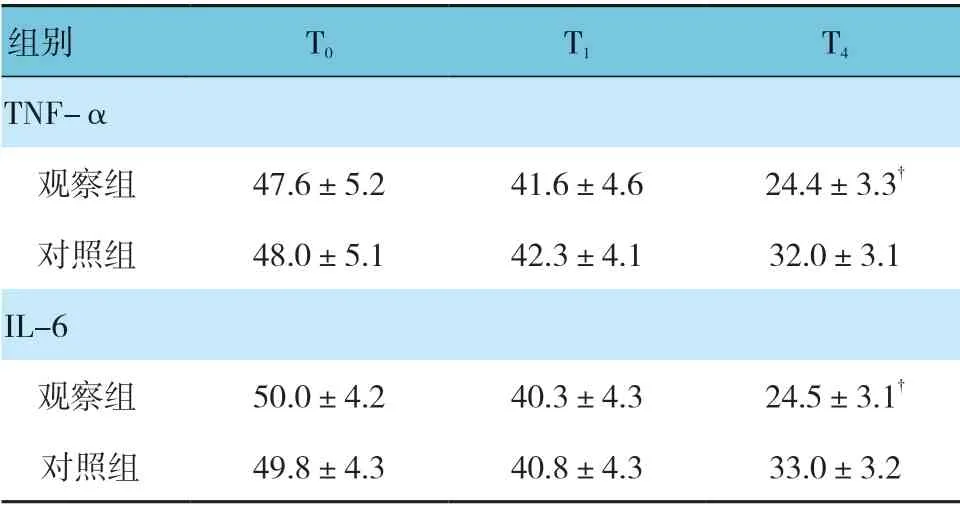
表4 两组炎症因子表达水平比较 (n =30,pg/ml,±s)
注: †与对照组比较,P <0.05。
组别 T0 T1 T4 TNF-α观察组 47.6±5.2 41.6±4.6 24.4±3.3†对照组 48.0±5.1 42.3±4.1 32.0±3.1 IL-6观察组 50.0±4.2 40.3±4.3 24.5±3.1†对照组 49.8±4.3 40.8±4.3 33.0±3.2
表5 两组胃肠激素表达水平比较 (n =30,pg/ml,±s)

表5 两组胃肠激素表达水平比较 (n =30,pg/ml,±s)
注: †与对照组比较,P <0.05。
组别 T0 T1 T4 GAS观察组 105.6±10.3 87.4±6.6 110.3±12.1†对照组 105.1±10.4 87.3±6.5 67.5±8.2 MTL观察组 320.6±80.6 300.6±83.6 330.4±87.6†对照组 319.1±79.8 298.6±84.2 245.1±60.3
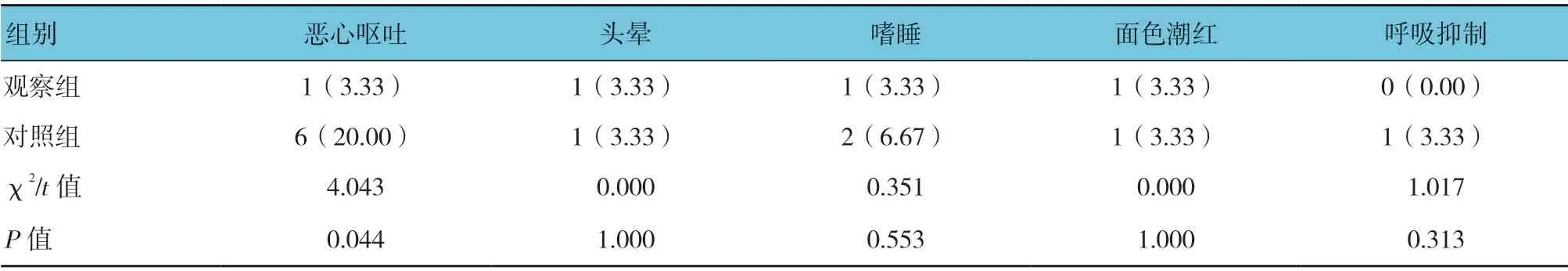
表6 两组术后不良反应发生率比较 [n =30,例(%)]
3 讨论
目前肺癌多采用胸腔镜下肺叶切除治疗,尽管手术切口缩小,但是肋间肌肉和神经机械损伤,以及胸腔引流管刺激胸膜等原因,使胸腔镜手术后仍有中至重度的疼痛[5-6]。组织和周围神经损伤诱发包括TNF-α、IL-6 等炎症细胞因子和前列腺素等异常释放。这些细胞因子可诱导外周和中枢神经系统敏化,导致痛觉增敏,同时延迟术后胃肠道功能的恢复。因此肺叶切除手术患者需针对性地实施安全有效的围手术期镇痛管理。
本研究结果表明,相较于对照组,观察组麻醉诱导前预先给予氟比洛芬酯可有效缓解肺癌患者术后疼痛程度。本实验中氟比洛芬酯采用预先给药,属于一种超前镇痛,麻醉诱导前就开始对患者进行镇痛药物供给,不但降低手术操作及创伤造成的疼痛反应,同时复合术后自控镇痛将镇痛效果维持、延伸至术后炎症阶段,患者可获得较好的镇痛效果[7-8]。ZHOU 等[9]也报道静脉注射氟比洛芬脂可减少髋关节置换术后老年患者的疼痛和炎症反应,并且氟比洛芬脂在术前应用比术中更有效。这与WANG[10]等的研究结论相似。而术后6 h 与术后12 h 镇痛评分有差异,可能与氟比洛芬酯的作用时间有关。
炎症反应是影响胃肠道功能恢复的一个重要因素。TNF-α、IL-6 是炎症反应的敏感指标,可较早且直接反映机体内的炎症程度。氟比洛芬酯对前列腺素的合成及炎症因子的分泌均存在显著的抑制作用,炎症因子水平降低,炎症反应也可得到有效缓解,患者术后炎性痛及胃肠道恢复得以改善。本研究中观察组镇痛效果明显优于对照组。HUANG 等[11]观察氟比洛芬酯单孔胸腔镜治疗原发性自发性气胸的疗效,结果表明氟比洛芬可使血清TNF-α 和IL-6 水平显著降低,抑制过度应激反应,有助于提高疗效和术后康复。GENG 等[12]报道氟比洛芬酯复合舒芬太尼可减少术后24 h 的TNF-α 和IL-6 表达水平。
GAS 和MTL 均能促进胃肠道蠕动和排空,是胃肠道功能相关的兴奋性激素,可直接反映胃肠动力情况[13]。麻醉药物、手术造成内环境紊乱,术后的疼痛和应激反应引起胃肠道激惹等均可对胃肠激素分泌有不同程度的抑制作用,因此患者血液中胃肠激素水平可能表现出不同程度的降低趋势。本研究提示,观察组氟比洛芬酯预先给药治疗后GAS 和MTL 表达水平明显高于对照组,其机制可能为: ①氟比洛芬酯预先给药的处理在保证麻醉效果的同时,减少了麻醉药物用量,进而减轻对胃肠功能的抑制作用;②氟比洛芬酯发挥较强的抗炎作用,一定程度上避免了胃肠道黏膜损伤和肠道运输功能受阻,间接影响胃肠激素的释放;③多模式镇痛的应用极大程度地减轻患者术后疼痛和应激反应,从而减轻对术后胃肠分泌功能的抑制作用。④氟比洛芬酯本身是不影响胃肠功能,不抑制胃肠蠕动。这或许也是观察组术后恶心呕吐减少的原因之一。WEN 等[14]亦报道氟比洛芬酯联合小剂量芬太尼可显著增强镇痛效果,减少呕吐的副作用。
综上所述,麻醉诱导前预先予以氟比洛芬酯可提高胸腔镜下肺叶切除患者术后镇痛效果,对患者机体炎症反应及胃肠功能有一定程度的改善,同时能降低患者术后恶心呕吐发生率。
