呼吸道病毒、炎症细胞因子、肺功能在慢性阻塞性肺疾病急性加重期的诊断价值及其相关性
2020-09-22孟伟峰童伟隆赵桂琴
孟伟峰 朱 衍 童伟隆 赵桂琴
相关研究报道,慢性阻塞性肺疾病的主要病理改变是气道炎症,且炎性反应与肺功能具有相关性[1-2]。但炎性因子的异常变化在其他疾病中亦会发生,故不能作为评价肺功能损伤程度的最佳指标。临床研究提示,呼吸道病毒感染是慢性阻塞性肺疾病急性加重的主要原因,在该病的发生发展过程中发挥重要作用[3-4]。病毒感染可诱导机体发生炎症反应,而临床关于呼吸道病毒感染与炎症因子在慢性阻塞性肺疾病中的相关报道甚少,且缺乏关于呼吸道病毒感染与肺功能的研究。基于此,本研究将探讨呼吸道病毒、炎症细胞因子、肺功能在慢性阻塞性肺疾病急性加重期的诊断价值及其相关性。
1 资料与方法
1.1 临床资料 以2017 年11 月—2019 年11 月于浙江省绍兴市第七人民医院收治入院的慢性阻塞性肺疾病急性加重期患者102 例为研究对象。其中男78 例,女24 例,年龄46~69(56.83±8.21)岁。本研究方案的制定符合《世界医学协会赫尔辛基宣言》的相关要求,且已通过我院伦理委员会审核。
1.2 纳入及排除标准 纳入标准:(1)均符合2013年《慢性阻塞性肺病诊治指南(修订版)》[5]中的相关标准;(2)无哮喘病史、过敏性鼻炎及支气管扩张者;(3)所有患者及其家属均自愿参与研究并签署知情同意书;(4)近8 周内无服抗病毒药物者;(5)近8 周内无COPD 急性发作及病毒感染病史;(6)临床资料完整者;(7)精神正常且依从性较好者。排除标准:(1)合并肝肾功能障碍;(2)合并肺栓塞、活动性肺结核等其他疾病;(3)合并其他恶性肿瘤者;(4)不能配合完成研究;(5)长期使用全身性糖皮质激素。
1.3 方 法 (1)标本采集:痰液标本在患者入院24h 内留取。采样前嘱咐患者保持平静,无痰的患者给予雾化吸入3%氯化钠溶液10min 后留痰;有痰的患者给予生理盐水漱口,将深咳吐出的痰存放在无菌痰杯中。采用生理盐水将痰液洗涤后通过低倍镜筛查,鳞状上皮细胞<10 个/视野,白细胞>25 个/视野,或同个视野下鳞状上皮细胞/白细胞<2.5,为合格,不合格者需再次留取。将痰液标本放置于4℃冰箱,在48h 内进行检测。(2)肺功能检测:患者入院24h 后,均采用肺功能检测仪(日本,福田,ST320)对患者1s 用力呼气容积(FEV1)与用力肺活量的比值(FEV1/FVC)、FEV1 占预计值百分比(FEV1%)进行测定。(3)提取病毒核酸:采用体液病毒DNA/RNA 小量试剂盒(美国AXYGEN 公司,批号AP-MN-BFVNA-50)进行检验。(4)病毒检测:采用呼吸道病原体多重荧光PCR 检测试剂盒(美国Roche 公司,批号53-0101-96),采用荧光PCR 扩增仪(美国,罗氏公司,LightCycler 480Ⅱ型),对11 种病毒进行检测包括流感病毒(InfA、InfB 型)、冠状病毒(OC43、HKU1、229E 型)、人博卡病毒(HBoV)、肠道病毒(HEV)、人鼻病毒(HRV)、呼吸道合胞病毒(RSV)、人偏肺病毒(HMPV)及腺病毒(ADV)等。荧光PCR扩增仪检测病毒阳性后,再选用相应病毒引物仅行PCR 扩增。本研究中所述呼吸道病毒序列、靶点及片段长度(见表1)。RT-PCR 扩增:按DNase/RNase Free H2O 8μL+5x RT Buffer 4μL+RT primer mix 2μL+Reverse transcriptase1μL+Sample 5μL 的比例共20μL,在PCR 管内加入试剂和样品以进行目的片段反转录,混匀后按48℃1min、42℃60min、95℃5min 温度孵育,4℃保存;按10×PCR Buffer 2μL+25mmol/L MgCl24μL+PCR primer mix 2μL+Solution X 2μL+TaqDNA Polymerase 0.7μL+RT 产物9.3μL 的比例共20μL,在另一PCR 管内加入试剂和样品以进行目的片段的PCR,混匀后按94℃1min、94℃ 30min、60℃ 30min、70℃ 1min 进行热循环反应,重复35 次,70℃1min,4℃保存。根据病毒检验结果阳性或阴性将其分为阳性组与阴性组。(5)炎症细胞因子测定:抽取所有患者清晨空腹时静脉血3~5mL,以2500r/min 离心15min,收集上清置于-30℃冰箱保存,用于检测肿瘤坏死因子-α(TNF-α)、调节活化正常T 细胞表达和趋化因子(RANTES)、干扰素诱导蛋白(IP-10)、干扰素-γ(INF-γ)、可溶性白细胞介素-2 受体(sIL-2R)、IL-8、IL-6 水平。均采用定量酶联检测法进行检测(海森雄科技实业有限公司),需严格按照说明书进行操作。
1.4 统计学方法 应用SPSS 22.0 软件分析所有数据,符合正态分布的计量资料用均数±标准差()表示,偏态分布定量资料采用M(P25,P75)进行描述,两组间样本均数比较采用t 检验表示;多组样本均数间比较采用方差分析,组间两两比较用LSD 法表示,计数资料采用χ2检验表示;采用Spearman 相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 病毒检测结果 102 例患者共39 例经病毒检测为阳性,阳性率为38.24%(39/102)。其中最为常见的病毒为A 型流感病毒共15 例,阳性率为38.46%(15/39),以9 月—次年1 月为高发期;其次为鼻病毒共11 例,阳性率为28.21%(11/39),以7—11 月为高发;再次为人偏肺病毒5 例,阳性率为12.82%(5/39),以12 月—次年1 月为高发;副流感病毒3 型2例,阳性率为5.13%(2/39),在5 月与10 月发现;呼吸道合胞病毒2 例,在11 月与12 月发现;冠状病毒OC43 型1 例,在4 月发现;肠道病毒1 例,在11 月发现;腺病毒1 例,在3 月发现。其中发生同时感染鼻病毒伴博卡病毒和鼻病毒伴流感病毒A 型患者2例,分别发生在4 月与3 月。
2.2 一般情况比较 两组患者年龄、性别、吸烟、体质指数、使用ICS、高血压、冠心病、心律失常、mMRC评分、WBC、NEUT、EOSC、ALT、SCr、CD4+比较,差异无统计学意义(P>0.05);两组住院时间、糖尿病、肺功能指标(FEV1/FVC、FEV1%)、发热、CAT 评分及CD8+比较,差异有统计学意义(P<0.05),见表2。

表1 呼吸道病毒序列、靶点及片段长度[6-7]
2.3 炎性细胞因子比较 病毒阳性组患者血清IL-6、IL-8、IP-10、RANTES、sIL-2R、INF-γ、TNF-α 及CRP 水平均高于病毒阴性组,但两组INF-γ 相比,差异无统计学意义(P>0.05),其他差异有统计学意义(P 均<0.05)。见表3。
2.4 相关性分析 FEV1%、FEV1/FVC、糖尿病、发热、CAT 评分、CD4+、IP-10、sIL-2R、TNF-α 水平与病毒阳性呈负相关(r=-0.452、-0.552、-12.987、-0.672、-0.563、-0.872、-0.982、-0.972、-7.372,P 均<0.001)。
3 讨论
慢性阻塞性肺疾病是呼吸科常见的一种慢性炎症性疾病,受呼吸道感染的影响会加重病情,常见的病原体为病毒[8]。由于呼吸道病毒的分布与季节性呈正相关,本研究为减少季节性分布造成的偏倚,设置研究时间为2 年。本研究结果显示,慢性阻塞性肺疾病急性加重期患者病毒检测阳性率为38.24%,其中最为常见的是流感病毒A 型,其次为鼻病毒。本研究结果与杜小兵等[9]及赵春柳等[10]研究相似。稳定期的慢性阻塞性肺疾病患者可检出病毒;而急性加重期患者痰液经检测可观察到病毒核酸,且伴严重的气促、咳嗽、咳痰及发热等症状。本研究结果显示,病毒阴性组的住院时间、糖尿病、肺功能指标(FEV1/FVC、FEV1%)、发热、CAT 评分及CD8+均优于病毒阳性组(P<0.05),提示糖尿病、发热、稳定期CAT 评分可增加病毒感染风险,而肺功能指标(FEV1/FVC、FEV1%)降低、CD8+细胞比例下降,延长住院时间,则易导致稳定期慢性阻塞性肺疾病患者感染病毒,加重病情,不利于康复。
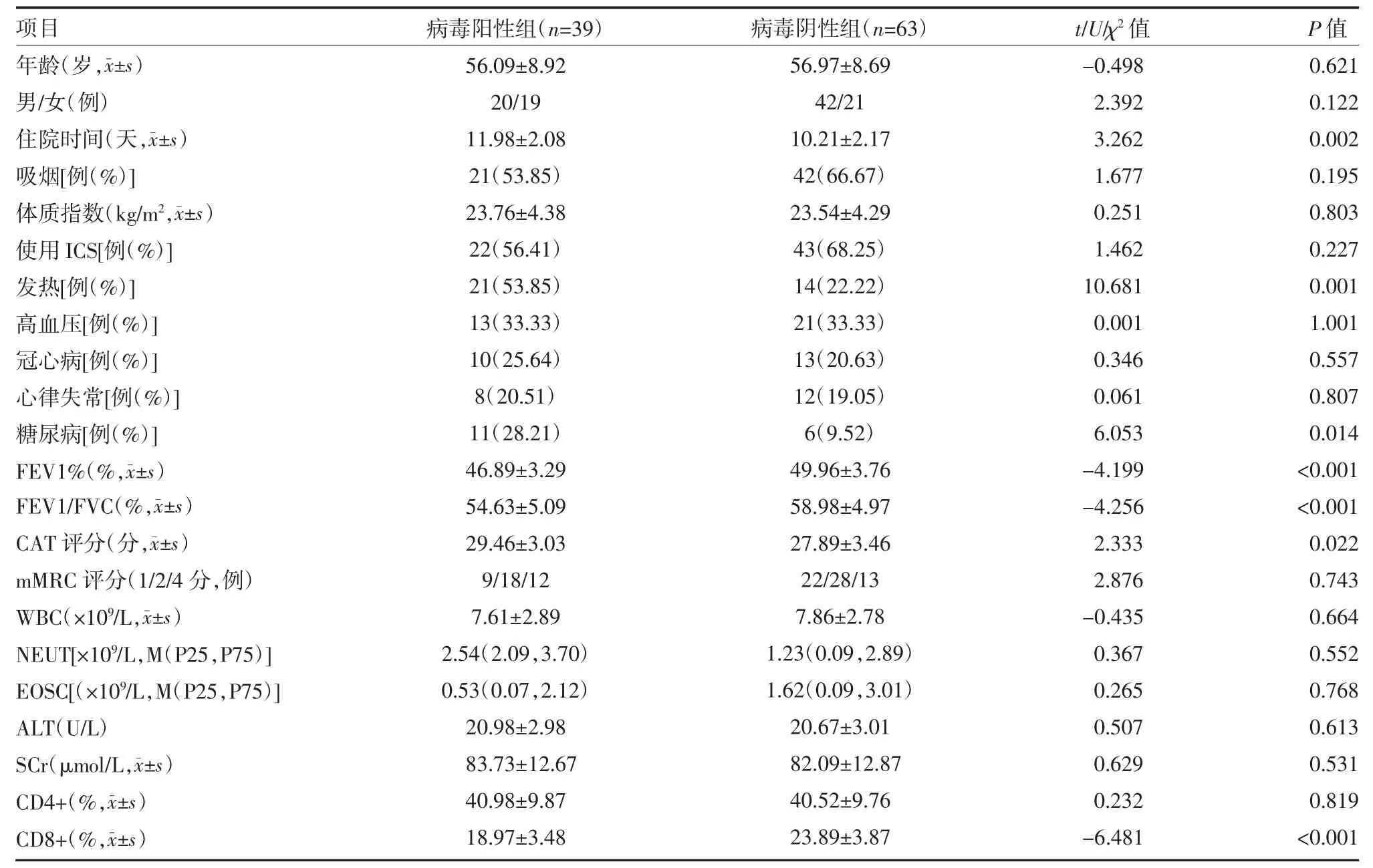
表2 两组慢性阻塞性肺疾病急性加重期患者一般资料比较
表3 两组慢性阻塞性肺疾病急性加重期患者血清炎性细胞因子比较()

表3 两组慢性阻塞性肺疾病急性加重期患者血清炎性细胞因子比较()
注:IL-6 为白介素-6;IL-8 为白介素-8;IP-10 为干扰素诱导蛋白;RANTES 为趋化因子;sIL-2R 为可溶性白细胞介素-2 受体;INF-γ 为干扰素-γ;TNF-α 为肿瘤坏死因子-α;CRP 为C 反应蛋白
Kido 等[11]通过研究证实,慢性阻塞性肺疾病患者肺部产生的炎症可转移至血液且可随血液在体内循环,形成系统性炎症反应。炎症反应中的重要组成部分为细胞因子,各个细胞因子在免疫系统中发挥不同的作用,在慢性阻塞性肺疾病急性加重期以急性呼吸道病毒感染为主。在炎症因子中IL-6 属于白细胞介素的一种,由巨噬细胞产生,参与免疫反应的细胞增殖、分化并提高其功能[12];IL-8 是趋化因子家族的一种细胞因子,参与和调节机体内生殖生理和病理过程[13];IP-10 是CXC 趋化因子家族的一员,可与相应的CXCR3 受体相互作用,参与抗病毒、活化吞噬细胞等作用[14]。sIL-2R 是一种复合性粘蛋白,可仰制已活化的T 细胞的克隆化扩增[15]。TNF-α 由单核-巨噬细胞产生,具有广泛的生物活性,可促使炎症细胞黏附,从而导致大量的活性氧自由基产生,对机体造成氧化损伤,并可释放IL-6 及IL-8 等炎性因子,增加机体的炎症反应[16]。本研究结果显示,病毒阳性组的IL-6、IL-8、IP-10、RANTES、sIL-2R、TNFα 及CRP 均高于病毒阴性组,提示慢性阻塞性肺疾病急性加重期在呼吸道病毒感染后系统性炎症水平明显升高。
Sithisarn 等[17]研究提示,IP-10 水平与所感染病毒量具有一定的相关性;Ng 等[18]研究则证实,IP-10水平越高则患者病毒感染后的病情越严重。由于病毒感染初期的临床症状并不明显,患者就诊不及时,且病毒阳性组血清IP-10 水平明显高于病毒阴性组,故病毒阳性导致的病情更严重。由于本研究未对病毒定量检测,故无法深入分析病毒载量高低的问题。另一方面本研究中sIL-2R 升高,这可能是由于病毒感染后导致淋巴细胞的活化造成的。本研究相关性分析结果显示,FEV1、FEV1/FVC、糖尿病、发热、CAT 评分、血清CD4+、IP-10、sIL-2R、TNF-α 水平与病毒阳性呈负相关,提示呼吸道病毒及炎症细胞因子会导致肺功能下降,从而影响慢性阻塞性肺疾病急性加重期的病情,且三者之间具有一定的相关性。
总而言之,呼吸道病毒、炎症细胞因子、肺功能在慢性阻塞性肺疾病急性加重期均具有一定的诊断价值,且三者之间具有一定的相关性。
