妊娠期肝内胆汁淤积症孕妇凝血功能及妊娠结局的变化
2020-09-21陈小芸李建华胡继芬通信作者
陈小芸,李建华,胡继芬(通信作者)
福建医科大学附属第一医院 (福建福州 350005)
妊 娠 期 肝 内 胆 汁 淤 积 症(intrahepatic cholestasis of pregnancy,ICP)是孕中、晚期特有的并发症,典型症状为无皮肤损伤的不明原因瘙痒,生化检测血清总胆汁酸升高,可造成产后出血、胎儿窘迫、早产、羊水胎粪污染、不可预测的突发胎死宫内等[1]。目前,该病病因尚不明确,可能与女性激素、遗传、免疫及环境等有关。有研究发现,由于ICP 孕妇血液流变学发生异常改变,导致其凝血功能受到影响,可能增加产后出血或血栓事件的发生风险[2-3]。本研究旨在探讨ICP 孕妇凝血功能及妊娠结局的变化,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2019年12月在福建医科大学附属第一医院产科住院分娩的92例ICP 孕妇(单胎妊娠)作为病例组,并将其分为重度ICP 组(23例)和轻度ICP 组(69例)两亚组。纳入标准及分度标准:符合2015年中华医学会妇产科学分会产科学组制定的《妊娠期肝内胆汁淤积症诊疗指南》中的疾病相关诊断标准[4],即出现其他原因无法解释的皮肤瘙痒;空腹血总胆汁酸≥10 μmol/L,可伴有肝功能异常;皮肤瘙痒和肝功能异常在产后恢复正常;轻度ICP 血清总胆汁酸10~40 μmol/L,临床症状以皮肤瘙痒为主,无其他症状;重度ICP 血清总胆汁酸≥40 μmol/L,瘙痒严重,伴其他情况,如妊娠高血压等。排除标准:合并非胆汁淤积引起的皮肤病、妊娠特异性皮炎、过敏反应、尿毒症性瘙痒等瘙痒性疾病的孕妇;存在病毒性肝炎(甲、乙、丙、丁、戊型肝炎)、病毒感染(巨细胞病毒、EB 病毒)、肝胆系统基础疾病(胆囊结石等)、自身免疫性肝炎、急性脂肪肝、子痫前期(HELLP 综合征)药物性肝损害等其他引起肝功能异常原因的孕妇;合并呼吸系统、消化系统、心血管系统、神经系统等严重内外科疾病的孕妇;非单胎妊娠的孕妇;非自然受孕的孕妇。以系统随机抽样法选取同期在福建医科大学附属第一医院产科住院分娩的105名自然受孕健康孕妇作为对照组。3组年龄及初产妇占比比较,差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 3组一般资料比较
1.2 方法
收集病例组和对照组的临床资料及实验室指标,并对其凝血功能指标[凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、国际标准化比值(international normalized ratio,INR)]、血小板相关指标[血小板计数(platelet count,PLT)、血小板平均体积(mean platelet volume,MPV)、血小 板比积(plateletcrit,PCT)、平均血小板内容物浓度(mean platelet component,MPC)]、围生儿结局进行统计分析。检测方法:采集所有研究对象晨起空腹外周静脉血4 ml 于真空采血管内,运用全自动血凝分析仪(SYEMEX CS-5100)及全自动血液分析仪(SYEMEX ADVIA-2120i)测定凝血功能指标及血小板相关指标,并严格按照试剂盒及仪器的说明完成操作。
1.3 统计学处理
2 结果
2.1 凝血功能指标
重度ICP 组PT、APTT、INR 均高于对照组和轻度ICP组,差异有统计学意义(P<0.05);轻度ICP 组与对照组PT、APTT、INR 比较,差异无统计学意义(P>0.05);3组FIB 比较,差异无统计学意义(P>0.05),见表2。
2.2 血小板相关指标
3组MPV、PCT 比较,差异无统计学意义(P>0.05);轻度ICP 组的PLT 低于对照组,差异有统计学意义(P<0.05);重度ICP 组的MPC 低于对照组,差异有统计学意义(P<0.05),见表3。
表2 3组凝血功能指标比较(±s)

表2 3组凝血功能指标比较(±s)
注:与对照组比较,aP<0.05;与轻度ICP 组比较,bP<0.05;PT 为凝血酶原时间,APTT 为活化部分凝血活酶时间,FIB 为纤维蛋白原,INR 为国际标准化比值
组别 例数 PT(s) APTT(s) FIB(g/L) INR重度ICP 组 23 10.96±0.70ab 28.27±5.78ab 4.10±1.20 0.10±0.10ab轻度ICP 组 69 10.87±0.56 26.41±2.57 4.12±0.75 0.95±0.48对照组 105 10.93±0.60 26.24±2.61 4.04±0.72 0.95±0.53
表3 3组血小板相关指标比较(±s)
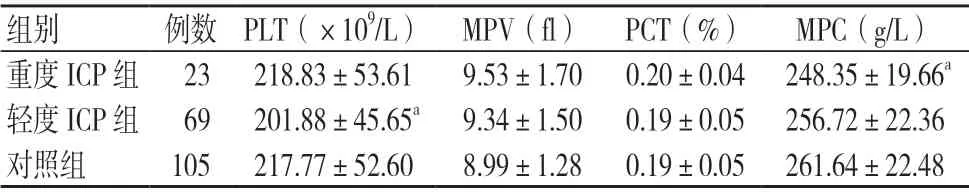
表3 3组血小板相关指标比较(±s)
注:与对照组比较,aP<0.05;PLT 为血小板计数,MPV 为血小板平均体积,PCT 为血小板比积,MPC 为平均血小板内容物浓度
组别 例数 PLT(×109/L) MPV(fl) PCT(%) MPC(g/L)重度ICP 组 23 218.83±53.61 9.53±1.70 0.20±0.04 248.35±19.66a轻度ICP 组 69 201.88±45.65a 9.34±1.50 0.19±0.05 256.72±22.36对照组 105 217.77±52.60 8.99±1.28 0.19±0.05 261.64±22.48
2.3 围生儿并发症
重度ICP 组新生儿窒息发生率高于对照组,差异有统计学意义(P<0.05);重度ICP 组与轻度ICP 组新生儿窒息发生率比较,差异无统计学意义(P>0.05);轻度ICP 组和重度ICP 组早产儿发生率均高于对照组,差异有统计学意义(P<0.05);重度ICP 组早产儿发生率高于轻度ICP 组,差异有统计学意义(P<0.05);3组羊水污染发生率比较,差异无统计学意义(P>0.05),见表4。

表4 3组围生儿并发症发生情况比较[例(%)]
3 讨论
ICP 是妊娠特有的并发症,可导致严重的母婴并发症,如早产、产后出血、胎儿宫内窘迫及突发死亡等,危及孕妇生命[5],因此,孕期应重视ICP 的筛查、诊断及治疗,以减少不良母婴结局的发生。
本研究结果显示,重度ICP 组PT、APTT、INR 均高于对照组和轻度ICP 组(P<0.05),而轻度ICP 组PT、APTT、INR 未见明显改变,且3组FIB 比较无显著差异。王敏[6]的研究也发现重度ICP 孕妇PT 明显延长,FIB 未见明显改变,但其研究未发现APTT 的改变。以上研究均提示重度ICP 可对凝血功能造成显著的影响,可能通过影响外源性及内源性凝血系统发挥作用,增加出血风险,导致产后出血。PT是外源性凝血系统功能的重要监测指标,其延长多见于凝血因子Ⅱ、Ⅴ、Ⅶ、Ⅹ及纤维蛋白原的缺乏;而APTT 是内源性凝血途径的重要监测指标,其延长可见于凝血因子Ⅷ、Ⅸ和Ⅺ的减少[7]。维生素K 是由茶脂类化合物组成的脂溶性维生素,是合成凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ的必要成分,其吸收必须伴随肠道脂性物质(如胆盐和脂肪等)的吸收。ICP 孕妇因脂肪吸收欠佳,且肝脏胆盐分泌减少,影响维生素K 的吸收,导致维生素K 缺乏,最终阻碍凝血因子的合成,使得APTT、PT 延长,造成凝血功能障碍,从而增加出血风险[8],因此,应加强对重度ICP 孕妇凝血功能的监测,警惕产后出血风险;但对于是否使用维生素K 纠正凝血功能,预防产后出血,目前仍无定论,有待今后更多的临床试验进一步证实。
本研究结果显示,重度ICP 组新生儿窒息发生率及早产儿发生率明显升高。Glantz 等[9]做了大数据研究,发现ICP 孕妇胆汁酸水平与胎儿早产、新生儿窒息等不良围生儿结局成正相关,与张雅丽等[10]的研究结果相似,目前认为其可能与高浓度的胆汁酸沉积在胎盘绒毛血管,导致血管痉挛,影响胎盘血供,降低胎儿血氧分压有关[11];也有研究认为,可能由于ICP 孕妇凝血功能异常而出现微循环障碍,影响胎盘血供,加之细胞炎症因子的释放[12],从而造成胎儿宫内窘迫、新生儿窒息、早产等风险增加。有研究发现,ICP 孕妇经过积极的降胆汁酸治疗,有助于改善早产、胎儿宫内窘迫、新生儿窒息等围生儿不良结局[13],因此,积极治疗ICP 孕妇,尤其是重度ICP 孕妇,降低胆汁酸水平,对于改善围生儿不良结局具有重要的作用。
本研究结果显示,重度ICP 孕妇PLT、MPV、PCT 未见明显改变,MPC 较健康孕妇降低,与唐海燕等[14]的研究结果不同,其发现与健康孕妇比较,ICP 孕妇PLT 降低,MPV升高,两研究结果不同可能与不同临床中心和样本量有关,有待多中心、大样本的研究进一步明确。但临床发现,只有当血小板的绝对值下降到一定程度(如<50×109/L),才可能对凝血功能造成明显的影响。目前,相关研究结果都显示ICP 孕妇血小板数量较健康孕妇无显著下降,由此推测ICP 孕妇血小板相关指标的改变与凝血功能改变并无绝对相关性,当然,此结论有待更大样本量的进一步研究。
综上所述,重度ICP 孕妇凝血功能改变明显,易导致产后出血,增加围生儿不良结局的发生风险,临床需高度重视,于围生期给予积极干预,以显著改善ICP 孕妇的妊娠结局。
[参考文献]
[1] Ovadia C, Seed PT, Sklavounos A, et al. Association of adverse perinatal outcomes of intrahepatic cholestasis of pregnancy with biochemical markers: results of aggregate and individual patient data meta-analyses [J]. Lancet, 2019, 393(10174): 899-909.
[2] Günaydin B, Bayram M, Altuğ M, et al. Retrospective analysis of maternal, fetal, and neonatal outcomes of intrahepatic cholestasis of pregnancy at Gazi University[J]. Turk J Med Sci, 2017, 47(2): 583-586.
[3] 张丽娟,张凤华,汤丽丽,等. 妊娠期肝内胆汁淤积症与胎儿损伤[J].中南大学学报(医学版), 2013,38(6):645-652.
[4] 贺晶,杨慧霞,段涛,等. 妊娠期肝内胆汁淤积症诊疗指南(2015)[J]. 临床肝胆病杂志,2015,31(10):1575-1578.
[5] Kawakita T, Parikh LI, Ramsey PS, et al.Predictors of adverse neonatal outcomes in intrahepatic cholestasis of pregnancy[J]. Am J Obstet Gynecol, 2015, 213(4): 570.e1-570.e8.
[6] 王敏.妊娠期肝内胆汁淤积症血小板及凝血指标对妊娠结局影响[J].实用中西医结合临床,2018,18(3):93-95.
[7] Babiker HI, Awooda HA, Abdalla SE . Prothrombin Time, Activated partial Thromboplastin Time and Platelets Count in Pregnant Females and Postpartum Period with Deep Venous Thrombosis[J]. International Journal of Hematological Disorders, 2014, 1(1): 41-44.
[8] Smith DD, Rood KM. Intrahepatic Cholestasis of Pregnancy[J]. Clin Obstet Gynecol, 2020,63(1): 134-151.
[9] Glantz A, Marschall HU, Mattsson LA. Intrahepatic cholestssis of pregnancy: Relationships between bile acid levels and fetal complication rates[J]. Hepatology, 2004, 40(2): 467-474.
[10] 张雅丽,马颖,郭咏梅. 妊娠期产妇肝内胆汁淤积症对围产儿预后因素分析[J]. 肝脏, 2019,24(5):588-590.
[11] Geenes V, Chappell LC, Seed PJ, et al. Association of severe intrahepatic cholestasis of pregnancy with adverse pregnancy outcomes: a prospective population-based case-control study[J].Hepatology, 2014, 59(4): 1482-1491.
[12] Kirbas A, Daglar K, Timur H, et al. Maternal circulating levels of irisin in intrahepatic cholestasis of pregnancy[J]. J Matern Fetal Neonatal Med, 2016, 29(21): 3483-3487.
[13] 李侠,肖维.丁二磺酸腺苷蛋氨酸联合熊去氧胆酸对妊娠期肝内胆汁淤积症患者胆汁酸、肝功能及妊娠结局的影响[J].中国肝脏病杂志(电子版),2019,11(4):55-60.
[14] 唐海燕,吴志辉,翁玉英,等.妊娠期肝内胆汁淤积症血小板和凝血功能变化[J].中国卫生标准管理,2019,10(5):86-88.
