新型异噁唑山酮素骨架螺环氧化吲哚类化合物的合成
2020-09-21景德红韦启迪刘雄利
景德红, 韦启迪, 刘雄利
(1. 黔西南民族职业技术学院,贵州 兴义 562400; 2. 贵州大学 贵州省药食同源植物资源开发工程技术研究中心,贵州 贵阳 550025)
根据药物设计的活性骨架拼接和迁越原理[1],把两个或多个具有生物活性骨架拼接成一个潜在生物活性的多骨架分子在有机化学和医药化学中是极其重要的研究领域。山酮素骨架普遍存在天然产物和药物分子中。例如: 天然产物分子ErgochromeDD,Diversonol,Desoxydiversonol,ApplanatinB和IsocochlioquinoneA共有一个山酮素骨架单元,这些化合物在解除病痛、经济发展中起着重大作用[2-4],螺环氧化吲哚广泛存在天然产物和合成药物分子中[5-7]吸引了许多化学工作者及医药化学团队的广泛关注,例如,天然产物活性小分子Satavaptan表现明显的生物活性。异噁唑基团普遍存在于天然产物和药物分子中[8-11]。如Cloxacillin,Muscimol,Isoxicam和Leflunomide等,在生物制药领域有重要应用价值。因此,将异噁唑和山酮素骨架拼接到螺环氧化吲哚骨架上,合成一系列具备潜在生物活性的异噁唑山酮素骨架螺环氧化吲哚类衍生物,可以为生物活性筛选提供物质基础,对药物的筛选和制药行业具有重要的应用价值。
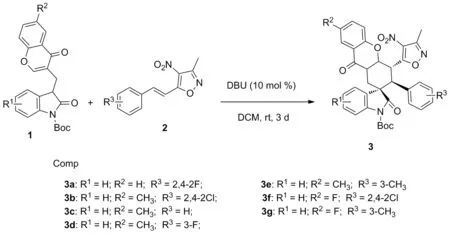
Scheme 1
以色酮-氧化吲哚合成子1与硝基异噁唑苯乙烯2,在催化剂DBU作用下,经分子间Michael加成,分子内Michael加成环化反应,获得了7个新型的异噁唑山酮素骨架螺环氧化吲哚类化合物3a~3g,产率87%~93%,dr=8/1~15/1, 其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker-500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.2 合成
3a~3g的合成(以3a为例)
依次加入氧化吲哚-色酮合成子78.2 mg(0.20 mmol), (E)-硝基异恶唑烯烃化合物63.8 mg(0.24 mmol),催化剂DBU 3.04 mg(10 mol %,0.02 mmol) 和二氯甲烷3.0 mL,室温下反应3 d(TLC监测)。经柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=4/1]纯化得119.6 mg化合物3a。
用类似方法合成3b~3g。
3a: 白色固体, 产率91%, m.p.172.0~173.8 ℃,dr=10/1;1H NMRδ: 1.64(s, 9H), 2.18~2.23(m, 1H), 2.46(s, 3H), 2.68~2.72(m, 1H), 4.12~4.18(m, 1H), 4.51(d,J=10.0 Hz, 1H), 4.92(br s, 1H), 5.76(br s, 1H), 6.82(d,J=6.8 Hz, 1H), 6.96(s, 1H), 7.00~7.07(m, 2H), 7.14~7.17(m, 1H), 7.20~7.24(m, 1H), 7.44~7.48(m, 3H), 7.52(d,J=6.4 Hz, 1H), 7.86~7.88(m, 1H);13C NMRδ: 11.7, 28.1, 29.7, 32.3, 43.1, 51.0, 80.0, 85.0, 114.5, 116.5, 120.5, 122.1, 123.6, 124.3, 127.1, 127.2, 127.8, 128.9, 129.2, 129.5, 131.5, 134.4, 135.0, 136.2, 138.2, 148.3, 155.7, 160.1, 160.3, 171.0, 176.6, 192.0; HR-MS(ESI-TOF)m/z: Calcd for C35H29N3O8F2Na{[M+Na]+}680.181 5, found 680.181 9。
3b: 白色固体, 产率93%, m.p.174.2~176.2 ℃,dr=10/1;1H NMRδ: 1.64(s, 9H), 2.16~2.21(m, 1H), 2.30(s, 3H), 2.45(s, 3 H), 2.67~2.71(m, 1H), 4.09~4.14(m, 1H), 4.51(d,J=6.0 Hz, 1H), 4.86~4.90(m, 1H), 5.75(br s, 1H), 6.71(d,J=6.8 Hz, 1H), 6.96(s, 1H), 7.00~7.02(m, 1H), 7.14~7.17(m, 1H), 7.20~7.23(m, 1H), 7.26~7.28(m, 1H), 7.46~7.48(m, 2H), 7.52(d,J=6.4 Hz, 1H), 7.65(s, 1H);13C NMRδ: 11.7, 20.4, 28.1, 29.7, 32.4, 43.1, 51.1, 80.0, 85.0, 114.5, 117.6, 120.1, 123.6, 124.3, 126.6, 127.2, 127.9, 128.9, 129.2, 129.5, 131.5, 131.6, 134.4, 135.0, 137.2, 138.2, 148.3, 155.6, 158.2, 171.1, 176.6, 192.2; HR-MS(ESI-TOF)m/z: Calcd for C36H31N3O8Cl2Na{[M+Na]+}726.1380, found 726.1385。
3c: 白色固体, 产率88%, m.p.172.5~174.1 ℃,dr=8/1;1H NMRδ: 1.59(s, 9H), 2.10~2.16(m, 1H), 2.31(s, 3H), 2.40(s, 3H), 2.70~2.74(m, 1H), 3.65~3.68(m, 1H), 4.10~4.14(m, 1H), 4.76~4.81(m, 1H), 5.83(br s, 1H), 6.72(d,J=6.8 Hz, 1H), 6.92~6.98(m, 4H), 7.18~7.20(m, 2H), 7.26~7.28(m, 2H), 7.35~7.36(m, 1H), 7.47~7.49(m, 1H), 7.66(s, 1H);13C NMRδ: 11.7, 20.5, 26.9, 28.1, 29.7, 31.7, 43.4, 51.2, 80.2, 84.5, 114.9, 117.7, 120.1, 122.3, 124.6, 126.6, 128.1, 128.8, 129.6, 131.5, 134.2, 137.2, 138.8, 148.5, 155.6, 158.4, 171.9, 176.4, 192.5, 222.7; HR-MS(ESI-TOF)m/z: Calcd for C36H33N3O8Na{[M+Na]+}658.2160, found 658.2164。
3d: 白色固体, 产率90%, m.p.172.2~173.4 ℃,dr=9/1;1H NMRδ: 1.60(s, 9H), 2.10~2.15(m, 1H), 2.31(s, 3H), 2.43(s, 3H), 2.71~2.75(m, 1H), 3.67~3.69(m, 1H), 4.09~4.15(m, 1H), 4.74~4.78(m, 1H), 5.78(br s, 1H), 6.68~6.73(m, 3H), 6.90(br s, 1H), 7.20~7.22(m, 2H), 7.26~7.28(m, 1H), 7.34~7.36(m, 1H), 7.52~7.54(m, 1H), 7.66(s, 1H);13C NMRδ: 11.6, 20.4, 26.9, 28.0, 29.7, 31.6, 43.3, 51.1, 80.1, 84.8, 114.9, 115.1, 117.7, 120.1, 122.2, 124.7, 126.6, 129.0, 129.2, 131.6, 136.7, 136.8, 137.2, 138.8, 148.5, 155.6, 159.9, 171.4, 176.1, 192.2, 222.6; HR-MS(ESI-TOF)m/z: Calcd for C36H32N3O8FNa{[M+Na]+}676.2066, found 676.2063。
3e: 白色固体, 产率87%, m.p.174.5~176.2 ℃,dr=10/1;1H NMRδ: 1.60(s, 9H), 2.10~2.15(m, 1H), 2.30(s, 3H), 2.40(s, 3H), 2.69~2.73(m, 1H), 3.59~3.62(m, 1H), 4.11~4.17(m, 1H), 4.76~4.81(m, 1H), 5.80(br s, 1H), 6.72(d,J=6.8 Hz, 1H), 6.77(s, 2H), 7.17~7.19(m, 2H), 7.25~7.27(m, 1H), 7.34~7.36(m, 1H), 7.48~7.50(m, 1H), 7.65(s, 1H);13C NMRδ: 11.7, 20.5, 21.1, 26.9, 28.1, 29.7, 31.7, 43.4, 51.2, 80.5, 84.5, 114.8, 117.7, 120.2,122.3, 124.5, 126.6, 127.8, 128.7, 128.8, 129.7, 131.5, 134.0, 137.2, 138.8, 148.6, 155.5, 158.4, 172.0, 176.4, 192.5, 222.7; HR-MS(ESI-TOF)m/z: Calcd for C37H35N3O8Na{[M+Na]+}672.2316, found 672.2317。
3f: 白色固体, 产率93%, m.p.171.6~173.4 ℃,dr=15/1;1H NMRδ: 1.57(s, 9H), 2.08~2.15(m, 1H), 2.38(s, 3H), 2.60~2.65(m, 1H), 4.03~4.11(m, 1H), 4.43(d,J=13.2 Hz, 1H), 4.81~4.87(m, 1H), 5.65~5.70(m, 1H), 6.73~6.76(m, 1H), 6.89(s, 1H), 6.92~6.95(m, 1H), 7.06~7.17(m, 4H), 7.38(s, 1H), 7.40(s, 1H), 7.44(s, 1H), 7.46(s, 1H);13C NMRδ: 11.7, 28.1, 29.7, 32.3, 43.1, 51.0, 80.2, 85.1, 112.0, 114.5, 119.6, 119.7, 123.6, 123.8, 124.4, 127.2, 127.7, 128.9, 129.3, 129.5, 131.3, 134.5, 135.0, 138.2, 148.3, 156.3, 158.7, 170.8, 176.6, 191.2; HR-MS(ESI-TOF)m/z: Calcd for C35H28N3O8FCl2Na{[M+Na]+}730.1130, found 730.1130。
3g: 白色固体, 产率90%, m.p. 171.5~173.2 ℃,dr=11/1;1H NMRδ: 1.53(s, 9H), 1.97(s, 3H), 2.02~2.09(m, 1H), 2.33(s, 3H), 2.62~2.67(m, 1H), 3.51~3.55(m, 1H), 4.07~4.13(m, 1H), 4.72~4.78(m, 1H), 5.70~5.76(m, 1H), 6.71~6.76(m, 4H), 7.08~7.14(m, 4H), 7.25~7.27(m, 1H), 7.40~7.46(m, 2H);13C NMRδ: 11.6, 14.2, 21.1, 28.0, 31.5, 41.3, 43.3, 51.1, 80.7, 84.5, 111.9, 112.1, 114.8, 119.6, 119.7, 120.9, 121.0, 122.2, 123.5, 124.5, 127.8, 128.8, 129.4, 133.8, 137.7, 138.8, 148.5, 155.5, 156.5, 157.7, 171.6, 176.3, 191.5; HR-MS(ESI-TOF)m/z: Calcd for C36H32N3O8FNa{[M+Na]+}676.2066, found 676.2067。
2 结果与讨论
2. 1 合成
在无催化剂作用下,反应无法进行(表1),对催化剂进行筛选后,发现在碱性更强的催化剂DBU下,3 d反应完全,产率达到91%。在碱性稍(DABCO, Et3N和DMAP),反应延长到4 d,产率明显降低。

Scheme 2
通过对底物扩展,发现该反应在DBU催化下,活性较高,在溶剂二氯甲烷中原料能完全溶解, 反应3 d基本完成(TLC监测), 产率为87%~93%,dr=8/1~15/1。尤其是R3为吸电子基团时,反应活性明显增大,产率最高达到93%(3b和3f)。

表1 反应条件的优化
2.2 反应机理
基于实验结果和文献[12-16],我们推测的反应机理如下图2:在有机碱DBU的作用下,色酮-氧化吲哚合成子1与硝基异噁唑苯乙烯2首先发生分子间Michael加成,再发生分子内Michael加成环化反应, 得目标产物异噁唑山酮素骨架螺环氧化吲哚类化合物3。
合成了7个新型的异噁唑山酮素骨架螺环氧化吲哚类化合物3a~3g,产率87%~93%,dr=8/1~15/1, 其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征,该化合物骨架含有连续5个立体中心,一个螺环季碳中心。
