绿豆肽对脂多糖诱导急性肺损伤小鼠肺组织的保护作用
2020-09-21刁静静刘妍兵李朝阳张丽萍
刁静静,刘妍兵,李朝阳,于 笛,左 锋,*,张丽萍
(1.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319;2.黑龙江八一农垦大学 农业农村部农产加工品质量监督检验测试中心,黑龙江 大庆 163319;3.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
绿豆(Vigna radiata(L.) Wilczek)具有清热、解毒、降胆固醇等功效,是我国最受消费者喜爱的食用豆之一。绿豆含有约20%~25%的蛋白质,其必需氨基酸组成与大豆、芸豆和粮农组织/世界卫生组织的参考蛋白质相比优势明显[1]。但是,我国对于绿豆工业化加工利用多是制取淀粉,而其副产物绿豆蛋白则多作为饲料或低值化产品进行处理,造成了优质资源的浪费。近20 年来的研究发现,从食源性蛋白质中获得的多肽具有较为广泛的生物活性功能,如抗氧化、降血压、降胆固醇、提高机体免疫力等[2-3],且食源性蛋白肽还不会对机体产生毒副作用,安全性高,逐渐引起国内外营养专家学者的关注[4]。研究发现绿豆蛋白经生物酶法处理后,其酶解产物可提高机体的缺氧耐受力和免疫力、血管紧张素转换酶抑制活性、降胆固醇等作用[5-6],但是,国内关于绿豆肽(mung bean protein hydrolysate,MBPH)抗炎作用的研究鲜有报道。已有研究显示,大豆、豌豆、羽扇豆等的蛋白水解产物具有抑制炎症的潜力。Vernaza等发现利用大豆水解物能够显著降低脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞RAW264.7中炎性标志物,如NO、诱导型一氧化氮合酶和前列腺素E2含量[7]。Millan-Linares等发现羽扇豆的蛋白质水解产物可以减弱THP-1巨噬细胞中促炎性细胞因子白介素-1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和NO的产生[8]。Ndiaye等发现豌豆水解物可通过抑制活化的巨噬细胞中NO、TNF-α和IL-6的产生发挥其抗炎作用[9]。急性肺损伤是肺部炎症疾病的一种典型代表,很多因素都会导致这种疾病的发生,而临床上多数是靠药物来缓解病情,尚无特效药和特效疗法,如果单靠药物在发病后再去治疗势必会对机体造成不良影响。许多研究探讨了绿豆肽的多种生物活性,但对于绿豆肽对细菌内毒素诱导的急性肺损伤的保护作用知之甚少。因此,本实验构建LPS诱导的急性肺损伤小鼠模型,研究绿豆肽对急性肺损伤小鼠的保护作用,以期明确绿豆肽是否具有极好的抗炎作用和效果,为绿豆功能性成分的开发和研究提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
SPF级C57 BL/6雄性小鼠72 只,6 周龄,体质量18~22 g,购自北京维通利华实验动物中心,生产许可证号:SCXK(京)2016-0011。
绿豆蛋白粉 山东招远温记食品有限公司;Alcalase 2.4 L 丹麦诺维信公司;IL-1β、IL-6、IL-10、干扰素γ(interferon γ,IFN-γ)等细胞因子酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 沈阳万类生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
细胞培养箱 上海玺恒实业有限公司;数显恒温水浴锅 常州荣冠实验分析仪器厂;超净工作台 郑州宏朗仪器设备有限公司;低速离心机 张家港市凯迪机械有限公司;高速冷冻离心机 北京时代北利离心机有限公司;电子显微镜 深圳市博视达光学仪器有限公司;ELX-800酶标仪 美国Bio-Tek仪器有限公司。
1.3 方法
1.3.1 绿豆肽的制备
绿豆肽实验室自制。将绿豆蛋白粉(蛋白质量分数80%)配制成底物质量分数为7%的溶液,用1 mol/L的NaOH溶液调pH值至9.0,加入1.0%(以底物质量计)Alcalase 2.4 L后于50 ℃水浴搅拌,用1 mol/L的NaOH溶液使pH值保持恒定,采用pH-stat法[6]测定水解度达到30%时终止酶解反应,调pH值至7.0,并边搅拌边迅速升温至100 ℃灭酶10 min,获得绿豆肽,然后经脱盐处理后冻干备用。采用反相高效液相色谱法测定得到95%以上的绿豆肽分子质量在1 000 Da以下。
1.3.2 动物实验
72 只小鼠随机分为6 组,分别为对照组、模型组(5 mg/kgmbLPS)以及MBPH低、中、高剂量组(MBPH剂量按照市售食源性蛋白多肽平均推荐剂量(按体质量60 kg的成人计)3.0 g/d(相当于0.05 g/(kgmb·d))的2.5、5 倍和10 倍设置,分别为125 mg/(kgmb·d)(MBPH-L组)、250 mg/(kgmb·d)(MBPH-M组) 和5 0 0 m g / ( k gmb· d ) ( M B P H - H组))、地塞米松(d e x a m e t h a s o n e,D E X)组(5 mg/(kgmb·d)DEX),每组12 只。各实验组均连续灌胃给药10 d,MBPH组灌胃给予小鼠低、中、高剂量绿豆肽,其他处理组灌胃相同体积的生理盐水。第11天,造模前1 h,DEX组经腹腔注射地塞米松磷酸钠,其他组注射相同体积的生理盐水,1 h后,经腹腔注射10%的戊巴比妥钠溶液(60 mg/kgmb)将小鼠麻醉,对照组鼻腔滴入100 μL生理盐水,其余组鼻腔滴入100 μL质量浓度为5 mg/mL的LPS。造模5 h将小鼠断颈处死,分别测定各处理组的炎症反应指标。
1.3.3 肺组织病理学切片形态观察
随机选取1.3.2节对照组、模型组、处理组中的小鼠进行肺组织苏木精-伊红(hematoxylin-eosin,HE)染色,观察小鼠在经LPS处理后肺组织炎性反应情况。
1.3.4 肺脏湿干质量比的测定
取小鼠肺脏用滤纸吸干表面水分和血液,称量得到肺脏湿质量。80 ℃恒温箱中干燥48 h,再次称量得到肺脏干质量。肺脏湿质量与干质量比即为湿干质量比(wet dry ratio,W/D),能够初步评估肺脏组织水肿程度。
1.3.5 肺泡灌洗液的制备
随机选取1.3.2节各处理组小鼠,打开胸腔,分离气管,将自制插管插入气管中并固定,向肺部注入4 ℃预冷的磷酸盐缓冲液,分3 次进行,每次0.5 mL,抽出的液体收集于1.5 mL离心管中。将肺泡灌洗液(bronchoalveolar lavage fluid,BALF)经4 ℃、3 000 r/min离心10 min,收集上清液,存放于-20 ℃冰箱中。
1.3.6 细胞计数
采用Wright-Giemsa法进行染色,取适量肺泡细胞悬液平铺于载玻片,室温干燥。滴加2~3 滴Wright-Giemsa染色液使其覆盖整个涂片。2 min后,向涂片中滴加等量的0.01 mol/L磷酸盐缓冲液(pH 6.4~6.8),轻轻摇动,使其与Wright-Giemsa染色液充分混匀,继续染色5 min。用流水缓慢冲洗涂片,晾干后镜检,每片至少计数200 个细胞。
1.3.7 BALF中细胞因子质量浓度的测定
取1.3.5节BALF上清液,采用ELISA法检测BALF中TNF-α、IFN-γ、IL-1β、IL-6、IL-10的质量浓度。
1.3.8 BALF中白蛋白质量浓度的测定
取1.3.5节BALF上清液,采用BCA法检测BALF中白蛋白质量浓度。
1.3.9 髓过氧化物酶活力测定
准确称取各处理组小鼠肺组织匀浆,采用ELISA试剂盒进行髓过氧化物酶(myeloperoxidase,MPO)活力的测定。
1.4 数据统计分析
所得数据均为3 次重复的平均值,用方差分析多参数检验方法进行统计学分析,P<0.05或P<0.01为差异有统计学意义。并采用SigmaPlot 12.0软件作图。
2 结果与分析
2.1 绿豆肽对急性肺损伤小鼠肺组织病理学切片形态的影响
肺组织的病理学可以反映LPS诱导小鼠急性肺损伤的严重程度[10-11]。由图1可知,经过HE染色后可以观察到对照组小鼠肺组织结构正常,肺泡壁完好,肺泡腔清晰可见,肺泡及肺间质无明显水肿现象,未观察到炎性细胞浸润。与对照组相比,模型组小鼠在鼻腔吸入LPS 5 h之后肺组织出现病理学变化,肺泡结构破坏、肺泡壁水肿、肺间质增厚、大量炎性细胞浸润。与模型组相比,MBPH低剂量组炎症程度有所减轻,但效果不明显;MBPH中、高剂量组肺泡结构较为完整,肺间质渗出减少,炎性细胞浸润程度明显减轻。结果表明,MBPH对LPS诱导的急性肺损伤具有一定的保护作用,且随着MBPH剂量的增加其恢复效果越好。

图 1 绿豆肽作用下的急性肺损伤小鼠病理学变化(×200)Fig. 1 Effect of MBPH on pathological changes of mice with ALI (× 200)
2.2 绿豆肽对急性肺损伤小鼠肺组织W/D的影响
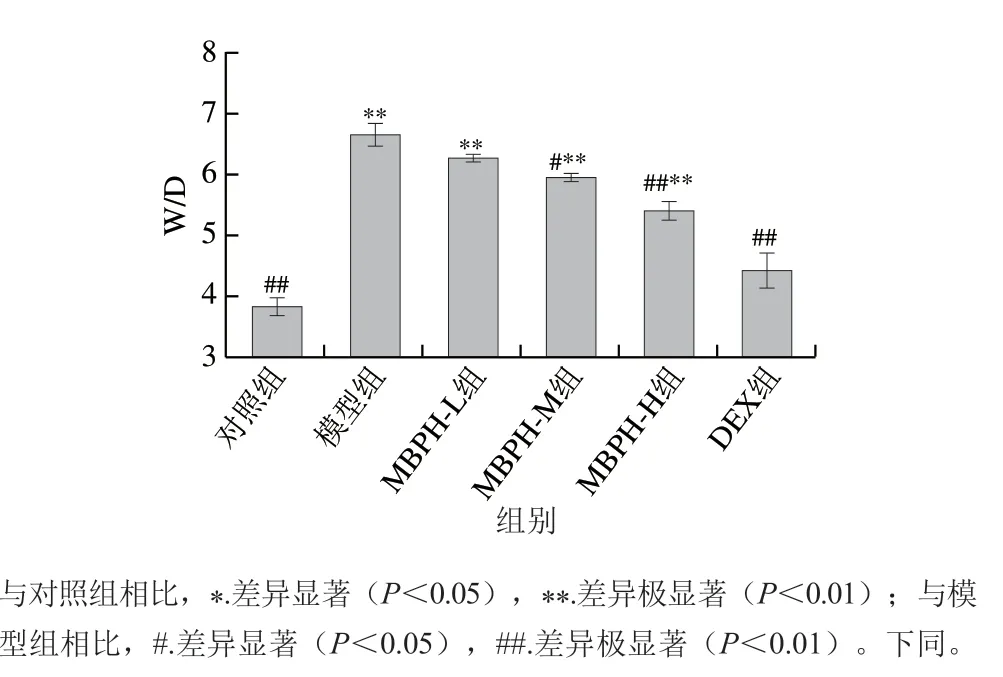
图 2 绿豆肽作用下的急性肺损伤小鼠肺W/D变化Fig. 2 Effect of MBPH on lung W/D weight ratio in mice with ALI
由图2可知,与对照组相比,模型组小鼠的W/D极显著增加(P<0.01)。与模型组相比,通过灌胃不同剂量的MBPH溶液,小鼠的W/D呈剂量依赖性显著降低,且高剂量效果最佳。结果表明,通过预先灌胃中、高浓度的MBPH能显著减轻急性肺损伤造成的肺水肿,说明绿豆肽对小鼠肺组织具有一定的保护作用。
2.3 绿豆肽对急性肺损伤小鼠肺组织MPO活力的影响
由图3可知,与对照组相比,模型组肺组织中MPO活力极显著增加(P<0.01)。与模型组相比,MBPH组小鼠肺组织中MPO活力显著下降(P<0.05,P<0.01),并且随着MBPH浓度的升高,MPO活力呈剂量依赖性降低。结果表明,MBPH对LPS诱导引起的小鼠肺组织MPO活力升高具有抑制作用,说明绿豆肽可减轻肺组织中中性粒细胞的聚集。
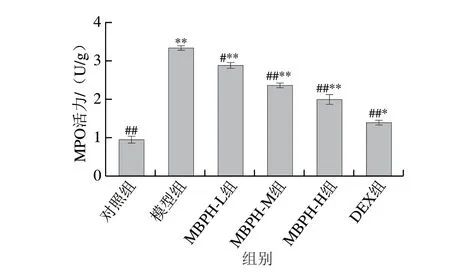
图 3 绿豆肽作用下的急性肺损伤小鼠肺组织中MPO活力变化Fig. 3 Effect of MBPH on MPO activity in lung tissue of ALI mice
2.4 绿豆肽对急性肺损伤小鼠BALF中细胞因子的影响
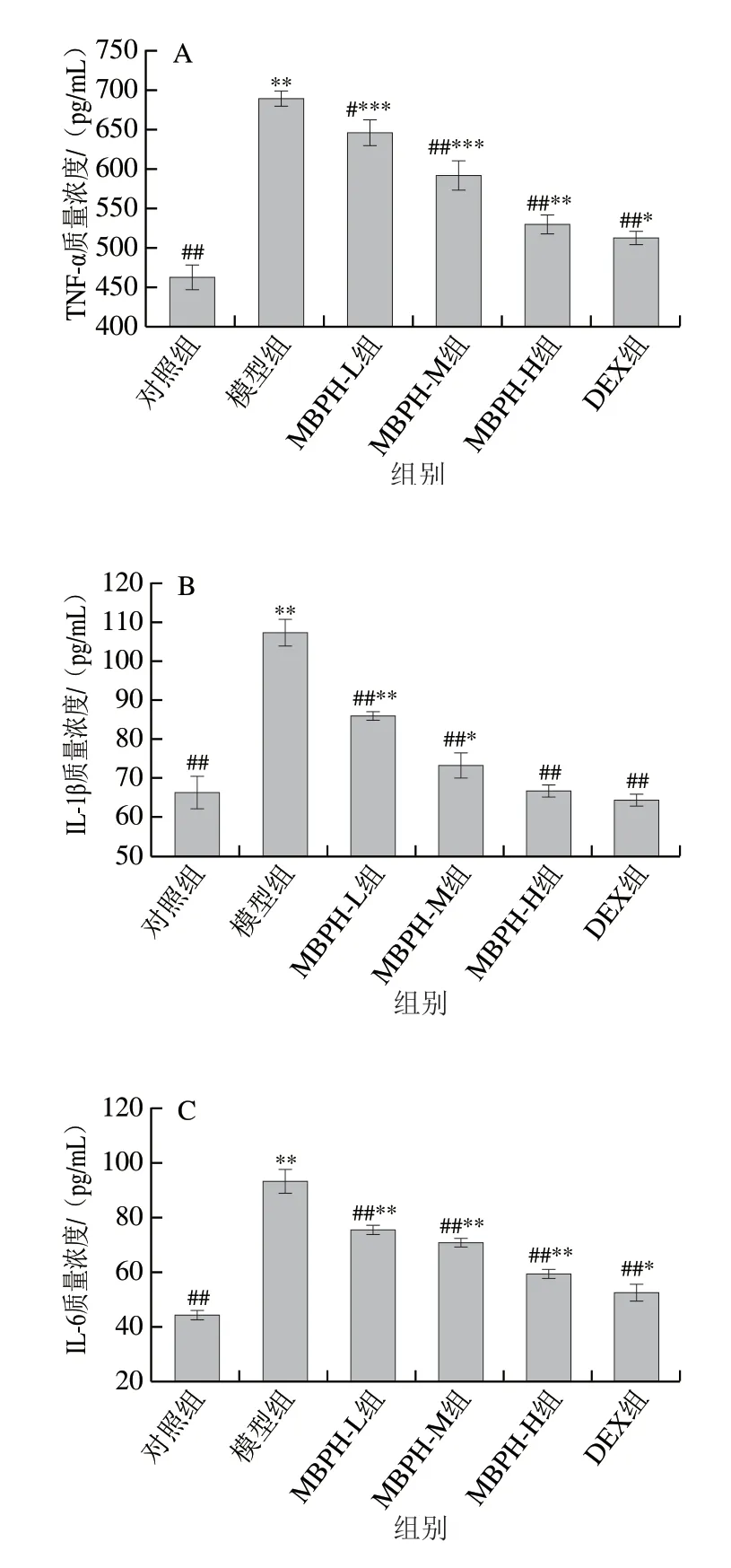

图 4 绿豆肽作用下的急性肺损伤小鼠BALF中细胞因子质量浓度变化Fig. 4 Effect of MBPH on cytokine concentrations in BALF of ALI mice
由图4可知,模型组的TNF-α、IL-1β、IL-6、I L-1 0 和I F N-γ 的质量浓度均显著高于对照组(P<0.05),MBPH处理则显著改善模型组炎症细胞因子和IL-10的表达,且呈剂量依赖性。不同剂量的MBPH均能降低小鼠BALF中TNF-α、IL-1β和IFN-γ的质量浓度,但是中、高剂量组的IL-1β和IFN-γ效果没有显著性差异。高剂量MBPH处理能显著降低小鼠BALF中IL-6质量浓度。IL-10是多功能抗炎性细胞因子,能够抑制多种炎症介质的生成从而减轻炎症损伤程度。不同剂量的MBPH处理均能下调BALF中IL-10的水平,但是随着MBPH剂量的升高,降低作用并不明显,且高剂量组的IL-10水平显著高于DEX组,这说明MBPH既可降低LPS诱导的炎症反应,又可改善机体的免疫状态。以上研究结果均表明绿豆肽可通过调节促炎因子和抗炎因子的表达改善肺组织的炎症反应。也就是说MBPH对急性肺损伤小鼠具有一定的保护作用。
2.5 绿豆肽对急性肺损伤小鼠BALF中蛋白质量浓度的影响
由图5可知,模型组BALF中白蛋白质量浓度极显著高于对照组(P<0.01),说明模型组小鼠肺泡组织受损[12],这与HE染色结果一致。与模型组相比,MBPH组蛋白质量浓度显著下降(P<0.05),且呈量效关系。结果表明,MBPH能显著缓解LPS诱导引起的BALF中白蛋白质量浓度的升高。

图 5 绿豆肽作用下的急性肺损伤小鼠BALF中蛋白质量浓度变化Fig. 5 Effect of MBPH on BALF protein concentration in ALI mice
2.6 绿豆肽对急性肺损伤小鼠BALF中中性粒细胞数目的影响

图 6 绿豆肽作用下的急性肺损伤小鼠BALF中中性粒细胞数目变化Fig. 6 Effect of MBPH on number of neutrophils in BALF of ALI mice
由图6可知,模型组中性粒细胞数目显著高于对照组(P<0.05)。与模型组相比,MBPH组中性粒细胞数目显著下降(P<0.05),且呈量效关系。结果表明,MBPH能显著缓解LPS诱导引起的BALF中中性粒细胞数目的升高。
3 讨 论
肺部在细菌感染时,肺循环毛细血管中的中性粒细胞会渗出到肺内[13-15],在感染部位表达多种细胞毒性产物,包括MPO以及IL-1β、TNF-α等促炎细胞因子[16-17],从而导致弥漫性肺间质及肺泡水肿,最终导致急性呼吸功能障碍[18-19]。本研究采用鼻腔滴注LPS建立急性肺损伤小鼠模型,探讨MBPH对LPS诱导急性肺损伤小鼠的保护作用。研究结果表明LPS的刺激显著增加了急性肺损伤小鼠BALF中中性粒细胞数目,同时增强了MPO活力,肺泡结构破坏、肺间质增厚、大量炎性细胞浸润,促炎细胞因子显著表达,这说明LPS可刺激小鼠发生肺实质损伤,这是由于中性粒细胞的活化会促使机体氧自由基和颗粒酶的过量产生,以及促炎细胞因子的产生[20-21],从而促进感染部位细胞毒产物的表达。而经过灌胃MBPH的小鼠情况发生了逆转,表明MBPH可有效缓解
LPS诱导的小鼠肺组织损伤。为了量化肺水肿的严重程度,本实验分析了各处理组的肺W/D和BALF的蛋白质量浓度,结果显示MBPH显著降低了小鼠肺W/D,且能防止富含蛋白质的水肿液渗透到肺组织中。这表明MBPH可以减轻LPS刺激引起的肺水肿,该研究结果与于笛的研究结果[22]一致,其研究也表明绿豆寡肽可有效缓解LPS诱导的肺水肿,这可能是由于低分子质量寡肽更易被机体吸收,促进细胞的代谢活性,从而发挥其抗炎效果。目前许多研究证实食源性活性肽的抗炎作用多与其氨基酸组成、序列、长度、电荷、疏水性等密切相关。结合本研究结果得出MBPH和绿豆寡肽都具有缓解LPS诱导的肺水肿,这可能与MBPH特殊的氨基酸组成以及疏水性有关。Chignard[23]和Abraham[24]等研究发现急性肺损伤小鼠肺屏障通透性的增加是由中性粒细胞介导引起的。本实验结果也证实小鼠经LPS滴注后,肺组织被大量中性粒细胞浸润,而MBPH显著减少了肺组织中中性粒细胞的增多。此外,细胞计数的结果进一步证实了MBPH可改善LPS诱导的急性肺损伤小鼠肺水肿、中性粒细胞浸润的组织病理学特征。这一研究结果表明MBPH对LPS诱导的急性肺损伤小鼠的保护作用可能与抑制肺部炎症过程有关。细胞因子分析结果显示LPS会引起急性肺损伤小鼠TNF-α、IL-1β、IL-6、IL-10和IFN-γ等细胞因子水平的显著升高[25-28],结合肺组织病理学特征、中性粒细胞数量等研究结果得出,鼻腔滴注LPS会导致小鼠急性肺损伤,这可能的机制是LPS诱导小鼠产生TNF-α、IL-1β、IL-6等促炎细胞因子,这些促炎细胞因子通过协同作用引发炎症级联反应并促成了急性肺损伤的发生[29-31]。MBPH可显著缓解LPS诱导的TNF-α、IL-1β、IL-6和IFN-γ等促炎细胞因子的产生。本课题组前期研究也证实MBPH可抑制LPS诱导RAW264.7细胞NF-κB信号通路的激活,从而抑制TNF-α、IL-1β、IL-6等促炎细胞因子的分泌[32]。MBPH可上调IL-10等抗炎细胞因子的表达,IL-10能有效抑制TNF-α、IL-1β、IL-6等细胞因子的产生,在机体中发挥拮抗炎症作用,从而对机体组织起到保护作用,这与Ndiaye等发现的植物蛋白水解物可抑制促炎细胞因子表达发挥抗炎作用的研究结果[9]一致。综合以上实验结果得出,MBPH对LPS诱导的急性肺损伤小鼠的保护机制在于MBPH通过减轻肺水肿和肺微血管渗漏、改善肺组织的病理学变化,减少急性肺损伤小鼠肺部中性粒细胞浸润,下调急性肺损伤小鼠的TNF-α、IL-1β、IL-6、IFN-γ等促炎细胞因子和上调IL-10等抗炎细胞因子的表达,以及降低MPO的活力等方式发挥其保护作用。
