迷走神经电刺激对DSS诱导的结肠炎大鼠炎性因子与趋化因子及其受体的影响研究
2020-09-21张小丽周安付孙晓宁
谭 琰, 张小丽, 苏 航, 周安付, 汤 净, 孙晓宁
1.海南医学院第一附属医院消化内科,海南 海口 570102; 2.海南医学院
结肠炎病因复杂,遗传、环境和微生物之间共同作用导致免疫系统失衡,最终导致炎症性肠病(inflammatory bowel disease,IBD)的发生[1-3]。近几年,IBD在全球的发病率不断升高,我国的发病率也呈不断上升的趋势[4]。目前,尽管在生物技术与疗法方面取得了一定的进展,但迄今为止尚无药物和手段可为IBD提供持续的缓解与有效的治疗。
迷走神经电刺激(vagus nerve stimulation,VNS)是一种非药理学的治疗方法,它能够激活胆碱能抗炎途径(CAIP)和肿瘤坏死因子-α(TNF-α)反应[5]。已有报道指出,结肠炎患者可能出现迷走神经的功能障碍,而与之前的疾病及结肠切除史无关[6]。通过VNS激活CAIP刺激脾脏神经,从而引起去甲肾上腺素的分泌而作用于脾脏[7-8],甲肾上腺素与T细胞上的β2肾上腺素受体结合又能够刺激乙酰胆碱(ACh)的分泌[9]。有报道指出,ACh与巨噬细胞上的α7烟碱乙酰胆碱受体(α7nAChR)结合,从而通过抑制促炎性细胞因子的释放来减轻炎症[10-12]。VNS可通过激活胆碱能肠神经元来减轻肠道炎症,提示其对肠道可能具有直接作用[13-14]。趋化因子是一种低分子量的蛋白质,具有吸引白细胞转移至感染部位的能力,在炎症反应中发挥重要作用[15]。趋化因子受体几乎在所有的淋巴细胞表面表达,可以趋化T细胞和B细胞分别进入各自特定微环境的生理分区内。一些趋化因子和趋化因子受体在血清中呈现高表达状态,对患者炎性应激及免疫应答均具有较高的反映价值[16]。本研究进一步探究了VNS对葡聚糖硫酸钠(DSS)诱导的大鼠结肠炎相关炎性因子、趋化因子及趋化因子受体水平的影响,现报道如下。
1 材料与方法
1.1 主要试剂与材料主要试剂:DSS购自美国MP Biomedicals公司(CAS:9011-18-1),免疫组化染色试剂盒(批号:IH-1474R)购自上海雅吉生物科技有限公司,HE染色试剂盒购自北京百奥莱博科技有限公司(批号:ZN1970-KPC),兔抗CCL28(货号:ab232837)与兔抗CCR10(货号:ab1661)购自美国Abcam公司,辣根酶标记链霉卵白素工作液(货号:SY0698-XEF)购自北京百奥莱博科技有限公司,Trizol试剂(货号:15596026)购自美国Invitrogen公司,Prime ScriptTMRT reagent Kit试剂盒(货号:DRR037A)、PowerUpTMSYBRTMGreen Master Mix试剂盒(货号:DRR014A)购自日本TAKARA公司,ELISA试剂盒购自武汉博士德生物工程有限公司,其他试剂均为国产分析纯。实验动物:雄性Sprague-Dawley大鼠,体质量150~200 g,购自上海斯莱克实验动物有限公司,SPF级。
1.2 方法
1.2.1 结肠炎大鼠模型制备:将60只SD大鼠适应性饲养1周后开始实验。将大鼠随机分为两组:对照组15只、DSS诱导组(DSS组)45只。对照组大鼠每日自由饮用水及进食基础饲料,不做任何处理;DSS组大鼠每日自由饮用5% DSS溶液替代饮用水,自由进食基础饲料。实验时间为7 d,大鼠饲养条件为22~25 ℃,湿度为70%~75%,12 h昼夜交替循环。
1.2.2 VNS:大鼠结肠炎造模成功后,进行VNS。从45只结肠炎大鼠中随机选择30只并分为两组(每组15只):DSS+VNS组和DSS+Sham组,其余15只结肠炎大鼠仍作为DSS组。首先,DSS+VNS组和DSS+Sham组大鼠大腿部肌肉注射0.1 ml/100 g硫酸庆大霉素预防感染。腹腔注射0.3 ml/100 g水合氯醛进行麻醉,将大鼠仰卧固定于手术台上,颈部皮肤消毒后于颈部正中切开,钝性剥离皮下肌肉组织,暴露左侧颈动脉鞘,钝性剥开,游离左侧迷走神经干约5 mm。用特制的电极缠绕于迷走神经上使电极与迷走神经紧密接触,用牙胶固定在头部,灵敏电流表检测确保接触良好后给予电流刺激,刺激结束后取出电极,手术切口消毒并缝合。DSS+Sham组大鼠进行假迷走神经电刺激,即连接电刺激仪,但无电流输出。刺激参数为:电流1.0 mA、波宽0.5 ms、连续30 s、频率20 Hz,总治疗时间为15 min,共3个循环。实验完毕,所有大鼠返回笼中,给予充足的食物和水。实验过程中,无大鼠死亡。
1.2.3 酶联免疫吸附试验:VNS术后48 h,用断头法处死大鼠,采集外周血,加入肝素钠抗凝,于-80 ℃下冻存。采用ELISA法检测各组大鼠血清细胞炎性因子、趋化因子及趋化因子受体的含量,取收集的血液,室温下孵育2 h后,4 ℃、3 000 r/min离心15 min,分离血清,检测血清中TNF-α、IL-6、IL-17、IL-22、CCL28、CCR10、ITAC及CXCR3的含量,具体操作严格按照ELISA试剂盒说明书进行。用酶标仪在450 nm处测定光密度(OD)值。
1.2.4 HE染色:VNS术后48 h,沿腹中红线切开腹壁分离结肠,沿肠系膜纵向剖开肠段,用预冷的生理盐水冲洗后,切取部分结肠段固定于4%多聚甲醛溶液中,常规石蜡包埋,切成4 μm厚的连续切片,进行HE染色。PBS冲洗材料,在4%多聚甲醛中固定,乙醇脱水,常规石蜡包埋,切成厚度为4 μm的薄片。苏木精染色5 min,流水冲洗后,伊红染色液染色3 min,脱水、透明、封片,于光学显微镜下观察并拍照。
1.2.5 免疫组织化学染色:将石蜡切片脱蜡至水,PBS配制并浸泡5 min,0.01 mol/L枸椽酸盐缓冲液进行抗原修复,4%过氧化氢清除内源性过氧化物酶活性,加山羊血清液室温孵育30 min,分别滴加兔抗CCL28(1∶100)与兔抗CCR10(1∶100)作为一抗,4 ℃孵育过夜。次日PBS冲洗,加入滴加辣根酶标记链霉卵白素工作液(1∶1 000)37 ℃孵育15 min,PBS冲洗后采用新鲜配置的DAB显色,并用苏木素进行复染,常规脱水、透明,中性树胶封片,在电子显微镜下进行图像采集与分析。若胞浆呈黄色细颗粒状则判断为阳性产物。
1.2.6 实时荧光定量PCR:将各组大鼠结肠组织用消毒的剪刀剪碎,组织匀浆器打成匀浆,严格按照Trizol试剂说明提取总RNA,使用分光光度计测RNA纯度及浓度,采用Prime ScriptTMRT reagent Kit试剂盒进行反转录合成cDNA。根据PowerUpTMSYBRTMGreen Master Mix试剂盒说明检测结肠组织中各炎性因子、趋化因子及其受体mRNA的水平,以GAPDH基因的表达作为内参。PCR反应条件为50 ℃ 2 min,95 ℃ 2 min,循环1次;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 1 min,循环40次。引物用Primer Premier 5.0软件设计,由上海博亚公司合成,各基因引物序列如表1所示。采用2-△△Ct法计算各检测目的基因的相对表达量。

2 结果
2.1 VNS对大鼠血清炎性因子、趋化因子及其受体含量的影响ELISA检测血清炎性因子、趋化因子及其受体。血清炎性因子检测结果显示,与对照组相比,DSS组大鼠血清炎性因子TNF-α、IL-6、IL-17、IL-22的含量显著升高(P<0.01)。经过VNS后,与DSS组相比,DSS+Sham组中这些炎性因子的含量差异无统计学意义(P>0.05),而DSS+VNS组中这些炎性因子含量较DSS组和DSS+Sham组均显著降低(P<0.01)(见表2)。趋化因子及其受体的检测结果如表3所示,与对照组相比,DSS组大鼠血清中趋化因子CCL28及其受体CCR10、趋化因子ITAC及其受体CXCR3水平均升高(P<0.01)。经VNS后,DSS+VNS组中这些因子的水平较DSS组和DSS+Sham组均显著降低(P<0.01),而DSS组与DSS+Sham组比较,差异无统计学意义(P>0.05)。

表1 各基因引物序列Tab 1 Primer sequences of each gene
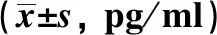
表2 各组大鼠血清炎性因子水平检测结果Tab 2 Results of serum inflammatory factor levels of rats in each group pg/ml)
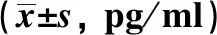
表3 各组大鼠血清趋化因子及受体水平检测结果Tab 3 Results of serum chemokine and chemokine receptor levels of rats in each group pg/ml)
2.2 VNS对大鼠结肠形态变化的影响通过结肠组织切片HE染色测定VNS对大鼠结肠的影响。结果如图1所示,对照组大鼠的结肠组织形态正常,未出现炎症和组织受损情况。DSS组与DSS+Sham组大鼠结肠均出现较大的炎性细胞浸润区域,伴有黏膜下层炎症现象,组织细胞形态受到破坏。而DSS+VNS组炎性细胞浸润区域较小,无明显的组织受损情况。

图1 HE染色检测各组大鼠结肠形态变化Fig 1 Colon morphology changes of rats were detected by HE staining in each group
2.3 VNS对结肠炎大鼠炎性因子表达的影响qRT-PCR检测结果显示,与对照组相比,DSS组TNF-α、IL-6、IL-17、IL-22的mRNA表达水平显著升高(P<0.01)。DSS诱导后再经过VNS实验,与DSS组与DSS+Sham组相比,DSS+VNS组TNF-α、IL-6、IL-17、IL-22的mRNA表达水平显著下降(P<0.01),而DSS组与DSS+Sham组表达水平比较,差异无统计学意义(P>0.05)(见图2)。
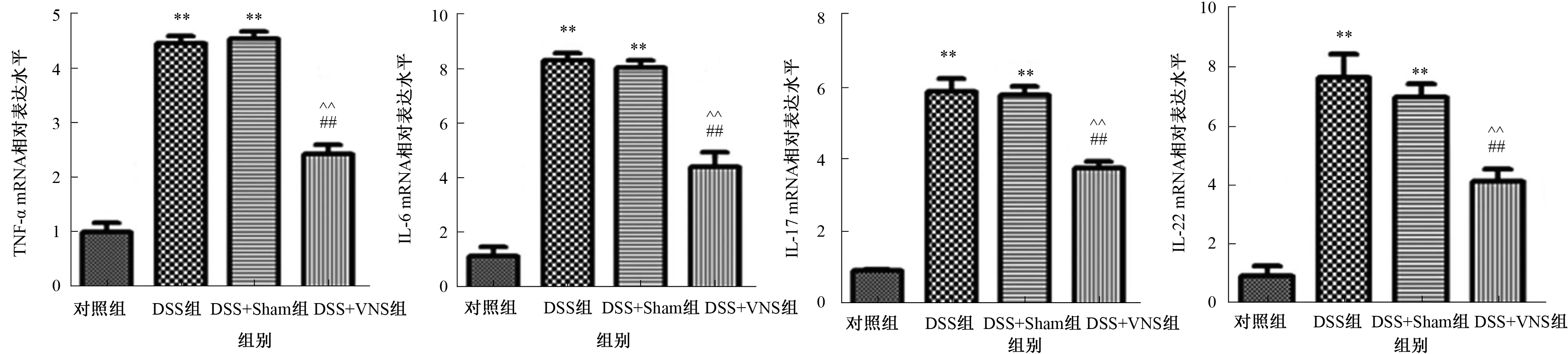
注:与对照组比较,**P<0.01;与DSS组比较,##P<0.01;与DSS+Sham组比较,^^P<0.01。 图2 qRT-PCR检测各组大鼠结肠组织中TNF-α、IL-6、IL-17及IL-22的mRNA表达水平Fig 2 Expression levels of TNF-α, IL-6, IL-17 and IL-22 mRNA in the colon tissues of rats were detected by qRT-PCR in each group
2.4 VNS对结肠炎大鼠趋化因子及其受体表达的影响免疫组化实验结果如图3所示,趋化因子CCL28与其受体CCR10在对照组胞浆中呈较弱染色或无染色,阳性表达率分别为3.03%、4.12%,DSS组与DSS+Sham组中细胞胞浆内可见呈弥漫片状中到强染色,DSS组阳性表达率分别为52.8%、54.9%,DSS+VNS组分别为56.7%、60.8%,DSS+VNS组中可见胞浆内有棕黄色的着色,染色强度较DSS组小,阳性表达率分别为30.1%、29.8%。
qRT-PCR检测结果显示,与对照组相比,DSS组中CCL28、CCR10、ITAC及CXCR3的mRNA表达水平显著升高(P<0.01)。然而,DSS诱导后再经过VNS实验,可以看到DSS+VNS组中CCL28、CCR10、ITAC及CXCR3的mRNA表达水平较DSS组和DSS+Sham组显著下降(P<0.01),而DSS+Sham组与DSS组比较,差异无统计学意义(P>0.05)(见图4)。
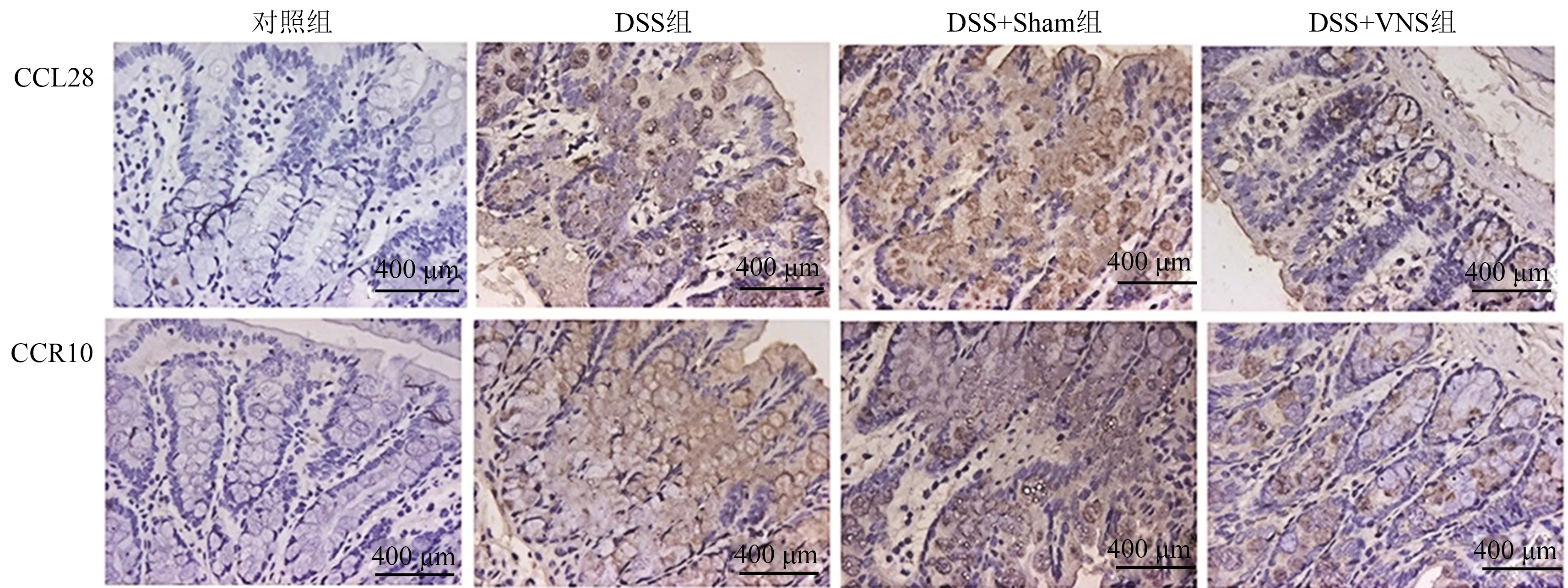
图3 免疫组化染色检测各组大鼠结肠组织中CCL28与CCR10的阳性表达情况Fig 3 The positive expressions of CCL28 and CCR10 in the colon tissues of rats were detected by immunohistochemical staining in each group

注:与对照组比较,**P<0.01;与DSS组比较,##P<0.01;与DSS+Sham组比较,^^P<0.01。 图4 qRT-PCR检测各组大鼠结肠组织中CCL28、CCR10、ITAC及CXCR3的mRNA表达水平Fig 4 Expression levels of CCL28, CCR10, ITAC and CXCR3 mRNA in the colon tissues of rats were detected by qRT-PCR in each group
3 讨论
在DSS诱导的结肠炎小鼠模型中,给予乙酰胆碱酯酶(AChE)抑制剂后可通过激活传出的迷走神经来降低疾病严重程度,当切断迷走神经或切除脾后CAIP效果则会消失[17]。目前,VNS已被用于抑郁症、癫痫、疼痛、心力衰竭、关节炎等疾病的临床治疗中[8,18-20],使用VNS在克罗恩病(CD)患者中进行的一项先导研究也证明了临床-生物-内镜的缓解[21]。此外,肠神经元的VNS可以诱导ACh的释放并与肠道巨噬细胞上的α7nAChR结合,从而减少肠道的炎症[11]。因此,推测VNS有可能成为药物或生物学治疗的辅助手段或替代方法。
本研究中,我们采用5% DSS诱导大鼠后,大鼠结肠出现较大的炎性细胞浸润区域,出现结肠组织受损的情况,同时,血清中促炎细胞因子TNF-α、IL-6、IL-17及IL-22的含量也明显升高,以上结果均说明DSS诱导大鼠结肠炎模型建造成功。通过VNS后,我们观察到DSS诱导的结肠组织受损现象得到明显抑制,这些炎性因子在血清中的含量下降,结肠组织中mRNA的表达水平也降低了。由此说明可能是VNS激活了CAIP从而抑制了这些促炎因子的表达。
趋化因子是一个广泛的小蛋白家族,能够与相应跨膜G蛋白偶联受体特异性结合,指导人体各个免疫细胞的趋化活性,当它们被激活时可以刺激细胞内部的信号传导途径从而调控机体内的一些生物学行为[22],对趋化因子及其受体的研究主要集中在免疫应答与炎症反应中[23]。CCL28是CC趋化因子家族成员之一,在乳腺、气管和胃肠道的大部分黏膜组织的上皮细胞中均有表达[24],CCR10最早被确定为CCL28的受体,其也被称为IL-11Rα-基因座趋化因子或皮肤T细胞吸引趋化因子[25]。趋化因子ITAC(CXCL11)可由IFN-γ诱导产生,属于ELR(-)CXC趋化因子家族成员,ITAC可通过与其受体CXCR3结合抑制由ELR(+)CXC趋化因子、血管内皮生长因子(VEGF)等诱导的血管形成来发挥作用[26]。在本研究中,我们检测了CCL28与CCR10、ITAC与CXCR3的表达情况,研究结果显示,在DSS诱导的结肠炎大鼠血清中CCL28、CCR10、ITAC、CXCR3含量均增加,各mRNA的表达水平也升高,此外,我们还检测了结肠组织中CCL28和CCR10的阳性表达情况,阳性表达率也增加。此研究结果与之前很多研究中趋化因子及趋化因子受体上调表达的结果相一致[23,27]。经VNS后,这些趋化因子及其受体的含量和表达水平均出现下调的现象,可能是VNS通过相关分子或信号通路来抑制趋化因子及其受体的表达,从而抑制其介导的一些恶性生物学行为的发生。故推测趋化因子CCL28及其受体CCR10、趋化因子ITAC及其受体CXCR3水平过高表达可能是诊治结肠炎患者的重要靶点。
通过本研究,我们研究了VNS对DSS诱导的结肠炎小鼠的影响,VNS可以改善DSS诱导的结肠组织学损伤,降低促炎因子的分泌和表达,抑制相关趋化因子及其受体的表达水平,从而减轻结肠炎症状,然而具体的作用通路有待进一步探究。
