简易式工厂化循环水对虾养殖系统构建及试验
2020-09-20刘兴国程果锋陈晓龙
朱 林,车 轩,刘兴国,程果锋,陈 军,刘 晃,陈晓龙
简易式工厂化循环水对虾养殖系统构建及试验
朱 林,车 轩※,刘兴国,程果锋,陈 军,刘 晃,陈晓龙
(1. 中国水产科学研究院渔业机械仪器研究所,上海 200092;2. 农业部渔业装备与工程技术重点试验室,上海 200092)
为探索低换水量的对虾养殖生产方式,该研究构建了一种简易式工厂化对虾养殖系统,试验组利用自行研发的蛋白分离器和新型集污盘去除系统总悬浮颗粒物和老化微藻,对照组不设置蛋白分离器和集污盘,进行对虾养殖和水质调控试验,结果表明:试验组平均总氨氮浓度、平均亚硝氮浓度、平均TSS(Total Suspended Solids)浓度、平均副溶血弧菌数量分别为(0.4±0.16)、(0.53±0.23)、(68.33±39.72)mg/L和(140±113.83)cfu/mL,显著低于对照组(0.96±0.62)、(1.17±0.59)、(147.14±94.18)mg/L和(661.34±473.96)cfu/mL(<0.05);试验组成活率及单位产量分别为82.62%±5.64%和(3.44±0.85)kg/m3,显著高于对照组18.29%±4.63%和(1.09±0.23)kg/m3(<0.05)。该研究构建的简易式循环水工厂化系统,设置蛋白分离器流量10 m3/h且不间断运行,养殖前45 d不换水、后55 d利用集污盘进行强排污保持日换水量5%的情况下能够有效调控对虾养殖水质。
水产养殖;水质;循环水系统;对虾;水污染控制
0 引 言
中国是世界第一养虾大国,2018年对虾养殖产量194.66万t[1],为农民增产增收和出口创汇做出了重要贡献。在精养系统中,转化为对虾蛋白质的饲料约占总投饲的30%,其余饲料以粪便残饵排入养殖水体中[2]。水体内无机氮水平的提高,严重影响精养池的性能,导致水质恶化,并引起有毒物质累积和潜在的环境污染[3], 传统的解决方法是进行大量排水换水[4],然而,中小型的水产养殖系统每天的用水量就达数百m3,凡纳滨对虾()每生长1 kg,至少需要20 m3的换水量[5]。近年来,由于大规模的高密度养殖、近海水环境恶化,养殖户往往无水可换[6],导致对虾病害蔓延,养殖成功率一直较低[7]。
水产养殖池内有毒氮排除方式有5种:排水换水、藻类和水生植物的光能自养过程、自养微生物利用氨为氮源合成自身蛋白质、异养微生物利用氨合成自身细胞的蛋白质、少量的氨以气体状态从水中排入大气[8]。20世纪80年代中期,Swif等[9]开始研究有限水交换用水系统应用于池塘高密度精养凡纳对虾,并且发现有限水交换提高了正常微生物群落对病原微生物(包括弧菌)的竞争力。90年代中期,工厂化对虾养殖开始起步,最初是在养鱼系统的基础上进行了部分的改良以适应对虾的生活习性,代表性系统有美国得克萨斯大学海洋科学研究所设计的跑道式对虾养殖系统、台湾对虾试验所台南分所开发的室内自动化养虾系统等[10];第二阶段为快速发展阶段,特点是各种新技术应用于对虾养殖的探索研究,代表性系统有美国海港海洋研究所设计的三阶段对虾养殖系统、美国夏威夷科纳海湾海洋资源公司的虾-藻类-贝养殖系统、美国南得克萨斯Sauz牧场的基于人工湿地的养虾系统等[11];第三阶段为平稳发展阶段,其特点是根据对虾的生活习性,更加注重菌与藻的相互关系[12],其单位产量和存活率都有大幅提高,代表性系统有美国墨西哥湾海岸研究实验室的基于生物絮凝的对虾养殖系统、美国德克萨斯农作物生命研究所海水养殖实验室的基于菌藻共生的对虾养殖系统等[13]。
工业化循环水养殖(Recirculating Aquaculture System,RAS)具有良好的系统封闭性的优点,能降低外来污染源和病原体的危害程度,目前在实验室水平和鱼类规模化养殖生产已经基本实现应用[14-17],但设备投入和运行成本较高的特点限制了其在对虾工业化养殖的大规模推广。因此,设计开发低成本的循环水对虾养殖系统具有重要意义。为此该研究构建了一套简易式循环水工厂化对虾养殖系统,在较高养殖密度下,利用自行研发的蛋白分离器去除系统总悬浮颗粒物和老化微藻,研发集污盘,提升养殖池集排污效果,减少换水量,尾水进入车间外部人工湿地进行处理,综合这2种技术手段,在保持较低的换水量的前提下,降低系统的有毒氮浓度,进行工厂化对虾养殖和水质调控试验。
1 材料与方法
1.1 试验系统构建
试验组(T组)配备蛋白分离器(图1a、图1b)和集污盘(图1d),对照组(C组)不配备蛋白分离器和集污盘,其中蛋白分离器主要由进水管、泡沫发生槽、出水管、排泡管和集污槽组成,采用节能型设计并利用消泡剂协助排污,功率0.3 kW,流量为10 m3/h。集污盘框架结构由外向内将其划分为外圈、中圈、内圈,外圈的外侧具有竖直的侧面,外圈和侧面采用较大网孔滤水网,中圈采用较小网孔滤水网,内圈为封闭式结构;内圈至外圈之间的范围内竖直、均匀布置多个旋流导向板,旋流导向板的高度等于或接近外圈侧面的高度。内圈铺设不锈钢板,中圈铺设每英寸100个筛孔的不锈钢网,外圈和其侧面铺设每英寸1个筛孔的不锈钢网,底部设计有旋流导向板,其在系统中的位置如图1d所示。
试验池与对照池构建于中国水产科学研究院渔业机械仪器研究所渔业装备与工程中试基地,如图1e所示。2组虾池均选择表面敷玻璃钢的水泥池塘,对虾养殖池尺寸15 m×18 m,方切角结构,面积约260 m2,池深1.5 m,设计水深0.8 m,设置直径1m的微孔增氧盘20个,沉于距池底20~30 cm的位置,底部铺设18根PVC微孔增氧管,微孔增氧管和微孔增氧盘通过PVC管道与1台1.1 kW罗茨风机相连,池中设置一台0.75 kW水车式增氧机,每组3个重复。

1A/1B.泡沫发生槽 2A/2B.出水管 3A/3B.排泡管4A/4B.集污槽 5A/5B.进水管 6.集污盘 7.球阀 8. 内圈 9.外圈 10.中圈11.水车增氧机 12. 排污口 13.蛋白分离器
1.2 试验方法
2018年4月18日,按每平方300尾分别投入凡纳滨对虾PL5虾苗放入试验池和对照池,分别命名为T组和C组,对虾收获时间为2018年7月26日。养殖原水取自附近河道,经过初步过滤后进入原水塘,以20 mg/L浓度的有效氯制剂进行消毒,同时曝气,5d后用5 mg/L浓度的大苏打消解余氯,通过水泵将淡水蓄水池的水抽入虾池以保持盐度不变。前期投喂虾片和卤虫,卤虫投喂频率随养殖天数的增加递减15%,一周后将虾苗驯食到纯人工配合饲料,试验过程中投喂无锡通威饲料生物科技有限公司特种料分公司生产的粗蛋白质量分数为42%凡纳滨对虾商品配合饲料。养殖期间,投饲后1 h检查吃食情况,根据吃食情况、天气情况、虾的生长情况和季节变化,及时调整饲料投喂量,每天分别于5:30、10:00、14:30、18:30及22:30投喂,以饲料质量的5%投入小苏打。日投饵量根据对虾大小及摄食情况确定,虾生物量根据每个月采样对虾体的平均体质量及对虾的实际存活数目而定。整个试验期间前45d不换水,后55d日换水量控制在5%,尾水进入车间外部人工湿地进行处理。整个试验过程中不添加任何药物。
1.3 指标测定
温度、pH值、溶解氧(Dissolved Oxygen)、盐度用YSI Professional Plus型水质分析仪于现场测定,测定时间为上午6:30-7:00;总氨氮测定采用次溴酸钠氧化法(GB12763.4),亚硝氮测定采用重氮-偶氮法(GB12763.4);总氮测定采用过硫酸钾消解紫外分光光度法(GB11894-89);水质指标每10 d测定1次。总悬浮颗粒物(TSS, Total Suspended Solids)测定:取一定量试验水样,用烘干的直径为47 mm的Whatman GF/F玻璃纤维滤膜抽滤,将截留有悬浮物的滤膜在110 ℃下烘至恒质量,称量干质量。水体副溶血弧菌()数量采用显色培养基法测量。
体质量(Weight,W)用电子天平测量,体长(Standard Length,SL)用游标卡尺测量
成活率(Survival Rate,SR)=起捕时活虾数量/放苗数量。
1.4 数据统计
应用 Excel 2016 及 Spss Statistics 18.0 软件对试验数据进行统计分析。
2 结果与分析
2.1 水质环境因子变化趋势
2.1.1 水温及盐度
试验期间T组及C组对虾养殖系统水温及盐度变化趋势如图2所示,2组初始水温都为(20.3±0.15)℃,随着气温的升高,水温慢慢上升,自4月28号至试验结束,T组水温在(23.5±0.1)~(30.8±0.15)℃之间;C组水温在(23.6±0.15)~(30.8±0.15)℃之间。T组盐度在(23.15±0.006)‰~(23.18±0.01)‰之间,C组盐度在(23.15±0.01)‰~(23.19±0.01)‰之间,试验全程2组水温及盐度差异不显著(>0.05)。本次简易式工厂化对虾养殖系统不设温控设备,大幅降低设备成本,选择同一座阳光大棚内方位一致的6套对虾养殖系统进行试验,保持试验组和对照组的水温一致;另一方面,因为盐度是影响对虾生长活动的重要因素之一,本次试验根据计算蒸发量通过小水泵往系统里面补充淡水,以保持系统盐度稳定。
2.1.2 溶解氧浓度及pH值
图3所示的是试验期间T组及C组对虾养殖系统溶解氧及pH值变化趋势,2组初始溶解氧浓度都为(7.08±0.05)mg/L,随着对虾及细菌生物量的增加、水温的升高,溶解氧浓度及pH值呈下降趋势,4月28日及5月8日,2组溶解氧浓度差异不显著(>0.05);5月18日至试验结束,T组溶解氧浓度从(6.58±0.18)降至(5.02±0.22)mg/L,C组溶解氧浓度从(5.98±0.15)降至(3.58±0.16)mg/L,T组与C组差异显著(<0.05)。2组初始pH值都为(8.56±0.02),4月28日至5月18日,T组与C组pH值2组差异不显著(>0.05);5月28日至试验结束,T组pH值变化范围为(8.15±0.13)~(8.29±0.12),C组pH值分别为(7.06±0.18)~(7.52±0.29),差异显著(<0.05)。溶解氧是对虾养殖生态环境中的重要指标,水中溶解氧不足可使对虾运动能力下降和食欲减退,当溶解氧在2.5~2.8 mg/L时,对虾会出现浮头。T组溶解氧全程在5 mg/L以上,能较好地满足对虾生长运动所需,C组溶解氧最低达到(3.58±0.16)mg/L,已接近危险浓度;凡纳滨对虾最适pH值在7.7~9.2之间,T组pH值保持在这一范围内,C组大部分养殖时间在7.6以下,不利于凡纳滨对虾生长。
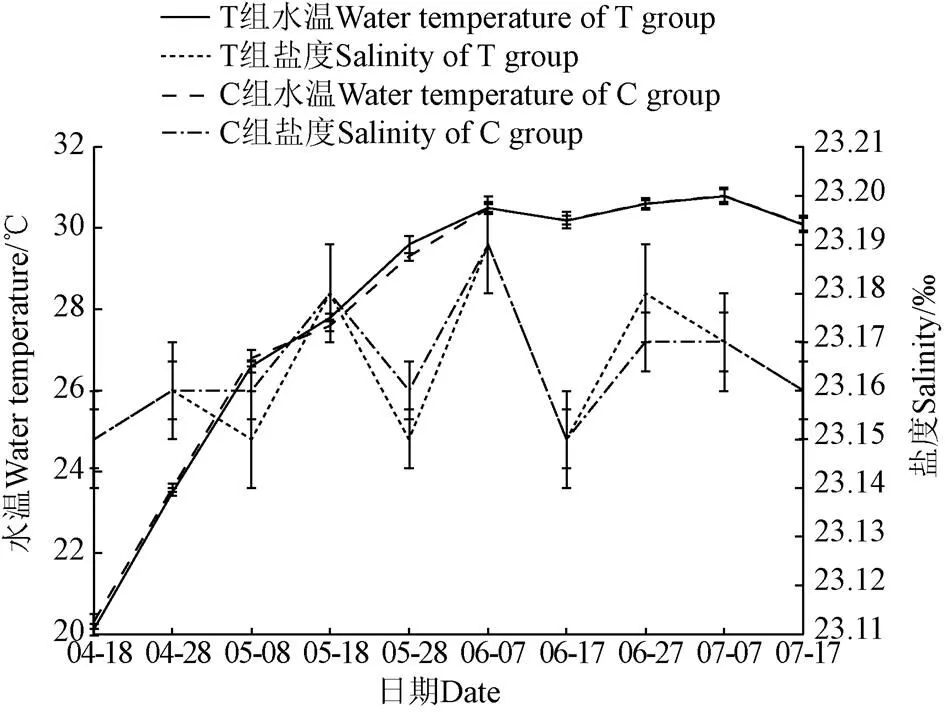
注:T组:试验组;C组:对照组。

注:不同字母表示处理间差异显著(P<0.05),下同。
2.1.3 总氨氮浓度及亚硝氮浓度
试验期间T组及C组对虾养殖系统总氨氮浓度及亚硝氮浓度变化趋势如图4所示,2组初始浓度都为(0.06±0.01)mg/L,4月28日,T组和C组总氨氮浓度分别为(0.16±0.02)、(0.17±0.05)mg/L,差异不显著(>0.05);5月8日至试验结束,T组总氨氮浓度在(0.35±0.05)~(0.58±0.09)mg/L之间,C组在(0.56±0.06)~(2.15±0.09)mg/L之间,差异显著(<0.05)。T组呈现稳定小幅上升的趋势,峰值出现在7月7日;C组呈现先大幅升高后期逐渐降低的趋势,对虾生长过程中绝大部分是利用蛋白质供能,因而对虾饵料中的营养成分以蛋白质为主。在好氧条件下,对虾残饵、粪便中的有机氮通过氨化作用转化成无机氮(以NH4+-N为主)[18],而导致后期逐渐降低的原因可能是6月17日后对虾死亡率增大投饲量减少。2组初始亚硝氮浓度都为(0.08±0.01)mg/L,4月28日,2组浓度分别为(0.25±0.03)和(0.26±0.05)mg/L,差异不显著(>0.05);5月8日至试验结束,T组亚硝氮浓度在(0.39±0.08)~(0.76±0.16)mg/L之间,C组浓度在(0.86±0.16)~(2.08±0.36)mg/L之间,差异显著(<0.05),2组都呈现逐步上升的趋势。对照组的亚硝氮部分通过亚硝酸单胞菌的硝化作用将氨氮转化而成;由于大部分养殖过程对照组的溶解氧显著低于试验组,硝酸盐还原也是亚硝氮的重要来源之一。

图4 试验期间总氨氮浓度和亚硝氮浓度
2.1.4 总氮浓度及TSS
图5所示的是试验期间T组及C组对虾养殖系统总氮浓度及TSS变化趋势,2组初始总氮浓度都为(1.5±0.3)mg/L,4月28日至试验结束,T组总氮浓度在(3.8±0.6)~(13.9±2.8)mg/L之间,C组浓度为(5.9±0.6)~(43.8±5.8)mg/L之间,差异显著,(<0.05)。2组初始TSS浓度都为(8.62±1.23)mg/L,4月28日至试验结束,T组TSS浓度为(13.65±1.7)~(126.89±13.9)mg/L之间,C组在(38.41±5.2)~(298.63±18.49)mg/L之间;差异显著(<0.05)。总氮是指水中各种形态无机氮和有机氮的总量,包括NO3-、NO2-、NH4+、蛋白质、氨基酸等,C组集排污效果效果差,大部分残饵,粪便、死亡微藻和死亡对虾留存在系统中导致总氮和TSS浓度不断升高。

图5 试验期间总氮浓度及TSS浓度
2.2 副溶血弧菌数量
图6所示的是试验期间T组及C组对虾养殖系统副溶血弧菌数量变化趋势,2组初始副溶血弧菌数量都为0,4月28号至试验结束,T组副溶血弧菌数量为(26.66±5.77)~(326.66±45.09)cfu/mL,C组副溶血弧菌数量为(120±10)~(1 066.68±32.15)cfu/mL,差异显著(<0.05)。副溶血弧菌通过耐热的直接溶血毒素,产生溶血活性、肠毒素活性、细胞毒性和心脏毒性,可引起对虾多种疾病。C组较高的副溶血弧菌数量增加了对虾感染概率,导致成活率下降。
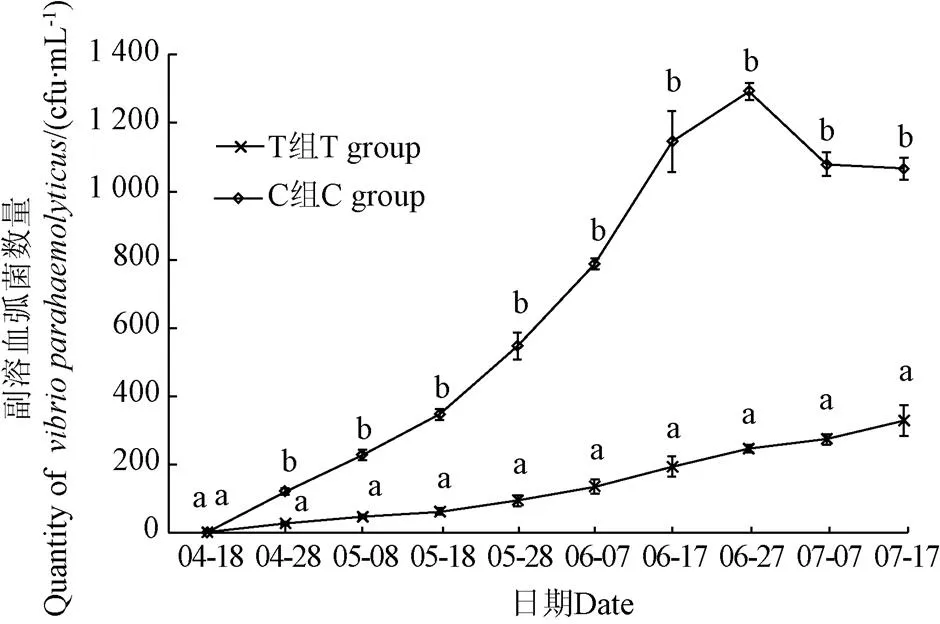
图6 试验期间副溶血弧菌数量变化趋势
2.3 对虾生长情况与养殖效果对比分析
对虾在3个生长阶段体质量、体长的测定结果如表1所示。

表1 T组和C组对虾生长情况及养殖效果对比
注:同列数据后不同字母表示差异显著(<0.05)。
Note: Different letters after peer data of the same column indicate significant difference (<0.05).
从表1可知,30日龄时,T组和C组体质量和体长差异均不显著(>0.05);在60日龄和90日龄,T组和C组体质量和体长差异均显著(<0.05)。T组和C组成活率和单位产量分别为82.62%±5.64和(3.44±0.85)kg/m3显著高于C组的18.29%±4.63%和(1.09±0.23)kg/m3(<0.05)。养殖中后期,C组对虾成活率下降,活下来的对虾由于密度较低获得了更多的生存空间,因此,C组体质量和体长在在60日龄和90日龄表现出显著高于T组。
3 讨 论
氨氮在水中有离子态氨(NH4+-N)和非离子态氨(NH3-N)2种状态存在,非离子氨具有脂溶性,能够穿透细胞膜毒害鳃组织,水体中氨氮超过对虾耐受限度时,氨氮能直接损害对虾的鳃组织,使肝胰腺结构发生病理变化,严重影响对虾的呼吸、蜕皮和排泄等正常生理功能,导致对虾抗病力下降[19-20]。更重要的是高浓度的氨氮长期胁迫凡纳滨对虾,导致对虾感染副溶血弧菌后死亡率增大,降低对虾肝胰腺中重要的非特异性免疫酶活性,减少其LvLT基因表达量,增加其对副溶血弧菌的易感性[21]。本试验中,T组的养殖全程平均总氨氮浓度(0.4±0.16)mg/L,显著低于对照组(0.96±0.62)mg/L (<0.05),尤其是6月7日、6月17日及6月27日,对照组的总氨氮浓度分别达到(1.36±0.16)、(2.15±0.09)、(1.56±0.13)mg/L。长时间的氨氮胁迫可能是导致对照组对虾成活率18.29%±4.63%显著低于试验组82.62%±5.64%的重要原因之一。
亚硝氮物质为强氧化剂,可引起缺氧和青紫症,即“棕血病”[22],亚硝氮的致毒机理主要是亚硝酸根离子与氧合血蓝蛋白结合,氧合血蓝蛋白中Cu+被氧化成Cu2+,导致其含量下降,机体携氧能力下降;高浓度氨氮在体内也可部分转化为亚硝酸盐,也可相应降低血淋巴中氧合血蓝蛋白含量[23-25]。本试验中,对照组养殖全程平均溶解氧浓度(5.39±1.15)mg/L,低于T组(6.18±0.68)mg/L,差异显著(<0.05);且后期在4 mg/L以下;另一方面,对照组的养殖全程平均亚硝氮浓度(1.17±0.59)mg/L,显著高于T组(0.53±0.23)mg/L(<0.05),特别是7月17日,对照组亚硝氮浓度达到(2.08±0.36)mg/L,更加剧了对虾的缺氧状态。
细菌的呼吸作用放出CO2,增加了水中CO2含量,使养殖系统水中pH值下降[26]。另一方面,自养细菌和异养细菌的繁殖都需要消耗碱度[27],进一步降低pH值。本试验中,T组的养殖全程平均pH值(8.32±0.15),显著高于对照组(7.67±0.55)(<0.05)。由于本次试验设计的集污盘提高了排污效率,结合蛋白分离器去除系统TSS和老化微藻,同时也降低了养殖系统的总氮浓度,T组的养殖全程平均TSS浓度(68.33±39.72)mg/L,显著低于对照组(147.14±94.18)mg/L(<0.05)。
自2013年中国对虾养殖业爆发“早期死亡综合症”(Early Mortality Syndrome,EMS)或称急性肝胰腺坏死综合症(Acute Hepatopancreas Necrosis Syndrome,AHPNS)病害以来[28-30],据统计,EMS/AHPNS造成每年超过10亿美元的经济损失;另一种病害对虾肝胰腺坏死症(Hepatopancreas Necrosis,HPNS)亦导致中国南方超过一半的凡纳滨对虾养殖场产量锐减80%以上[31];迄今为止,国内外主流学术专家认为副溶血弧菌是导致EMS/AHPNS/HPNS爆发的致病原[32-37],弧菌还会导致红腿病及甲壳溃疡病等传染性疾病,弧菌病已成为对虾养殖业最常见、危害较为严重的疾病[38]。本试验中,T组的养殖全程平均副溶血弧菌数量为(140±113.83)cfu/mL,显著低于对照组(661.34±473.96)cfu/mL(<0.05);尤其是6月7日至7月17日,对照组的副溶血弧菌数量都在1 000 cfu/mL以上,且同时期对照组总氨氮浓度也处于高位状态,构成了副溶血弧菌的致病条件,增加了对虾感染的机率。
传统的工厂化对虾养殖车间水泥池一般采用在池底中心部位设置套管的形式进行排污,套管上设有网孔,下方污水排放管道与套管连通,污水透过网孔排出养殖水池。这种排污方式只能将排污管周边很小范围的固体废物排出,沉降在排污管3 m内的大部分固体废物无法顺利排出养殖池,排污的效率较低,浪费大量水资源[39]。本次试验中,系统开启排污水泵时,由于外圈和网孔面积较大,内圈的网孔面积较小,大部分水体从外圈流入,顺势进入水池底部的排污口;小部分水体从中圈流入,进入水池底部的排污口;内圈由于被盖板封死,不会有水体进入。位于外围的水质污染较严重的区域的养殖沉积物被优先排出,中心区域水质较为良好的水体被延迟排出。
4 结 论
1)该研究设计的简易式循环水工厂化系统,能够有效调控对虾养殖水质,将总氨氮浓度、亚硝氮浓度及TSS控制在(0.58±0.09)、(0.76±0.16)和(126.89±13.9)mg/L以下,养殖全程平均总氨氮浓度、亚硝氮浓度及TSS控制在(0.4±0.16)、(0.53±0.23)、(68.33±39.72)mg/L,显著低于对照组。
2)该研究设计的简易式循环水工厂化系统,将副溶血弧菌数量控制在(326.66±45.09)cfu/mL以下,养殖全程平均副溶血弧菌数量控制在(140±113.83)cfu/mL,显著低于对照组;成活率82.62%±5.64%,单位产量(3.44±0.85)kg/m3,显著高于对照组。
[1] 农业部渔业局. 中国渔业年鉴2019[M]. 北京:中国农业出版社,2019.
[2] Hopkins T A, Manciw E. Feed convension, waster and sustainable aquaculture, the fate of the feed[J]. Aquacultural Magazine, 1989, 15(2): 32-36.
[3] Piedrahita R H. Reducing the potential environmental impact of tank aquaculture effluents through intensification and recirculation[J]. Aquaculture, 2003, 226(1/2/3/4): 35-44.
[4] Gutierrez-Wing M T, Malone R F. Biological filters in aquaculture: trends and research directions for freshwater and marine applications[J]. Aquacultural Engeering. 2006, 34(3): 163-171.
[5] Wang J K. Conceptual design of a microalgae-based recirculating oyster and shrimp system[J]. Aquacultural Engeering, 2003, 28(1/2): 37-46.
[6] 刘晃,倪琦,顾川川. 海水对虾工厂化循环水养殖系统模式分析[J]. 渔业现代化,2008(1):15-19.
Liu Huang, Ni Qi, Gu Chuanchuan. Review of recirculating marine shrimp cultivation systems[J]. Fishery Modernization, 2008(1): 15-19. (in Chinese with English abstract)
[7] Lightner D V, Redman R M, Pantoja C R, et al. Early mortality syndrome affects shrimp in Asia[J]. Global Aquaculture Advocate,2012(2): 40-46.
[8] 赵培. 生物絮团技术在海水养殖中的研究与应用[D]. 上海:上海海洋大学,2011.
Zhao Pei. The Study and Application of Bioflocs Technology in Seawater Aquaculture[D]. Shanghai: Shanghai Ocean University, 2011. (in Chinese with English abstract)
[9] Swift M R. Drag force acting on biofouled net panels[J]. Aquacultural Engineering, 2006, 35(3): 292-299.
[10] Ebeling J M, Timmons M B, Bisogni J J. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/2/3/4): 346-358.
[11] Zimba P V. Co-occurrence of white shrimp, Litopenaeus vannamei, mortalities and microcystin toxin in a southeastern USA shrimp facility[J]. Aquaculture, 2006, 261(3): 1048-1055.
[12] Khoi C M, Guong V T, Merckx R. Predicting the release of mineral nitrogen from hypersaline pond sediments used for brine shrimp Artemia franciscana production in the Mekong Delta[J]. Aquaculture, 2006, 257(1/2/3/4): 221-231.
[13] Pina P. Survival, development and growth of the Pacific white shrimp Litopenaeus vannamei protozoea larvae, fed with monoalgal and mixed diets[J]. Aquaculture, 2006, 253(1/2/3/4): 523-530.
[14] Blancheton J P. Developments in recirculation systems for Mediterranean fish species[J]. Aquacultural Engeering, 2000, 22(1): 17-31.
[15] Honda H, Kikuchi K. Management of a Seawater Recirculation Fish Culture System for Japanese Flounder[R]. Proc. 24thUS-Japan Aquaculture Panel Symposium. US-Japan Cooperative Program in Natural Resources (UJNR) Technical Report, 1997: 165-171.
[16] Martinsa C I M, Eding E H, Verdegem M C J, et al. New developments in recirculating aquaculture systems in Europe: Aperspective on environmental sustainability [J]. Aquacultural Engeering, 2010, 43: 83-93.
[17] 刘鹰. 海水工业化循环水养殖技术研究进展[J]. 中国农业科技导报,2011,13(5):50-53.
Liu Ying. Research progress on marine industrial recirculating aquaculture technology[J]. Journal of Agricultural Science and Technology, 2011, 13(5): 50-53. (in Chinese with English abstract)
[18] Boopathy R. Biological treatment of shrimp production wastewater[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(7): 989-996.
[19] Chen J C, Kou Y Z. Effects of ammonia on growth and molting of Penaeus japonicus juveniles[J]. Aquaculture, 1992(104): 249-260.
[20] Burford Michele A, Williams Kevin C. The fate of nitrogenous waste from shrimp feeding[J]. Aquaculture, 2001, 198(1): 79-93.
[21] 葛红星,李健,陈萍,等. 氨氮胁迫下凡纳滨对虾对副溶血弧菌的易感性[J]. 渔业科学进展,2014,35(6):76-82.
Ge Hongxing, Li Jian, Chen Ping,et al.The immune response of litopenaeus vannamei and its susceptibility tounder stress caused by ammonia Nitrogen at different concentrations[J]. Progress In Fishery Sciences, 2014, 35(6): 76-82. (in Chinese with English abstract)
[22] Kroupova H, Machova J, Svobodova Z. Nitrite influ-ence on fish: A review[ J].Vet Med Czech, 2005, 50(11): 461-471.
[23] Chen J C, Cheng S Y. Hemolymph, oxygen content, oxyhemocyanin, protein level and ammonia excretion in the shrimp Penaeus monodon exposed to ambient nitrite[J]. Comp Ysiol, 1995(164): 530-535.
[24] Bagarinao T, Vetter R D. Slushed tolerance and adaptation in the California killifish, Fundulus parvipinnis a salt marsh resident[J]. Journal of Fish Biology, 1993(42): 729-748.
[25] Truong D H, Eghbal M A, Hindmarsh W, et al. Mo-lecular mechanisms of hydrogen sulfide toxicity[J]. Drug Metab Rev, 2006, 38(4): 733-744.
[26] Ray A J, Lotz J M. Comparing a chemoautotrophic-based biofloc system and three heterotrophic-based systems receiving different carbohydrate sources[J]. Aquacultural Engineering, 2014, 63: 54-61.
[27] Ebeling J M, Timmons M B, Bisogni J J. Engineering analysis of the stoichiometry of photoautotrophic,autotrophic and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/4): 346-358.
[28] Zhang L, Orth K. Virulence determinants for Vibrio parahaemolyticus infection[J]. Current Opinion in Microbiology, 2013, 16(1): 70-77.
[29] FAO. Report of the FAO/MARD technical workshop on early mortality syndrome (EMS) or acute hepatopancreatic necrosis syndrome (AHPND) of cultured shrimp ( under TCP/VIE/3304)[R]. FAO Fisheries and Aquaculture Report. Rome. Hanoi, VietNam, 2013: 54.
[30] Lightner D V, Redman R M, Pantoja C R, et al. Historic emergence, impact and current status of shrimp pathogens in the Americas[J]. Journal of Invertebrate Pathology, 2012, 110: 174-183.
[31] 李巍,贾延民,鲁国延. 我国水产种业产业现状,面临挑战及发展途径[J]. 中国水产,2014(6):19-23.
[32] Lightner D V. EMS/AHPNS: Infectious disease caused by bacteria[J]. Global Aquaculture Advocate, 2013, 7/8: 18-20.
[33] Eduardo M L, Mohan C V. Early mortality syndrome threatens Asia’s shrimp farms[J]. Global Aqua-culture Advocate, 2012, 23(7): 38-39.
[34] Tran L, Nunan L, Redman R M, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Diseases of Aquatic Organisms, 2013, 105: 45-55.
[35] Tran L, Nunan L, Redman R M, et al.EMS/AH-PNS: Infectious disease caused by bacteria[J]. Global Aquaculture Advocate, 2013, 20(7): 18-20.
[36] Han J E, TanG K F, Tran L H, et al. Photorhabdus insect related (Pir) toxin like genes in a plasmid of, the causative agent of acute hepatopancreatic necrosis disease (AHPND) of shrimp[J]. Diseases of Aquatic Organisms, 2015, 113(1): 33-40.
[37] 黄志坚,陈勇贵,翁少萍,等. 多种细菌与凡纳滨对虾肝胰腺坏死症(HPNS)爆发有关[J]. 中山大学学报:自然科学版,2016(1):1-11.
Huang Zhijian, Chen Yonggui, Weng Shaoping, et al. Multiple bacteria species were involved in hepatopancreas necrosis syndrome (HPNS) of[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016(1): 1-11. (in Chinese with English abstract)
[38] Alabi A O, Latchford J W, Jones D A. Demonstration of residual antibacterial activity in plasma of vaccinated[J]. Aquaculture, 2000(187): 15-34.
[39] 刘堃. 海水健康养殖业内涵特征及发展对策研究[J]. 渔业信息与战略,2015,30(3):186-191.
Liu Kun. On connotation,characteristics and development countermeasures of healthy marine aquaculture industry[J]. Fishery Information and Strategy, 2015, 30(3): 186-191. (in Chinese with English abstract)
Construction and experiment of simple industrial recirculating water shrimp culture system
Zhu Lin, Che Xuan※, Liu Xingguo, Cheng Guofeng, Chen Jun, Liu Huang, Chen Xiaolong
(1.,200092,; 2.,,200092,)
China has been the largest shrimp farming country in the world. As such , shrimp culture has also made a great contribution to the increase of farmers’ income and export earnings. In recent years, the performance of intensive aquaculture system was seriously affected by a large amount of nitrogen that discharged into the aquaculture water body. Normally, a conventional solution to this problem is to drain a lot of water for water exchange in the intensive aquaculture system. In this case, most water resources can be overly consumed to waste in the aquaculture system. Alternatively, the industrial recirculating aquaculture system can be selected due to its good system closure, but the high cost of equipment input and operation have limited its large-scale application in industrial aquaculture of prawn. In this paper, a set of simple industrial shrimp culture system with circulating water was designed to develop a protein separator removal system TSS (total suspended solids) and aged microalgae, where the collection and drainage effect of culture pool were strengthened using the self-developed collection tray. An experiment related to industrial shrimp culture was carried out to control the water quality. The results showed that the average concentration of total ammonia nitrogen was (0.4±0.16) mg/L, significantly lower than the control group (0.96±0.62) mg/L,<0.05. The average concentration of dissolved oxygen in the control group was (5.39±1.15) mg/L, dramatically lower than that in the test group (6.18±0.68) mg/L,<0.05. The average concentration of nitrous oxide in the control group was (1.17±0.59) mg/L, significantly higher than that in the test group (<0.05). The average concentration of TSS in the test group was (68.33±39.72) mg/L, lower than that in the control group (147.14±94.18) mg/L,<0.05. The average number ofin the experimental group was (140±113.83) CFU/mL, lower than that in the control group (661.34 ± 473.96) CFU/mL,< 0.05. After the age of 30 days, the body weight of the test and control group were (1.05 ± 0.15) g and (0.98 ± 0.26) g, respectively, whereas, the body length was (4.95 ± 0.56) cm and (4.86 ± 0.69) cm, respectively, indicating that the difference between two groups was not correlated (> 0.05). After the age of 60 days, the body weight of the test and control group were (5.26±0.82) g and (6.12±1.76) g, respectively, whereas, the body length was (8.17±0.92) cm and (9.12±0.81) cm, respectively, indicating that the difference between two groups was significant correlated (< 0.05). After the age of 90 days, the body weight of the test and control group were 13.89±1.23 g and 20±1.58 g, respectively, while, the body length was (12.26±1.98) cm and (14.06±1.68) cm, respectively, indicating that the difference between two groups was significant correlated (<0.05). In terms of survival rate, the shrimp size of the test and control group were 82.62%±5.64% and 18.29%±4.63%, respectively, with significant difference (<0.05). The single output of the test and control group were (3.44±0.85) kg/m3and (1.09±0.23) kg/m3, respectively, indicating a significant difference (< 0.05). This finding can offer a promising method to accurately monitor the water quality in an intensive aquaculture system for the shrimp farming.
aquaculture; water quality; circulating water system; prawn; water pollution control
朱林,车轩,刘兴国,等. 简易式工厂化循环水对虾养殖系统构建及试验[J]. 农业工程学报,2020,36(15):210-216.doi:10.11975/j.issn.1002-6819.2020.15.026 http://www.tcsae.org
Zhu Lin, Che Xuan, Liu Xingguo, et al. Construction and experiment of simple industrial recirculating water shrimp culture system[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(15): 210-216. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.15.026 http://www.tcsae.org
2020-04-15
2020-05-31
现代农业产业技术体系专项资金—虾蟹体系(CARS-48);上海市科技兴农重点攻关项目“构建池塘养殖小区绿色生产技术及模式研究(沪农科创字(2018)第2-12号)”;农业农村部农业国际合作交流项目“‘一带一路’热带国家水产养殖科技创新合作”
朱林,助理研究员,从事养殖水环境控制研究。Email:zhulin@fmiri.ac.cn
车轩,副研究员, 研究方向为水污染控制工程。Email:Chexuan@fmiri.ac.cn
10.11975/j.issn.1002-6819.2020.15.026
S968.22
A
1002-6819(2020)-15-0210-07
