CPT1B 基因在灵山香鸡上的时空表达规律研究
2020-09-18屠云洁束婧婷巨晓军刘一帆单艳菊姬改革唐燕飞蒋华莲邹剑敏
屠云洁 ,束婧婷,章 明,巨晓军,刘一帆,单艳菊,姬改革,唐燕飞,蒋华莲,邹剑敏*
(1.江苏省家禽科学研究所,江苏省家禽遗传育种重点实验室,江苏扬州 225125;2.广西富凤农牧集团有限公司,广西南宁 530024)
肉碱脂酰转移酶1B(Carnitine Palmitoyl Transferase 1B,CPT1B)作为CPT1 的一种重要同工酶-肌肉型肉碱脂酰转移酶1(MCPT1),其在调节体内脂肪酸的氧化过程中起着重要作用[1-3]。以往关于CPT1B基因的研究多集中于哺乳动物,而禽类的能量代谢调节系统与哺乳动物存在诸多差异,因此有关哺乳动物[4-5]的研究结论可能并不适用于禽类。作者前期研究结果显示,CPT1B基因在隐性白羽鸡产蛋高峰期心脏、胸肌和腿肌的表达量显著高于肝脏[5],但不同发育阶段表达量的变化趋势未见报道。灵山香鸡是从灵山县地方优良肉用土种鸡中经过多年选育而成的一种优质型肉鸡品种,其肉嫩滑、鸡味香浓,肌内脂肪含量高。灵山香鸡在广西、广东、海南及港澳地区广受市场的青睐,竞争于南方高档次肉鸡消费市场[6-7]。为了更好地开发利用灵山香鸡,本研究分析CPT1B基因在灵山香鸡胸肌、腿肌、心脏和肝脏不同发育阶段差异表达量,以揭示CPT1B在灵山香鸡不同组织中和同一组织不同发育阶段的差异表达量,为研究鸡体内脂肪代谢机制提供一定的基础资料。
1 材料与方法
1.1 实验动物 灵山香鸡种蛋来自广西富凤农牧集团有限公司,300 个灵山香鸡种蛋在江苏省家禽科学研究孵化,出雏,饲养。
1.2 样品采集 每个发育阶段采集灵山香鸡商品鸡10 个样品,共采集11 个时间点:9、12、16 胚龄、1 日龄、1、3、5、7、10、13、16 周龄。屠宰后迅速采取腿肌、胸肌、心脏和肝脏样本并投入液氮中,然后置于-80℃的冰箱中保存备用。
1.3 RNA 的提取以及cDNA 的合成 利用Trizol Reagent Kit 试剂盒提取腿肌、胸肌、心脏和肝脏RNA,cDNA第一链的合成按照反转录试剂盒的使用说明书进行,反转录产物保存于-20℃备用。以提取的总RNA 为模板,按照RT-PCR 试剂盒(TaKaRa,Dalian,China)说明书反转录合成cDNA 第一链。反转录反应体系20 μL:总 RNA 2 μL,OligodT20 1 μL,AMV 反转录酶(200 U/μL)1 μL,RNA 酶抑制剂 1 μL,dNTP Mix(10 mmol/L)2 μL,5×RT Buffer 4 μL,DEPC 水9 μL。反转录条件:42℃作用30 min,99℃反应5 min。
1.4 引物设计 根据CTP1B和β-actin基因的mRNA 序列,利用Primer5.0 设计荧光定量PCR 引物,由上海生物工程(上海)股份有限公司合成。
鸡CPT1B基因正反向引物序列为F:5'-TGCTGCT TCCAATTCGACG-3',R:5'-TGCAGCGCGATCTGAA TG-3';鸡内参基因β-actin 基因正反向引物序列为F:5'-GTCCACCGCAAATGCTTCTAA-3',R:5'-TGCGCATT TATGGGTTTTGTT-3′。
1.5 荧光定量PCR 反应条件CPT1B:95 ℃预变性20~30 s,然后40 个循环的95 ℃变性20~30 s,退火55~60℃ 20~30 s,最后95℃变性10~15 s,60℃ 1 min,95℃ 10~15 s,连续测定样品的荧光强度以获取熔解曲线。
β-actin:95℃ 预变性 20 s,然后40 个循环的95℃变性20~30 s,退火56~59℃ 20~30 s,最后95℃ 变性10~15 s,60℃ 1 min,95℃ 10~15 s,连续测定样品的荧光强度以获取熔解曲线。
1.6 mRNA 定量数据分析 鸡各组织样本经反转录成cDNA 第一链后,分别利用CPT1B和β-actin基因各自优化好的条件进行荧光定量PCR 反应,每个样品均做3个平行管,每次反应均设无模板对照(NTC)。以β-actin基因为内参照,对CPT1B基因mRNA 表达水平进行校正,并采用2-△△Ct法对数据进行处理,其中△Ct=(Ct目的基因- Ct 内参基因),以1 个发育阶段基因表达量为参照,如3 周龄△Ct 作为其他组织的参照,计算相对表达量 △△Ct,△△Ct=(△CtXgroup-△Ct 参照),以此来比较CPT1B基因表达量的倍数变化。
2 结果与分析
从图1 可以看出,CPT1B在不同发育阶段4 种组织中表达差异性不同。在胚胎期(9、12、16 胚龄)和1 日龄,CPT1B基因在肝脏的表达量显著高于在心脏、胸肌和腿肌;1、3 周龄时,CPT1B基因在4 种组织中的表达量差异不显著,5、7、10、13 周龄时,CPT1B在胸肌的表达量显著高于其他3 种组织,性成熟16 周龄时,CPT1B在腿肌的表达量显著低于其他3 种组织,在胸肌、心脏、肝脏中的表达量差异不显著。
CPT1B基因在4 种组织不同发育阶段表达量的变化趋势不一致。CPT1B在肝脏的胚胎期(9、12、16 胚龄)和1 日龄时的表达量虽有降低升高再降低的趋势,但表达量差异不显著,且显著高于 1、3、5、7、10、13、16 周龄,且1~16 周龄的CPT1B表达量差异不显著。
CPT1B基因在心脏、胸肌和腿肌的不同发育阶段变化趋势一致,但不同发育阶段表达量变化显著性不同。CPT1B出雏后在心脏、腿肌、胸肌的各个发育阶段的表达量显著高于胚胎期。CPT1B在心脏1 日龄时表达量显著上升,1~10 周龄表达量变化不显著,13、16 周龄的表达量显著高于1、3、5、7、10 周龄。CPT1B在腿肌胚胎期和出雏后的表达量差异不显著。CPT1B在胸肌从9 胚龄到10 周龄表达量逐渐升高,13 周龄时表达量显著下降,且5、7、10、13、16 周龄极显著高于1、3 周龄,1 日龄表达量显著高于胚胎期。
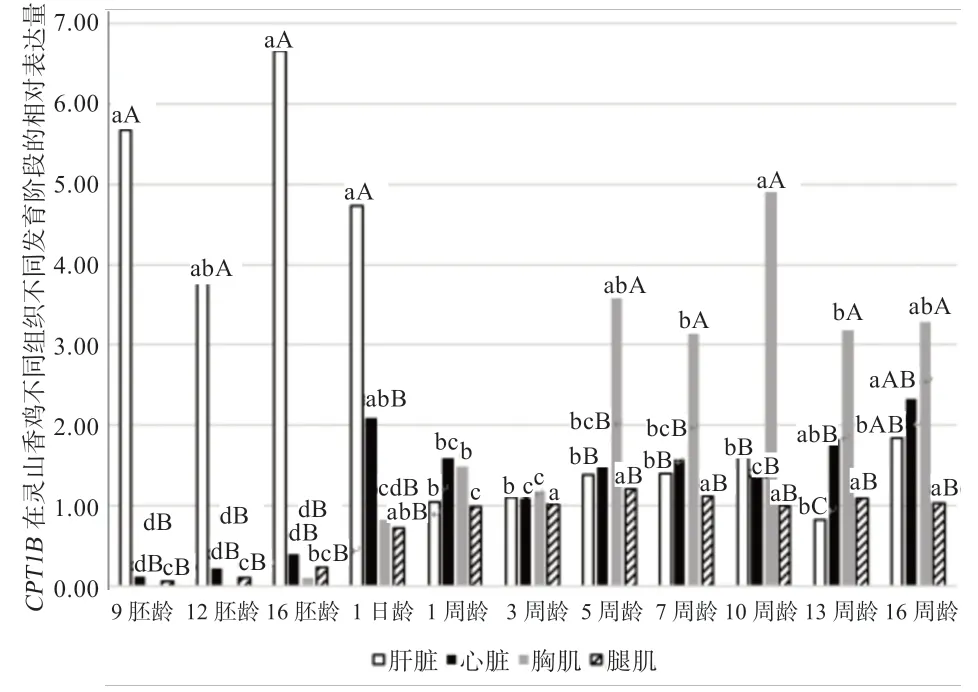
图1 CPT1B 基因在灵山香鸡不同组织和不同发育阶段的差异表达量
3 讨 论
3.1CPT1B基因在不同组织中的差异表达量分析 大多数组织都有氧化脂肪酸的能力,肝脏和肌肉组织是脂肪酸β-氧化的主要场所。肌肉亚型(CPTlB)属于CPTs家族中的一员,是脂肪酸β-氧化的关键限速酶,对脂肪的分解供能具有重要的调控作用[8-10]。Tu 等[5]研究了包括CPT1B在内的8 个鸡脂质代谢相关基因在产蛋高峰期217 日龄隐性白羽公母鸡中的差异表达,结果显示CPT1B在公母鸡心脏、胸肌、腿肌的表达量大于肝脏。本研究发现,CPT1B虽然属于肌肉亚型CPT,但不是每个发育阶段在肌肉组织中的表达量高于肝脏,且CPT1B在不同发育时间点的组织中表达量不同,在胚胎期和1 日龄时,CPT1B基因在肝脏的表达量最高,5~13 周龄CPT1B在胸肌的表达量最高。本实验结果与前期研究结果[5]不一致,这可能与鸡的日龄有关,不同发育阶段所需的能量不同。胚胎期心脏、胸肌和腿肌发育比较缓慢,需要能量较少,在肝脏氧化产生的能量主要供自身利用;但出雏后,1、3 周龄时,心脏、胸肌和腿肌发育迅速,需要由肝脏为心脏、胸肌和腿肌提供更多的能量,5、7、10、13 周龄时,CPT1B在胸肌的表达量显著高于其他3 种组织,可能是因为从5 周开始灵山香鸡的胸肌迅速发育。不同发育阶段4 种组织差异表达量结果表明,灵山香鸡胚胎期,肝脏是CPT1B参与脂肪酸β-氧化的主要场所,出雏后到性成熟,胸肌是CPT1B参与脂肪酸β-氧化的主要场所。
3.2CPT1B基因在4 种组织不同发育阶段的差异表达量分析 本研究中,CPT1B基因在4 种组织不同发育阶段变化趋势不一致,其中CPT1B在肝脏的胚胎期和1日龄时的表达量显著高于 1、3、5、7、10、13、16 周龄,呈显著下降趋势,这可能与肝脏在脂肪代谢中的功能有关。肝脏是动物脂肪代谢的主要部位,肝细胞液中的脂肪酸以及肌肉和其他组织细胞摄取的脂肪酸借助CPT-Ⅰ被转运至线粒体内,经β-氧化后生成乙酰CoA,肝脏中生成的乙酰CoA 除经三羧酸循环产生ATP 供自身利用外,更多的是转化为酮体运输到脑等肝外组织氧化利用[4]。胚胎期和1 日龄时胸肌、腿肌和心脏发育比较缓慢,需要能量较少,所以CPT1B在胚胎期和1 日龄时在肝脏表达量明显高于其他时期,出雏后由于胸肌、腿肌和心脏等组织迅速发育需要由肝脏提供更多的能量,所以在肝脏的表达量显著下降。
CPT1B在心脏1 日龄~16 周龄的表达量显著高于胚胎期,这可能由于出雏后心脏活动量加大,需要更多能量,CPT1B在心脏参与的脂肪酸β-氧化增强,为心脏提供更多能量。
CPT1B在腿肌的胚胎期到出雏后的各个发育阶段的表达量变化趋势比较平缓,1 日龄~16 周龄的表达显著高于胚胎期。CPT1B在胸肌胚胎期到出雏后的多个发育阶段的表达量持续显著性上升。CPT1B在胸肌和腿肌不同发育阶段表达量不同,这可能由于胸肌和腿肌的肌纤维发育快慢不同,胚胎期肌纤维发育低于出雏后[11-12]。灵山香鸡作为一个优质肉鸡品种,出雏后胸肌逐渐发育,胸肌肌内脂肪含量和腹脂沉积会逐渐增加[13]。CPT1B在调节体内脂肪酸的氧化过程中起着重要作用,CPT1B基因是催化脂肪酸线粒体β-氧化的限速酶,影响体内脂肪的分布,与脂质代谢密切相关[14]。本实验中CPT1B在胸肌的表达量显著升高,推测CPT1B在脂质代谢过程中起到正调控作用,后续将进一步进行CPT1B基因功能验证。
4 结 论
本研究结果显示,CPT1B在不同发育阶段4 种组织相对表达量不同,在胚胎期,CPT1B基因在肝脏的表达量最高,5、7、10、13 周龄时,CPT1B在胸肌的表达量最高。CPT1B基因在4 种组织不同发育阶段变化趋势不一致,CPT1B在肝脏的胚胎期到性成熟时表达量呈下降趋势,而CPT1B在腿肌、胸肌和心脏的表达量呈上升趋势,在胸肌的表达量上升趋势最显著。灵山香鸡胚胎期,肝脏是CPT1B参与脂肪酸β-氧化的主要场所,出雏后到性成熟,胸肌是CPT1B参与脂肪酸β-氧化的主要场所。
