超高效液相色谱-串联质谱法同时直接测定草甘膦和草铵膦及其代谢物
2020-09-17杨华梅刁春霞张雪梅
杨华梅, 杭 莉, 刁春霞*, 张雪梅
(泰州市疾病预防控制中心,江苏泰州 225300)
草甘膦(Glyp)和草铵膦(Gluf)均为非选择性、内吸附型的转基因作物耐受除草剂,他们的使用量分别位于世界第一和第二的位置[1,2],已被广泛应用于农业生产中。我国是农业大国,草甘膦、草铵膦的生产和使用量都位居世界前列[3]。草甘膦通过干扰肠道细菌,抑制CYP酶类,以及影响硫酸盐的运输活动,可增加乳糜泻、自闭症谱系障碍、不孕不育症、肥胖症以及癌症等临床疾病的患病风险[4]。草铵膦因其可能会对哺乳动物和非目标节肢动物造成危害,欧盟委员会已于2013年11月13日开始限制草铵膦除草剂的使用[5]。另外有研究显示草铵膦会造成人的DNA氧化性损伤[6],在使用草铵膦的地区,通过饮食和饮水可对人体和动物造成危害[7 - 9]。草甘膦在环境中主要有氨甲基膦酸(AMPA)、N-乙酰氨甲基膦酸(N-Acely-AMPA),他们具有与有机膦化合物类似的毒理作用[3]。草铵膦在环境中主要降解为3-甲基磷酸亚基丙酸(MPPA)。大量使用草甘膦和草铵膦必然会对土壤、水体及生物等造成极大的污染,并通过食物链的生物富集作用对人体产生潜在及长期的毒性[10]。因此,对草甘膦和草胺膦的检测具有重要意义。
目前文献报道较多的主要关于水中草甘膦及其氨甲基膦酸的测定,最常用的检测方法有柱后衍生液相色谱法[10,11]、柱前衍生液相色谱法[12,13]、柱前衍生液相色谱-质谱联用法[14]和液相色谱-质谱联用直接测定法[15]。但草甘膦与草铵膦及其代谢物同时检测的方法报道很少[12,16]。本文采用超高液相色谱-串联质谱法(UPLC-MS/MS)同时测定水中草甘膦、氨甲基膦酸、乙酰氨甲基膦酸、草铵膦和3-(甲基膦基)丙酸5种化合物。将此方法应用到泰州市自来水和河水中此5种物质的检测中,从而对泰州河水中草甘膦和草铵膦的富集污染情况有了初步了解。
1 实验部分
1.1 仪器与试剂
Waters ACQUITY超高效液相色谱(美国,Waters公司);AB SCIEX API4000+质谱仪(美国,AB公司);中佳HC-3018R高速冷冻离心机。
草甘膦(纯度99%)、氨甲基膦酸(纯度99%)、草铵膦(纯度99%)、3-(甲基膦基)丙酸(纯度99%)、乙酰氨甲基膦酸(纯度99%),均购于Sigma公司(美国)。称取以上各物质0.1 g于100 mL容量瓶中,用纯水定容,得浓度为1 mg/mL的标准储备溶液,于4 ℃下保存;混合标准使用液根据实验需要用0.1%甲酸水溶液稀释配制。乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);实验用水为屈臣氏瓶装蒸馏水。
1.2 水样的采集与储存方法
水样采集与储存同国家标准(GB/T 5750.9-2006)中的方法。泰州城区生活饮用水样品共采集20份,分别为二次供水4份、管网末梢水14份,出厂水4份;泰州城区内河水共43份;泰州城区周边农村河水13份。
1.3 样品前处理
将采集的水样充分混匀后,取1.0 mL于2.5 mL具塞塑料管中,加入1 μL甲酸,混匀,置于高速离心机中,以20 000 r/min离心10 min,取上清液直接测定。
1.4 超高效液相色谱-质谱条件
1.4.1 色谱条件色谱柱:SIELC Obelisc N柱(50 mm×2.1 mm,5 μm);流动相:0.1%甲酸水溶液+乙腈=99+1,等度洗脱。流速:0.6 mL/min;进样体积:20.0 μL;柱温:40 ℃;样品室温度:25 ℃。保留时间定性,峰面积外标法定量。
1.4.2 质谱条件电喷雾电离源,负离子(ESI-)扫描;采集模式:多反应监测(MRM)模式;碰撞气压力(CAD):4 Pa;气帘气压力(CUR):30 Pa;雾化气压力(GS1):65 Pa;辅助气压力(GS2):65 Pa;入口电压(EP):10 V;碰撞室出口电压(CXP):15 V;喷雾电压:4 000 V;气化温度:350 ℃。定量和定性离子、碰撞能量等参数见表1。

表1 5种物质的保留时间、相对分子质量和优化的质谱分析参数
2 结果与讨论
2.1 样品前处理条件的选择
草甘膦、氨甲基膦酸、乙酰氨甲基膦酸、草铵膦和3-(甲基膦基)丙酸5种化合物属于水溶性强极性的弱酸性化合物,在酸性条件下相对稳定,因此在处理水样时加入微量甲酸使样品呈微酸性。
2.2 色谱柱的选择
考察了Waters Atlantis T3色谱柱(250 mm×4.6 mm,5 μm)和SIELC Obelisc N色谱柱(50 mm×2.1 mm,5 μm)的分离效果。结果表明:5种化合物在Waters Atlantis T3色谱柱中出峰很快,并且拖尾严重。而SIELC Obelisc N色谱柱具有很好的极性特点,非常适用于极性以及带电样品的分离,在上述流动相条件下能将5种极性的待测物分离。故实验选择SIELC Obelisc N色谱柱(50 mm×2.1 mm,5 μm)。
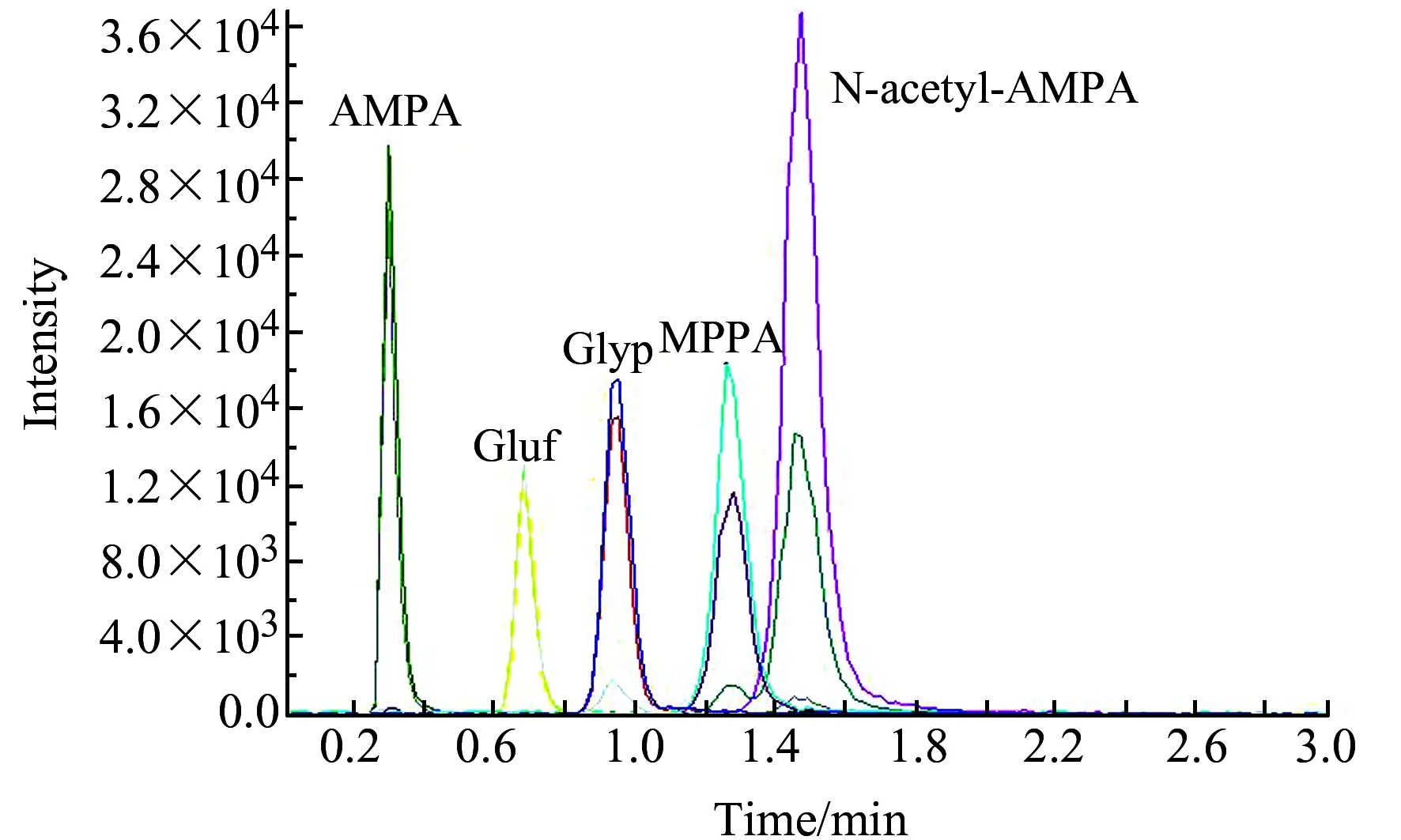
图1 5种标准混合物质的MRM色谱图Fig.1 MRM chromatograms of the five mixed standard solution
2.3 流动相的选择
比较了甲醇、甲醇∶0.1%甲酸水(50∶50)、甲醇∶0.1%甲酸水(30∶70)、甲醇∶0.1%甲酸水(1∶99)等几种流动相,发现甲醇∶0.1%甲酸水(1∶99)能够很好的分离5种待测物。在0.2~1.0 mL/min范围内改变流动相流速,在0.6 mL/min时出峰时间合适,峰形较好。综合考虑,确定测定的色谱条件为:流动相为甲醇∶0.1%甲酸水(1∶99),流速0.6 mL/min,柱温40 ℃,进样量:20 μL。各个待测物的MRM色谱图如图1所示。
2.4 线性关系
5种待测物储备溶液用0.1%甲酸水溶液稀释配制成10 μg/mL的标准混合溶液,然后再稀释成浓度为1、2、5、10、20、50、100、200、500 ng/mL标准工作溶液系列。以上述色谱-质谱条件,对系列标准工作液进行分析,采用多点线性校正,建立峰面积-待测物浓度标准曲线。以3倍噪音为样品检出限。本方法5种物质的回归方程、线性相关系数和检出限见表2。

表2 5种化合物的线性方程、相关系数、检出限(LOD)
2.5 回收率、精密度和检出限
在处理的水样中添加标准混合溶液,制备20、50、150 ng/mL 3个浓度加标水平的样品,每个浓度水平设6个平行样品。用本方法进行测定,平均回收率和相对标准偏差见表3。

表3 回收率与相对标准偏差试验结果(n=6)
2.6 方法的应用
用本方法分别对泰州市生活饮用水20份、城区河水共43份和周边农村河水13份样进行检测。其中生活饮用水中5种化合物均为检出;城区河水中草甘膦和氨甲基膦酸检出率分别为74.4%和72.1%,浓度范围分别为0.36~0.59 μg/L和0.15~7.23 μg/L,其余3种物质均未检出;周边农村河水中草甘膦和氨甲基膦酸检出率分别为15.4%和76.9%,浓度范围分别为0.43~0.50 μg/L和0.30~1.60 μg/L,其余3种物质均未检出。部分样品色谱见图2和图3。生活饮用水中草甘膦和其代谢物没有检出可能是饮用水中余氯对草甘膦的分解有较大影响[17]。

图2 样品中氨甲基膦酸的MRM色谱图Fig.2 MRM chromatogram of AMPA in the sample
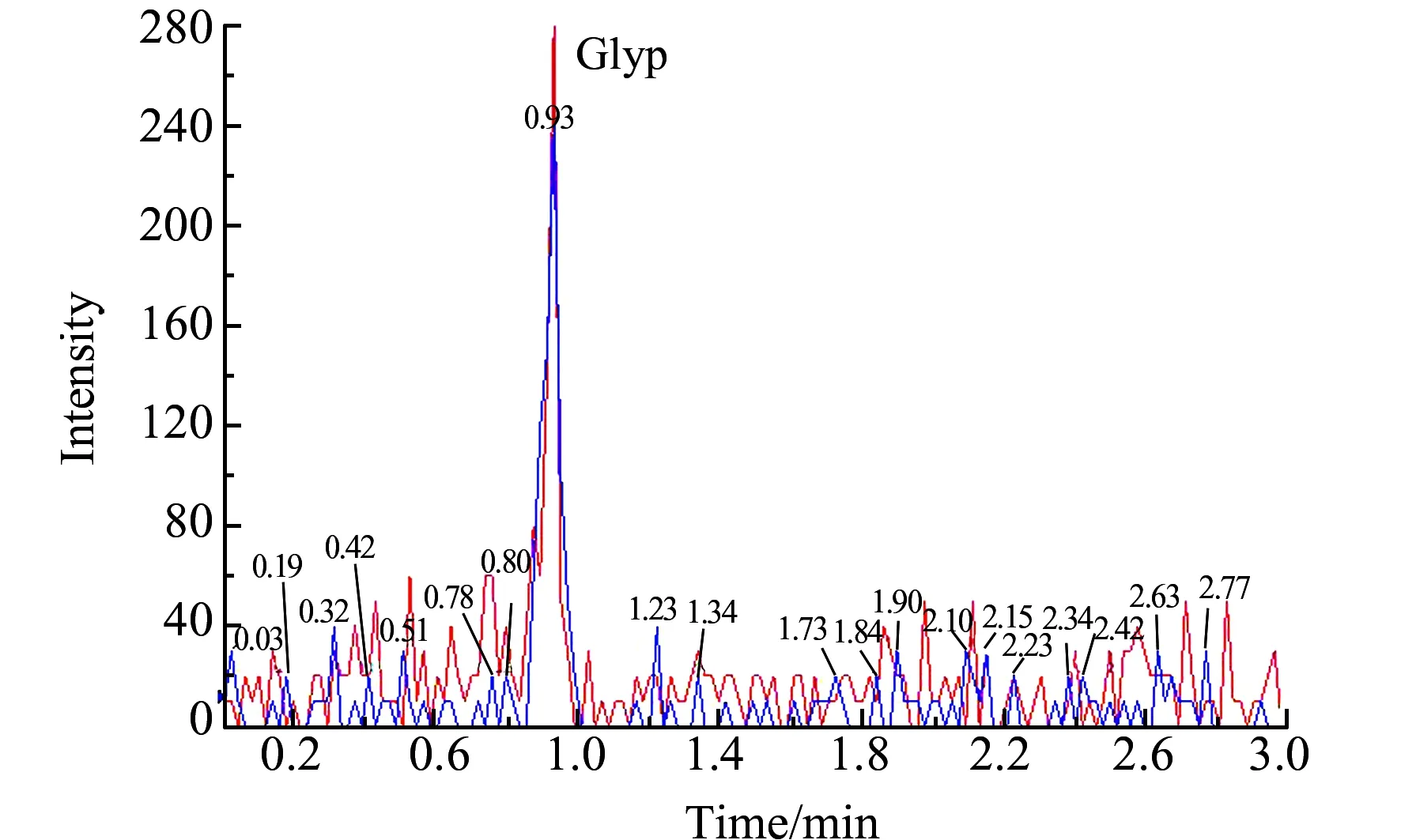
图3 样品中草甘膦的MRM色谱图Fig.3 MRM chromatogram of Glyp in the sample
3 结论
本研究建立了超高效液相色谱-串联质谱法同时测定水样中草甘膦、氨甲基膦酸、乙酰氨甲基膦酸、草铵膦和3-(甲基膦基)丙酸5种化合物。该方法简便、快速、准确,适用于水中草甘膦、氨甲基膦酸、乙酰氨甲基膦酸、草铵膦和3-(甲基膦基)丙酸的残留检测。通过对泰州市生活饮用水和河水中5种有机膦农药及其代谢物的检测,大致了解了泰州市生活饮用水和河水中有机膦农药及其代谢物的污染情况。城区河水中草甘膦代谢物检出率比周边农村河水高可能是城区河水的流动性差导致的。由于采集样品数量有限,故结果不足以说明泰州河水中草甘膦污染的整体趋势,不过从另一方面可以推断,泰州河水正经受着一定程度上草甘膦的污染,这种情况与近年来对除草剂草甘膦的大量使用有着一定的关系。
