复合菌种协同发酵制备鸡肉香精前体物工艺的研究
2020-09-17王聪马浩然李佩佩刘军马露王丽萍张喜康刘敦华
王聪,马浩然,李佩佩,刘军,马露,王丽萍,张喜康,刘敦华
(宁夏大学 农学院,银川 750021)
鸡肉同猪肉、牛肉相比,口感细腻、味道鲜美且脂肪含量较低[1]。肉味香精的前体物多为大豆分离蛋白和肉制品,其中发酵肉制品作为肉味香精的前体物已成为制备肉味香精的重要原料之一。发酵肉是指利用微生物发酵技术应用于肉中,经过发酵制备的一种具有良好发酵风味的肉制品[2]。
本文首先通过对菌种的发酵特性进行测定,确定菌种的最佳培养时间及生长环境的食盐浓度,并对菌种进行蛋白酶、脂肪酶测定及活菌计数,确保菌种在发酵过程中具有较高活性,达到最佳发酵效果。再通过单因素实验与响应面分析法,研究探讨菌种配比、发酵温度、发酵时间、发酵剂接种量对氨基态氮含量、感官评分的影响,在此基础上确定鸡肉香精制备的前体物的最佳发酵条件,为制备鸡肉香精原料的研究提供了基础数据与理论依据。
1 材料与方法
1.1 材料与试剂
戊糖片球菌(Pediococcuspentosaceus,CICC 22227)、木糖葡萄球菌(Staphylococcusxylose,CICC 21445)、干酪乳杆菌(Lactobacilluscasei,CICC 20282):均为冻干粉,购于中国工业微生物菌种保藏管理中心(CICC)。氯化钠(分析纯,纯度≥99.5%):国药集团化学试剂有限公司;甲醛溶液(分析纯,纯度37.0%~40.0%):天津市瑞金特化学品有限公司;三丁酸甘油酯(高级纯,纯度≥98.0%):合肥博美生物科技有限责任公司;各培养基成分物质:均为分析纯;食盐、葡萄糖、亚硝酸钠、异VC钠:均为食品级,购于宁夏恒元创科贸有限公司;鸡胸肉:购于银川新华百货宁阳店。
1.2 仪器与设备
TDL-5-A型低速台式大容量离心机 上海安亭科学仪器厂;BSP-250型生化培养箱 上海博讯实业有限公司;AIR TECH型超净工作台 苏净集团安泰公司;FiveEasy Plus型pH计 梅特勒-托利多公司;DSX-280型手提式压力蒸汽灭菌锅 上海申安医疗器械厂;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 培养基的制备
MRS培养基:参照王亚男的方法[3];MSA培养基:参照张文娟的方法[4];耐盐性培养基、营养琼脂培养基、平板计数培养基:参照何健叶的方法[5,6]。
1.3.2 菌种生长曲线及产酸曲线的测定
将3株菌(干酪乳杆菌、戊糖片球菌、木糖葡萄球菌)在超净工作台中活化2次,用移液管吸取1.5 mL的菌液于150 mL的液体培养基中,并将液体培养基分装于15个试管中,置于生化培养箱中培养,温度为37 ℃,以2 h为时间间隔,依次取出一支试管测定其pH值与OD600值。
1.3.3 菌种耐盐特性的测定
将菌株培养至对数生长期时,以1 mL的接种量分别无菌接种于含有0%、2%、4%、6%、8%、10% NaCl的10 mL MRS、MSA培养基中,以37 ℃培养48 h,分别测定其在600 nm波长下的吸光值(OD600值)。
1.3.4 菌种蛋白酶和脂肪酶特性的测定
蛋白酶活性:参考樊明明等[7]的方法,并略作修改。分别向MRS、MSA固体培养基中添加15%脱脂乳粉作为蛋白酶检测培养基,将各菌株培养至24 h,在超净工作台中吸取各菌株的菌液0.5 mL,均匀涂布于具有脱脂乳粉的MRS、MSA固体培养基中,37 ℃培养48 h后观察菌落周围是否有透明环,有透明环说明该菌株具有分泌蛋白酶的特性。
脂肪酶活性:参考帅瑾[8]的方法,并略作修改。分别向MRS、MSA固体培养基中添加1%三丁酸甘油酯作为脂肪酶检测培养基,将各菌株培养至24 h,在超净工作台中吸取各菌株的菌液0.5 mL,均匀涂布于具有脱脂乳粉的MRS、MSA固体培养基中,37 ℃培养48 h后观察菌落周围是否有透明环,若有,说明该菌株具有分泌脂肪酶的特性。
1.3.5 活菌计数
参考卜宁霞[9]的方法,将活化至对数生长期的菌液离心,离心速度为4000 r/min,时间为20 min,倒掉上清液,将菌体以0.85%的生理盐水进行悬浮,得到发酵剂,并对菌液进行梯度稀释后用平板计数法活菌计数。
1.3.6 工艺流程
原料选择→预处理→绞肉→腌制→发酵→成品。
1.3.7 操作要点
原料选择:选择新鲜的鸡胸肉。
预处理:去除可见的脂肪和筋膜。
绞肉:将处理后的鸡胸肉用绞肉机绞碎至肉糜。
腌制:将鸡肉糜中加入食盐3%、葡萄糖1%、亚硝酸钠0.01%、异VC钠0.5%,并搅拌均匀置于冰箱中进行腌制,温度为4 ℃,时间为5~6 h。
发酵:腌制结束后,按一定接种量将复合发酵剂接种于鸡肉糜中,置于保温培养箱中进行发酵。
1.3.8 鸡肉糜发酵特性单因素试验
1.3.8.1 菌种配比的选择
在预试验的基础上,将3种比例发酵剂(干酪乳杆菌∶戊糖片球菌∶木糖葡萄球菌分别为1∶1∶1、1∶1∶2、1∶1∶3、1∶2∶1、1∶2∶2)接种于腌制后的鸡肉糜中,接种量为3%(108CFU/g),在30 ℃的条件下发酵45 h,对发酵成品进行氨基态氮含量和感官评价的测定。
1.3.8.2 发酵剂接种量的选择
在预试验的基础上,将腌制后的鸡肉糜中加入发酵剂(干酪乳杆菌∶戊糖片球菌∶木糖葡萄球菌为1∶1∶2),接种量分别为1%、2%、3%、4%、5%(108CFU/g),在30 ℃的条件下发酵45 h,对发酵成品进行氨基态氮含量和感官评价的测定。
1.3.8.3 发酵温度的选择
在预试验的基础上,将腌制后的鸡肉糜中加入发酵剂(干酪乳杆菌∶戊糖片球菌∶木糖葡萄球菌为1∶1∶2),接种量为3%(108CFU/g),分别在温度为20,25,30,35,40 ℃的条件下发酵45 h,对发酵成品进行氨基态氮含量和感官评价的测定。
1.3.8.4 发酵时间的选择
在预试验的基础上,将腌制后的鸡肉糜中加入发酵剂(干酪乳杆菌∶戊糖片球菌∶木糖葡萄球菌为1∶1∶2),接种量为3%(108CFU/g),在30 ℃的条件下分别发酵30,35,40,45,50 h,对发酵成品进行氨基态氮含量和感官评价的测定。
1.3.9 响应面试验
在单因素试验的基础上,确定各因素的最适水平范围,建立了三因素三水平的响应面试验模型。以氨基态氮含量为指标,优化制备鸡肉香精前体物的工艺条件,响应面试验因素水平表见表1。

表1 Box-Benhnken试验因素水平表Table 1 The factors and levels of Box-Behnken design
1.3.10 测定指标及方法
氨基态氮含量的测定[10]:采用甲醛滴定法测定发酵鸡肉糜中的氨基态氮含量。
1.3.11 感官评价
由10名经过培训的教师、学生组成评定小组,对发酵鸡肉糜的组织状态、色泽、气味等指标逐一进行打分,满分为100分,感官评价标准见表2。

表2 发酵鸡肉糜感官评价表Table 2 Sensory evaluation table of fermented chicken mince
1.3.12 数据处理
数据的统计分析与绘图采用Excel 2016;响应面绘图与方差分析采用Design Expert 8.0.6。
2 结果与分析
2.1 菌种生长曲线及产酸曲线的测定
由图1和图2可知,干酪乳杆菌、戊糖片球菌、木糖葡萄球菌分别在培养6,8,12 h后进入对数生长期,16,16,28 h后进入生长稳定期。干酪乳杆菌在6~16 h间pH值下降速率较快;戊糖片球菌在8~16 h间pH值下降速率较快;木糖葡萄球菌在16~26 h间pH值缓慢下降,在26~28 h下降速率加快。干酪乳杆菌、戊糖片球菌、木糖葡萄球菌的pH值下降趋势分别与其生长密度上升趋势相对应。其中干酪乳杆菌和戊糖片球菌较先进入对数生长期,并且产酸量较大,在发酵过程中快速生长成优势菌,抑制其他微生物的生长,有利于产品形成乳酸风味以及保证产品在发酵过程中的安全性。木糖葡萄球菌的产酸量较小,其在发酵体系中可与干酪乳杆菌、戊糖片球菌复合使用,形成特殊的发酵风味。

图1 干酪乳杆菌、戊糖片球菌、木糖葡萄球菌产酸曲线Fig.1 The acid production curves of Lactobacillus casei, Pediococcus pentosaceus, Staphylococcus xylose
根据生长曲线和产酸曲线得出3种菌制备发酵剂的最佳培养时间为:干酪乳杆菌10~12 h,戊糖片球菌12~14 h,木糖葡萄球菌26~28 h。
2.2 菌种耐盐性的测定
菌种耐盐特性的测定结果见图3。
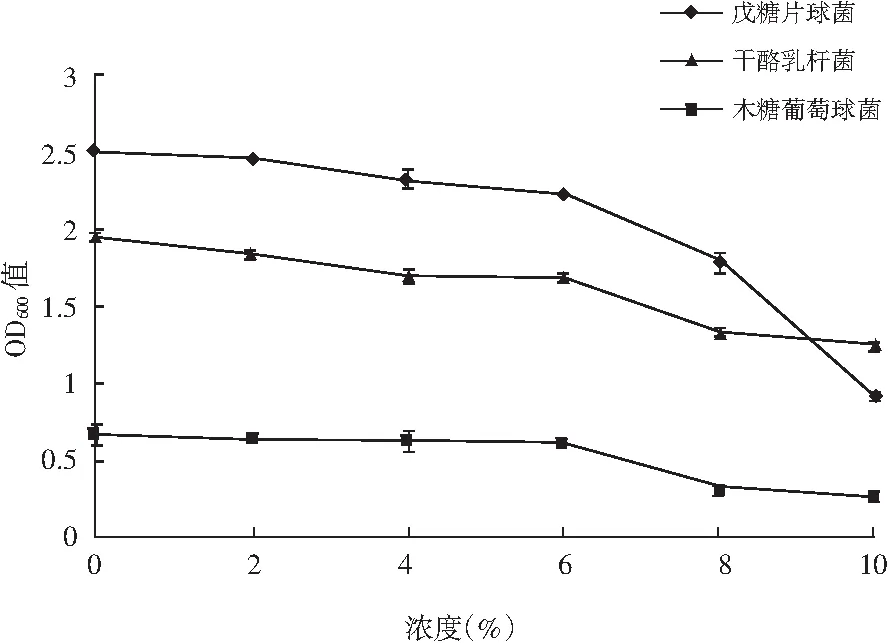
图3 菌种耐盐特性Fig.3 The salt tolerance of strains
由图3可知,随着食盐浓度的增加,3株菌的OD600值均呈先稳定后下降的趋势,食盐浓度范围在0%~6%时,3株菌的OD600值均趋于稳定,说明3株菌在次食盐浓度条件下均能够正常生长。3株菌在食盐浓度高于6%时,OD600值均迅速下降,表明高于6%的食盐浓度会对菌株的生长产生抑制作用。当盐浓度较高时,外界环境渗透压变大,微生物的细胞容易失水,从而抑制了微生物的生长。发酵肉制品中食盐的添加量为2%~4%时,3株菌均能够正常生长,因此干酪乳杆菌、戊糖片球菌与木糖葡萄球菌均可用于发酵肉制品的生产中。
2.3 测定菌种的脂肪酶和蛋白酶特性
菌种蛋白酶和脂肪酶特性的测定结果见表3。

表3 菌种的蛋白酶和脂肪酶特性测定Table 3 Protease and lipase characteristics of strains
由表3可知,干酪乳杆菌仅具有蛋白酶活性;戊糖片球菌与木糖葡萄球菌同时具有蛋白酶活性和脂肪酶活性。蛋白酶能催化蛋白质肽键的水解[11]。蛋白质能够在微生物分泌的蛋白酶和内源性组织蛋白酶的共同作用下水解,蛋白质水解后,肌肉结构被破坏,释放出大量的游离氨基酸、脂肪酸等物质,从而影响肉制品的风味,使肉制品具有特殊的组织状态与发酵风味[12]。
2.4 菌种的活菌计数
活菌计数结果见表4。

表4 活菌计数结果Table 4 Live bacteria count results
发酵肉制品生产中发酵剂接种量一般在106CFU/g[13],由表4可知,3种菌的计数结果都≥106CFU/g,均满足发酵肉制品的生产接种量要求。
2.5 发酵鸡肉糜单因素试验
2.5.1 菌种配比的选择


图4 鸡肉糜在不同菌种比例下的氨基态氮含量和感官评价Fig.4 Amino nitrogen content and sensory evaluation of chicken mince in different bacteria proportions
由图4可知,5组中菌种配比为1∶1∶2与1∶1∶3的两组感官评分较高,其中,菌种配比为1∶1∶2组的鸡肉糜氨基态氮含量最高,为0.26%。氨基态氮含量高,说明鸡肉糜鲜味浓郁[14]。干酪乳杆菌和戊糖片球菌为乳酸菌,而乳酸菌比例会影响产品的酸度,从而影响产品的风味。此外,菌种比例为1∶1∶2组的感官评分值也较高。在此条件下其产品中的氨基酸含量较高,整体风味较协调。因此,确定菌种的最佳配比为干酪乳杆菌∶戊糖片球菌∶木糖葡萄球菌为1∶1∶2。
2.5.2 接种量的选择


图5 鸡肉糜在不同发酵剂接种量下的氨基态氮含量和感官评价Fig.5 Amino nitrogen content and sensory evaluation of chicken mince under different starter inoculation amount
由图5可知,鸡肉糜的氨基态氮含量随着接种量的增加呈先上升后下降的趋势,这可能是由于较高的发酵剂接种量会导致微生物过度生长,氮源作为营养物质消耗过多,从而造成氨基态氮含量降低;而发酵剂接种量过低会导致微生物发酵不完全,风味物质产生不足[15,16]。从感官评分来看,接种量为2%、3%、4%的产品感官评分值较高且氨基态氮含量较高,因此,选择菌种接种量的最适水平为2%、3%、4%。
2.5.3 发酵温度的选择

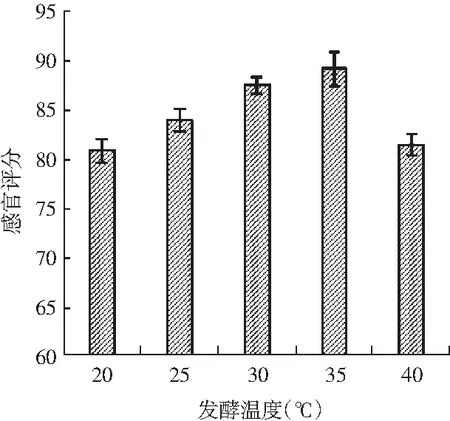
图6 鸡肉糜在不同发酵温度下的氨基态氮含量和感官评价Fig.6 Amino nitrogen content and sensory evaluation of chicken mince at different fermentation temperatures
菌种都有一个最适生长温度范围,在最适生长温度下,菌种会快速生长繁殖,有利于菌种发酵性能的增加[17]。由图6可知,在20~40 ℃温度区间内,随着发酵温度的增加,鸡肉糜的氨基态氮含量呈先上升后下降的趋势,说明温度对鸡肉糜的氨基态氮值有一定的影响[18]。发酵温度在25,30,35 ℃的鸡肉糜氨基态氮含量较高。从感官评价来看,发酵温度在25,30,35 ℃时的感官评分值较高,发酵温度过低或过高均会影响发酵效果,导致产品的感官评分较低。因此,综合来看,发酵温度在25,30,35 ℃时能达到较好的发酵鸡肉糜品质。
2.5.4 发酵时间的选择
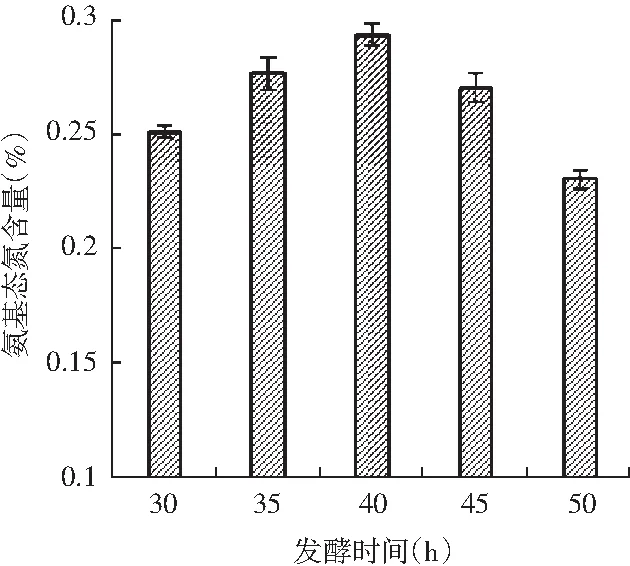

图7 鸡肉糜在不同发酵时间下的氨基态氮含量和感官评价Fig.7 Amino nitrogen content and sensory evaluation of chicken mince under different fermentation time
由图7可知,随着发酵时间的增加,鸡肉糜的氨基态氮含量呈先上升后下降的趋势,可能是由于鸡肉中的蛋白质和肽被微生物降解,氨基态氮含量逐渐升高,但随着发酵时间增加到50 h时,鸡肉糜中的氮源逐渐被消耗,从而导致氨基态氮含量降低。从感官评价来看,发酵时间在35,40,45 h时的感官评分值较高,发酵时间过短会导致发酵效果差,发酵不完全,产品的风味较差;而发酵时间过长则会增加生产成本,产品由于过酸等原因导致感官评分较低。因此,综合来看,发酵时间在35,40,45 h时为菌种最适的发酵时间水平。
2.6 响应面试验
Box-Behnken试验设计及结果见表5。

表5 Box-Behnken试验设计及结果Table 5 Box-Behnken test design and result
2.7 回归分析
A(发酵剂接种量),B(发酵温度),C(发酵时间)与响应值的二次多项回归模型为:氨基态氮含量=0.3-0.002625A+0.014B+0.004375C-0.0035AB-0.016AC-0.00175BC-0.04A2-0.023B2-0.028C2。回归模型方差分析结果见表6。

表6 回归模型方差分析Table 6 Regression model variance analysis
由表6可知,回归模型P<0.0001,表明响应面模型极显著,失拟项P=0.1233,不显著,相关系数 R2=0.9910,RAdj2=0.9793,表明模型能够反映97.93%响应值的变化。经F检验,回归方程中B、AC、A2、B2、C2对产品氨基态氮含量影响极显著(P<0.01),C对产品氨基态氮含量影响显著(P<0.05),本试验 C.V .(%)值为1.82。因此,此模型方程具有较高的可靠性,可用于分析各因素对发酵鸡肉糜氨基态氮含量的影响。
2.8 交互作用分析
响应面的3D曲面图和等高线图见图8~图10。
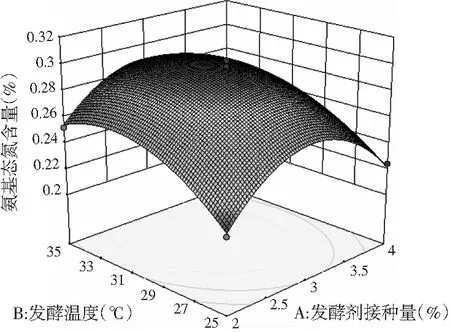

图8 发酵温度和发酵剂接种量对鸡肉糜氨基态氮含量的影响Fig.8 Effect of fermentation temperature and starter inoculation amount on amino nitrogen content in chicken mince


图9 发酵时间和发酵剂接种量对鸡肉糜氨基态氮含量的影响Fig.9 Effect of fermentation time and starter inoculation amount on amino nitrogen content in chicken mince

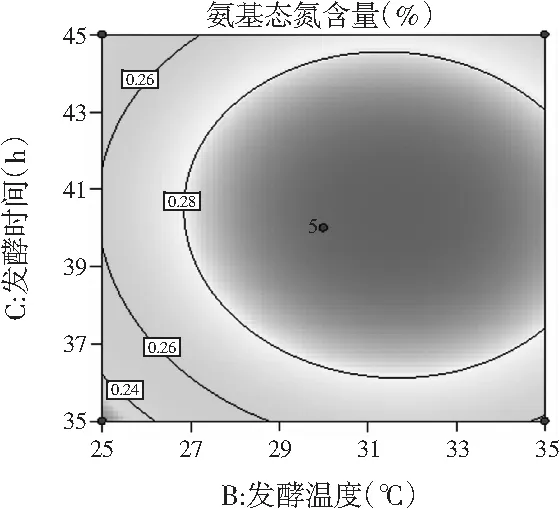
图10 发酵温度和发酵时间对鸡肉糜氨基态氮含量的影响Fig.10 Effect of fermentation temperature and fermentation time on amino nitrogen content in chicken mince
由图8中的响应曲图可以看出,当发酵温度恒定时,随着发酵剂接种量的增加,氨基态氮含量呈先增加后减少的趋势;当发酵剂接种量不变时,随着发酵温度的增加,氨基态氮含量呈先增加后减小的趋势。这是因为发酵剂的接种量越小,不完全发酵将导致发酵效果差和风味物质越少;发酵剂的接种量越大,微生物的生长越旺盛,大量氮源物质的消耗会导致氨基态氮含量减少。而过高或过低的发酵温度都会抑制菌株的生长,温度条件应在菌株生长繁殖的最佳温度范围内,以充分发挥最佳发酵效果。由图9中的响应曲图可以看出,当发酵时间恒定时,氨基态氮含量随着发酵剂接种量的增加先增加后减少;当发酵剂接种量不变时,响应值氨基态氮含量随着时间的增加先增加后减少。由图10中的响应曲图可以看出,当发酵时间恒定时,响应值氨基态氮含量随着发酵温度的升高先增加后减少;当发酵温度恒定时,响应值氨基态氮含量随着发酵时间的增加先增加后减少。
由图8~图10中的等高线图可以看出,图9中的等高线图呈椭圆形,因此AC项之间的交互作用显著(P<0.05),即发酵剂接种量和发酵时间之间的交互作用对氨基态氮含量的影响显著(P<0.05);图8和图10中的等高线图趋向于圆形,表明A(发酵剂接种量)和B(发酵温度)、B(发酵温度)和C(发酵时间)之间的交互作用对氨基态氮含量的影响不显著(P>0.05),这一结论与方差分析结果一致,均表明只有AC项之间的交互作用显著。
2.9 最佳工艺及验证试验
经Design Expert 8.0.6软件分析得到的最佳发酵工艺条件为:发酵剂接种量为2.937%(108CFU/g),发酵温度为31.541 ℃,发酵时间为40.428 h,氨基态氮含量预测值为0.3000%。为了便于工业生产,将工艺条件调整为:发酵剂接种量为3%(108CFU/g),发酵温度为31 ℃,发酵时间为40 h,在此工艺条件下进行了3次平行验证试验,发酵鸡肉糜的平均氨基态氮值为0.2912%,与预测值相比,误差仅为2.93%,说明该模型的可信度较高。
3 结论
为制备鸡肉香精前体物,通过单因素和响应面法确定最佳工艺条件:菌种配比为干酪乳杆菌∶戊糖片球菌∶木糖葡萄球菌为1∶1∶2,发酵剂接种量为3%(108CFU/g),发酵温度为31 ℃,发酵时间为40 h,在此工艺条件下得到的发酵鸡肉糜氨基态氮含量最大,为0.3%。该模型可信度较高,可以预测发酵鸡肉糜的氨基态氮含量值。在此条件下得到的发酵鸡肉糜形状均匀、协调,有浓郁的发酵气味。
