水杨酸钠诱导耳鸣大鼠海马中TNF-α、IL-1β的表达△
2020-09-17肖倩文左健葛佳丽王采集李雅兰李婷乔月华
肖倩文 左健 葛佳丽 王采集 李雅兰 李婷 乔月华
耳鸣是机体在无外界声音刺激时对声音的幻觉感知,慢性耳鸣患者常伴有焦虑、抑郁、失眠和注意力不集中等症状,严重影响工作和日常生活[1]。耳鸣的发病机制尚不明确,普遍认为中枢神经系统的结构和功能异常可能是造成耳鸣的重要因素之一。水杨酸钠是目前常用的诱导模型动物耳鸣发作的药物,研究发现,耳蜗是水杨酸钠损伤听觉通路的起始阶段,并可逐步侵及中枢神经系统,主要表现为神经活动异常和听觉系统的神经可塑性改变[2]。
最新研究显示,除中枢听觉系统外,属于非听觉脑区的边缘系统也可能参与了耳鸣的发生发展;海马区是边缘系统的重要组成部分,在调节情绪反应、学习记忆等方面发挥重要作用[3]。已有研究证实,长期腹腔注射水杨酸钠可引起大鼠海马突触结构改变和葡萄糖代谢水平增加[4],因此,研究者认为,海马区可能参与水杨酸钠诱导的耳鸣并扮演重要角色。耳鸣患者常伴有焦虑、抑郁等情绪,而焦虑和抑郁等情绪反应可激活下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPA)和交感-肾上腺髓质轴(sympatheticoadreno-medullary axis, SAM),可伴有炎症因子分泌失调[5]。研究发现,慢性耳鸣患者外周血中肿瘤坏死因子α(TNF-α)和白介素1β(IL-1β)水平升高,其含量变化与情绪困扰的严重程度存在相关性[6];此外,在水杨酸钠诱导耳鸣动物模型的耳蜗核和下丘组织中也可检测到TNF-α和IL-1β表达增加[7]。TNF-α和IL-1β可上调中枢系统中 N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR)表达水平,引起神经损伤、慢性疼痛等多种疾病[8]。然而,海马区炎症反应是否参与水杨酸钠诱导耳鸣的发生发展以及相关的机制研究未见报道。本研究拟通过建立水杨酸钠诱导耳鸣大鼠模型,检测其海马中TNF-α、IL-1β与 N-甲基-D-天冬氨酸受体2B亚基(N-methyl-D-aspartate receptor 2B, NMDAR2B)的表达变化,初步探讨海马区炎症反应对耳鸣的作用及其可能的机制,为耳鸣的发病机制研究提供新的思路。
1 材料与方法
1.1实验动物及分组 健康雄性SD大鼠18只,体重250~300 g,购自徐州医科大学动物中心。大鼠耳廓反应灵敏,无噪声暴露、中耳感染和耳毒性药物服用史。将大鼠随机分为3组:对照组、水杨酸钠注射14天组(S14组)和停药后恢复7天组(R7组),每组6只。
1.2主要试剂 水杨酸钠购自美国Sigma公司; Trizol试剂购自Life Technology 公司;组织蛋白提取试剂盒购自上海生工生物工程技术有限公司;BCA测定试剂盒购自上海碧云天生物技术有限公司; 荧光定量PCR(quantitative PCR, qPCR)试剂盒购自Roche公司;引物由华大基因公司合成;兔多克隆抗TNF-α、IL-1、NMDAR2B抗体购自美国Abcam公司;鼠单克隆抗-actin抗体购自美国CST公司。
1.3建立水杨酸钠诱导耳鸣大鼠模型
1.3.1各组动物用药剂量及方法 对照组:分别于早上8点和下午4点腹腔注射生理盐水200 mg/kg,连续注射14天;S14组:分别于早上8点和下午4点腹腔注射水杨酸钠200 mg/kg,连续注射14天;R7组:连续腹腔注射水杨酸钠14天后(剂量与方法同注射14天组),停药恢复7天。
1.3.2惊跳反射前脉冲抑制(prepulse inhibition,PPI)检测[9]于造模前后分别检测各组大鼠前脉冲抑制率。为了更加准确地利用间隙检测实验来评估大鼠耳鸣,实验动物需置于环境噪声为60 dB SPL的消音室且载有压力感受器的平台上。每次实验中,大鼠需提前适应于声强刺激为65 dB SPL的白色背景噪声中,检测信号被传感器接收并传送到特定的电脑,用于收集惊吓反应数据。检测期间,起初给予大鼠10次声强为115 dB SPL的脉冲刺激,其次,通过扬声器随机给予大鼠30次声音刺激,包括:10次声强为115 dB SPL的脉冲刺激,10次没有前脉冲的惊跳反射刺激和10次前脉冲惊跳反射刺激。前脉冲刺激为100 ms, 它包含20 ms的白噪声脉冲刺激,该刺激为75 dB SPL、80 dB SPL和85 dB SPL(分别记为PPI2、PPI4和PPI8)三种不同声强的前脉冲刺激,惊跳刺激之间相隔27~32 s。前脉冲抑制率计算公式为:PPI%=(1-PPI/ASR)×100%。
1.3.3听性脑干反应(ABR)检测 造模前后分别检测各组大鼠ABR。各组大鼠经2%戊巴比妥钠溶液(50 mg/kg)麻醉后,置于环境噪声低于30 dB SPL的隔声屏蔽室内并注意保暖。将记录电极置于两侧外耳道口与颅正中线交点处的皮下,参考电极置于单侧耳乳突皮下,接地电极置于鼠尾根部。采用校准后的TDT系统进行ABR检测,将耳机置于大鼠外耳道口1 cm处,采用短声进行单耳给声刺激,刺激速率为21次/秒,观察时程为10 ms,带通滤波为100~3 000 Hz,叠加次数为500次。测试声强度从80 dB SPL开始, 然后依次以5 dB SPL递减,以引出波Ⅲ的最小刺激声强度作为ABR反应阈,记录各组大鼠ABR阈值。
1.4大鼠海马组织获取及TNF-α、IL-1、NMDAR2B检测 完成PPI及ABR检测后,断头处死各组大鼠,迅速分离出海马,置于-80 ℃冰箱保存备用,用于mRNA及蛋白检测。
1.4.1荧光定量PCR 使用Trizol法提取海马组织总RNA,紫外分光光度计分析RNA浓度。使用TaKaRa公司的反转录试剂盒合成cDNA,反应条件为:70 ℃ 10 min,4 ℃ 10 min,42 ℃ 60 min,70 ℃ 15 min。产物稀释后用SYBR Green做荧光定量PCR,以GAPDH为内参,扩增条件为:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火、延伸1 min,进行40个循环。结果采用2-△△CT法计算差异倍数。不同基因的PCR引物见表1。

表1 引物列表
1.4.2Western Blot检测 使用组织蛋白提取试剂盒提取海马组织总蛋白,采用BCA法测定蛋白浓度。配制12% SDS-PAGE胶,各组取等量总蛋白进行电泳,用湿转法将蛋白转移至NC膜上;然后用5%脱脂奶粉封闭NC膜1 h,加入相应一抗稀释液(1∶1 000稀释)并于4 ℃过夜孵育。第二天回收抗体,用PBS洗涤3遍,加入红外荧光标记的二抗稀释液(1∶10 000稀释)并于室温孵育1 h。回收抗体,用PBS洗涤3遍,将NC膜放入Odyssey红外荧光扫描成像系统扫描蛋白条带,分析TNF-α、IL-1β、NMDAR2B及内参蛋白β-Actin的表达变化。
1.5统计学方法 采用Graphpad Prism7.0软件对数据进行统计分析。组间比较采用单因素方差分析(Tukey事后检验),P<0.05为差异有统计学意义。
2 结果
2.1PPI抑制率及ABR检测结果 对照组和S14组大鼠三种不同声强前脉冲刺激的前脉冲抑制率见表2,结果显示,腹腔注射水杨酸钠14天后大鼠三种不同声强的前脉冲抑制率显著增加,与对照组比较,差异均有统计学意义(均为P<0.001),表明腹腔注射水杨酸钠成功导致了大鼠耳鸣,建模成功。

表2 对照组和S14组三种不同声强前脉冲刺激的 PPI抑制率
ABR检测结果:水杨酸钠注射前,各组大鼠ABR反应阈差异无统计学意义(P>0.05);注射水杨酸钠14天后,S14组ABR反应阈较对照组显著升高(P<0.01);R7组ABR反应阈与对照组差异无统计学意义(P>0.05)(表3),表明腹腔注射水杨酸钠可导致大鼠可逆性的听力下降。

表3 各组大鼠造模前后ABR反应阈
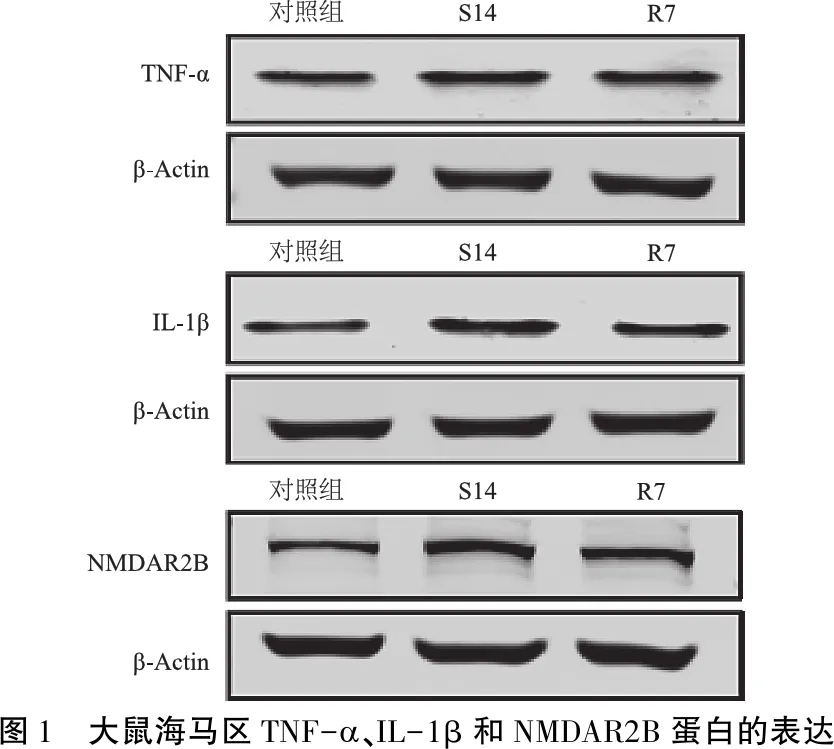
2.2TNF-α 在海马中的表达 与对照组相比较,S14组大鼠海马区TNF-α mRNA表达水平显著升高(P<0.01);R7组TNF-α mRNA表达水平与对照组的差异无统计学意义(P>0.05)(表4)。Western Blot 结果显示,与对照组比较,S14组大鼠海马区TNF-α 蛋白水平显著升高(P<0.01),而R7组与对照组的差异无统计学意义(P>0.05)(图1、表5)。
2.3IL-1β 在海马中的表达 与对照组相比,S14组、R7组大鼠海马区 IL-1β mRNA表达水平均显著升高(P<0.05)(表4)。Western Blot结果显示,S14组海马区IL-1β 蛋白水平较对照组显著上升(P<0.001),而R7组虽有下降趋势,但与对照组相比仍有统计学差异(P<0.05)(图1、表5)。
2.4NMDAR2B在海马中的表达 与对照组相比,S14组大鼠海马区NMDAR2B mRNA表达水平显著升高(P<0.001), R7组NMDAR2B mRNA表达水平与对照组的差异无统计学意义(P>0.05)(表4)。Western Blot结果显示,与对照组比较,S14组NMDAR2B蛋白水平显著升高(P<0.01),而R7组与对照组的差异无统计学意义(P>0.05)(图1、表5)。

表4 大鼠海马区TNF-α、IL-1β和 NMDAR2B mRNA相对表达水平

表5 大鼠海马区TNF-α、IL-1β和 NMDAR2B蛋白相对表达水平
3 讨论
腹腔注射水杨酸钠是建立耳鸣动物模型的常用实验方法,检测前脉冲抑制率常被用来评估耳鸣现象是否存在[7,9]。从本研究结果看,腹腔注射水杨酸钠14天(200 mg/kg,每天2次)可导致大鼠前脉冲抑制率显著增加,表明该方法成功诱导了大鼠耳鸣;同时,S14组大鼠ABR阈值显著高于对照组,而R7组大鼠ABR阈值与对照组相比并无显著差异,提示腹腔注射水杨酸钠可导致大鼠可逆性的听力下降,与文献[10]报道一致。
耳鸣常导致患者失眠、焦虑或抑郁等情绪障碍,而这些情绪障碍反过来又可加重患者对耳鸣的主观感受,从而形成恶性循环,严重影响患者的生活质量[11]。因此,情绪相关脑区如何参与耳鸣的发生、发展以及耳鸣发病的心理学机制研究逐渐成为研究热点。海马不仅是边缘系统的重要结构,也是HPA轴的高级调节中枢,与焦虑、抑郁等情绪调节密切相关。TNF-α和IL-1β是中枢神经系统重要的促炎细胞因子,在宿主发生感染、创伤或应激等时,主要由神经元、小胶质细胞和星型胶质细胞等表达产生[12,13]。越来越多的研究发现,海马中TNF-α和IL-1β升高引起的炎症反应与抑郁等情绪障碍关系密切[6]。TNF-α、IL-1β等促炎性细胞因子的升高能够激活吲哚胺-2,3双加氧酶(indoleamine 2,3-dioxygenase,IDO),改变色氨酸代谢通路,引起五羟色胺(5-hydroxytryptamin,5-HT)的减少和神经元的退行性改变,最终导致抑郁的发生[14,15]。包括氯胺酮在内的很多抗抑郁药物,可通过减少海马部位的促炎细胞因子的表达起到缓解焦虑、抑郁等不良情绪的作用[15]。本研究结果显示腹腔注射水杨酸钠14天后,大鼠海马组织中TNF-α、IL-1β表达水平显著高于对照组;停药恢复7天后,TNF-α表达水平与对照组相比无显著差异,说明腹腔注射水杨酸钠诱导大鼠产生耳鸣可以引起大鼠情绪相关脑区的神经炎性反应,这种炎性反应可能参与了耳鸣伴发的焦虑、抑郁等情绪障碍的发生,而不良情绪又可加重耳鸣的严重程度[11],进一步提示海马参与了耳鸣的发生发展;同时,停药恢复7天后IL-1β表达水平仍高于对照组,这可能是机体降低5-HT水平的一种稳态机制[16]。
NMDAR是中枢神经系统重要的兴奋性神经递质受体,是由GluN1、GluN2A-D、GluN3A/B等不同亚基构成的四聚体。含NMDAR2B亚基位点的NMDA离子通道对Ca2+具有高度通透性,细胞膜去极化时,激活状态下的NMDAR2B引起细胞外Ca2+大量内流,Ca2+与钙调蛋白形成的Ca/CaM复合物经信号转导进一步影响神经元的突触可塑性和生长发育等过程[17,18]。已有研究证实耳鸣的发病机制与NMDAR2B活动增强密切相关,Niu等[9]发现长期注射水杨酸钠可导致耳鸣大鼠海马区神经元生成减少,因此水杨酸钠可能过度激活NMDAR2B从而影响海马神经元的生长发育。另外,长期注射水杨酸钠可引起大鼠海马区促肾上腺皮质激素释放因子(corticotropin releasing factor,CRF)表达增加,其表达量具有时间依赖性,过多的CRF可通过持续激活HPA轴促进海马兴奋性神经递质的释放,进而引起突触后膜NMDAR增敏并影响海马功能[19],这也进一步证实水杨酸钠可能通过作用于NMDAR影响海马功能。大量研究发现异常表达的TNF-α、IL-1β可参与对NMDAR功能的调控,TNF-α、IL-1β可通过作用于NMDAR引起癫痫发作和脊髓损伤等疾病[7]。在神经元活动过程中,TNF-α 通过与TNFRⅡ结合可促进NMDAR依赖的Ca2+内流,NMDAR过度激活引起的神经元过度兴奋可导致神经元死亡[20]。海马神经元中,IL-1β可通过激活酪氨酸激酶和促进NMDAR2A/B亚基磷酸化从而增加NMDAR依赖的Ca2+内流,这种作用可引起神经元的退行性改变[21]。从本研究结果看,水杨酸钠诱导的耳鸣大鼠海马区TNF-α、IL-1β和NMDAR2B表达水平均升高,推测海马中的促炎细胞因子可能通过作用于NMDAR2B参与耳鸣的发生发展。
总之,水杨酸钠引起的耳鸣与海马区TNF-α、IL-1β和NMDAR2B表达升高密切相关,但在耳鸣的发生发展过程中,TNF-α、IL-1β作用于NMDAR2B的确切机制仍不明确,有待进一步研究。
