饮用水中消毒副产物卤代苯醌去除技术研究进展
2020-09-16王永强李桂芳孙韶华贾瑞宝
王永强,李 强,李桂芳,孙韶华,贾瑞宝,*,李 梅
(1. 山东建筑大学市政与环境工程学院,山东济南 250101;2.山东省城市供排水水质监测中心,山东济南 250100;3.济南水务集团有限公司,山东济南 250022;4. 成都基准方中建筑设计有限公司西安分公司,陕西西安 710054)
随着人们生产、生活水平的不断提高,工业及生活废水排放量也在不断增加,部分废水会直接排入河流中,最终污染饮用水源。为提高饮用水微生物安全性,水厂会投加氯、氯胺、二氧化氯和臭氧等消毒剂,但消毒剂可与水中有机物生成消毒副产物(disinfection byproducts,DBPs)[1],对人类健康造成较大影响。DBPs的形成与待处理水质特性、消毒剂种类和消毒工艺有着很大的关系[2]。卤代苯醌(halogenated benzoquinone,HBQ)已经被确定为一类新型DBPs,具有一定的细胞毒性,并可能具有致癌性以及氧化应激破坏DNA导致的遗传毒性[3-4]。因此,饮用水HBQ污染特性、生成机制和处理技术等已经成为当前的研究热点。
1 HBQ污染现状
Zhao等[5]使用电喷雾电离串联质谱技术对加拿大某地区自来水中HBQ的含量进行了多次检测,发现检出率较高的组分为2,6-二氯-1,4-苯醌(2,6-dichloro-1,4-benzoquinone,DCBQ)、2,6-二氯-3甲基-1,4-苯醌(2,6-dichloro-3-methyl-1,4-benzoquinone,DCMBQ)、2,3,6-三氯-1,4-苯醌(2,3,6-trichloro-1,4-benzoquinone,TCBQ)和2,6-二溴-1,4-苯醌(2,6-dibromo-1,4-benzoquinone,2,6-DBBQ),检出浓度分别为(165.1±9.1)、(1.3.1±9)、(9.1±0.2)、(0.5±0.6)ng/L。Qin等[6]对加拿大2个饮用水厂中DCBQ含量检测时发现,原水未检出HBQ前体物,经“氯+紫外线”照射消毒再加氯二次消毒后,2个水厂的出水均检测到DCBQ,浓度分别为5.3~14.4、14.3~54.6 ng/L。Zhao等[7]测定了饮用加氯后出水中8种HBQ的含量,发现在56份水样中,DCBQ的检出率为100%,浓度为4.5~274.5 ng/L,其中,11份水样中检测到了2,6-DBBQ,其浓度为0.5~37.9 ng/L;该研究同时发现,次氯酸钠处理后的饮用水中HBQ的浓度远高于其他消毒方式。另外,游泳等一些娱乐活动用水中HBQ的危害性同样不能忽视,与饮用水源相比,游泳池中的总有机碳(TOC)和氯含量相对较高,从而导致游泳池水中的DBPs浓度较高,化学成分也更为复杂,因此,对游泳池水中HBQ的检测和控制十分必要[4]。Wang等[8]对10个游泳池水中HBQ浓度进行了采样检测,在10个游泳池中均检测到了DCBQ,浓度为19~299 ng/L,约是进水浓度的100倍。以上研究成果均来自国外水体加氯消毒后HBQ的生成情况,国内学者Wu等[9]使用超高效液相色谱-串联质谱法检测了南宁市7个公共室内和室外游泳池水中的HBQ,发现DCBQ相比其他HBQ含量最高,浓度为4.56~45.3 ng/L,室内游泳池HBQ水平大于室外游泳池。目前,国内对HBQ浓度检测的研究较少,对水体氯化消毒后HBQ的污染特性、污染现状及生成潜力尚不明确。表1为几种HBQ在水厂与游泳池中的检测频率及浓度。
2 HBQ形成机制及特性
原水氯化后生成HBQ表明,给水厂的原水中存在HBQ前体物[11],具有相似芳香族结构的化合物一般都是DCBQ前体物[11]。例如,苯酚是公认的DCBQ前体物之一,单独氯消毒与臭氧-氯联用消毒时DCBQ生成的途径不同(图1)。DCBQ是2,4,6-三氯苯酚(2,4,6-trichlorophenol,2,4,6-TriCP)的一种中间产物[7],也是双酚A的氯化产物之一[12]。个人护理产品加氯后可能生成DCBQ。Wang等[10]使用含有个人护理产品(包括4种身体乳液和4种防晒剂)水样,加氯反应一段时间后,对水样中HBQ含量进行检测,发现在所有8个样品中均检测出DCBQ,且其浓度最高达到了5 420 ng /L,在一些样品中发现了其他几种HBQ(TCBQ、DCMBQ和2,3,5,6-四溴-1,4-苯醌)。HBQ也可以由原水中的天然有机物(natural organic matter,NOM)形成[11]。尽管水中不存在苯酚,但通过氯化含有对位取代的酚类物质和对位取代的芳族胺天然有机物也可以形成DCBQ,在对位取代的酚类化合物中,含有对位取代基的烷基和羧基化合物氯化后产生的HBQ浓度较高[13]。
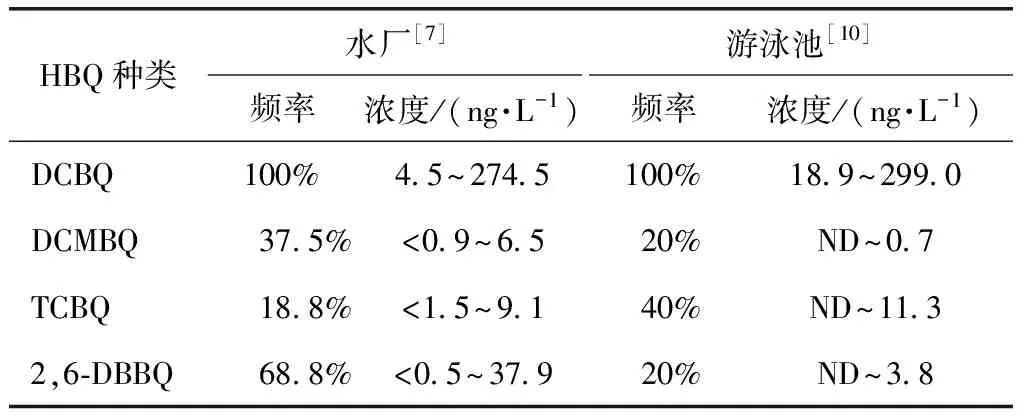
表1 加拿大水厂与游泳池HBQ检出情况Tab.1 Detection Frequencies and Concentrations of HBQ in Waterworks and Swimming Pools in Canada
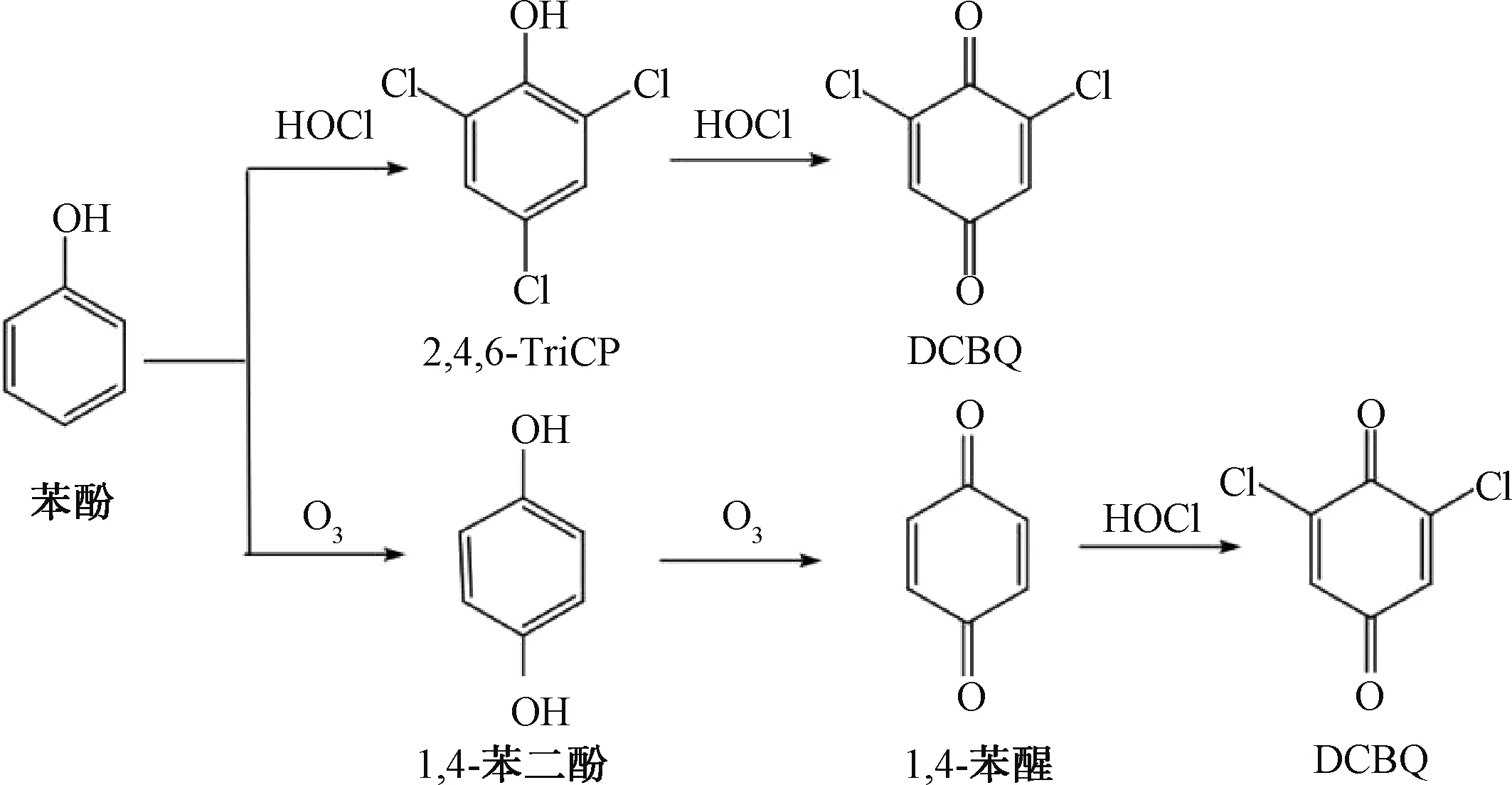
图1 单独氯消毒与臭氧-氯联用消毒DCBQ生成途径Fig.1 DCBQ Generation Pathway of Chlorine Disinfection and O3-Chlorine Disinfection
HBQ是由苯醌与苯环上的卤素以及烷基或羟基取代基组成。HBQ与苯醌有着相似的氧化还原和加成等特性[4],但是由于取代基不同,HBQ又有着独特的性质,如电子分布(极性性质)、平衡酸碱(pKa)以及氧化还原电势(E0)等特性。吸电子基团(如卤素基团)的存在会降低pKa并增加E0;给电子基团(如烷基)则相反[4]。同时,HBQ在中性或碱性条件下不稳定(当pH值=7时,半衰期为6~7 h),在酸性条件下相对稳定(当pH值=2.6~2.8时,可以稳定5 d)[6]。
饮用水中的消毒副产物会导致很多生物学不良效应(包括死产、自然流产、出生缺陷和低出生体重[14]),这引起了越来越多学者的关注。目前的毒理学数据表明,HBQ不仅具有高毒性,还可能具有致癌性。由于人类和线虫之间的遗传和生化途径高度同源,Zuo等[15]使用秀丽隐杆线虫对DCBQ的毒性进行了评估,结果发现,DCBQ诱导一般毒性能力比受控的DBPs(三卤甲烷和卤乙酸等)更强,且DCBQ有一定的体内遗传毒性。Li等[16]通过分析定量结构-毒性关系(QSTR),将HBQ鉴定为具有高毒性的DBPs。Wang等[17]通过研究也发现,HBQ对仓鼠卵巢细胞慢性细胞毒性明显高于受控的DBPs。HBQ的预测不良反应水平在2,3,5,6-四氯-1,4-苯醌的5 μg/kg到DCMBQ的79 μg/kg,比一些受控的DBPs低10 000倍[7, 18]。近期研究中,Hung等[19]比较了DCBQ及其衍生物的毒性,发现DCBQ的毒性更大,且由于DCBQ在培养基中半衰期较短(1 h),可能造成在一些毒性评估中低估了HBQ的毒性。由此可以推断,DCBQ在某些浓度或长时间暴露下可能会对人类健康造成潜在危害。表2为几种DBPs毒性的比较。

表2 DBPs毒性比较Tab.2 Comparison of Toxicities of DBPs
HBQ可以嵌入双链DNA(dsDNA),并通过H2O2的溶血分解在亲核点位附近产生·OH。因此,HBQ可以在非常短的时间内(小于5 min)诱导氧化性DNA损伤,且具有很大的遗传毒性和致癌性[22]。几种HBQ对小牛胸腺DNA(ct-DNA)序列氧化能力:TCBQ>四溴-1,4-苯醌(TBBQ)>2,5-二氯-1,4-苯醌> DCBQ[23]。虽然目前关于HBQ的检出以及其潜在毒性研究足以证明HBQ会对人类健康有一定的影响(如癌症风险),但全球HBQ引起的发病事件记录很少,HBQ对人体的体内毒性和遗传毒性影响更是知之甚少。因此,有必要开展相关研究,充分了解与HBQ暴露相关的潜在健康风险,进一步确定饮用水中HBQ的最大限值,最终确保人类的饮水安全。
3 HBQ去除技术
由于经饮用水厂消毒后HBQ普遍存在且毒性较强,HBQ的控制技术亦逐渐成为国内外学者研究的热点。目前,HBQ去除技术主要集中在以下几种方法。
3.1 臭氧/活性炭联用法
臭氧(O3)单独使用或与活性炭(granular activated carbon,GAC)结合可以用来处理水中的污染物。O3可与富含电子的化合物反应,破坏有机化合物并产生·OH,可与GAC反应(催化羧基过程)产生更多的活性氧物质,延长GAC使用寿命,促进·OH氧化和矿化污染物[24],O3与GAC联用还有生物降解作用。Qian等[25]在对经生物预处理后纺织废水的研究时发现,O3/GAC具有明显的协同作用,当O3与COD比值为0.6、GAC浓度为10 g/L时,测得的DOC去除率约为单独O3、GAC吸附总和的1.6倍。O3/GAC与单独O3达到相同去除效果时所需的O3剂量更低。丁春生等[26]对比研究了单独GAC、O3以及O3/GAC联合工艺对DCBQ的去除,研究发现:当GAC投加量为0.5 g/L、O3投加浓度为10.06 mg/L、DCBQ浓度为20 μg/L、反应时间为90 min的条件下,单独采用GAC、O3和O3/GAC联合工艺对DCBQ的去除率分别为29.64%、32.81%和 84.93%。O3/GAC联合工艺去除率明显高于单独采用GAC、O3工艺,这是因为O3可以将吸附在GAC上的DCBQ分解为小分子物质,同时释放出GAC的吸附空间,促进GAC对DCBQ的吸附,从而进一步提高去除效率。
3.2 高铁酸钾法
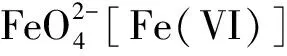
3.3 紫外线辐射法
紫外线(UV)辐射已成为一种有效的消毒技术。UV辐射法不添加化学药剂就可以去除一些使用氯消除不了的微生物。研究发现,DCMBQ、 DBBQ、DCBQ和TCBQ在254 nm波长下摩尔吸光系数为6 882、2 828、4 258、4 449 L/(mol·cm)[31]。这为紫外线辐射法去除水中HBQ提供了一定的理论基础。
HBQ部分分子经过UV照射、吸收了光子能量后,电子从低能量的基态跃迁到高能量的激发态[2],激发态的HBQ会优先与水发生反应,形成HBQ-H2O络合物。这种络合物随后在UV照射下被转化成卤代苯三醇,可能会与基态HBQ进一步反应形成羟基化HBQ(OH-HBQ),最后在连续UV照射下,通过氧化还原反应,OH-HBQ可能通过取代反应失去氯或溴,最终在溶液中形成脱氯/脱溴的OH-HBQ[31]。研究表明[32],即使DCBQ完全光降解,处理后水样的细胞毒性基本保持不变,这说明UV辐射法并不能使DCBQ完全矿化,其光降解产物与HBQ有着相似的细胞毒性。
UV光强对HBQ的去除有明显的影响。李乃军[2]使用UV辐射法探讨了UV光强、pH、初始浓度对TCBQ去除的影响,结果表明:当TCBQ初始浓度为50 μg/L、UV光强度分别为64、110、180 μW/cm2、反应240 min后,TCBQ去除率分别为52.61%、60.56%、73.15%(UV光强度越大,所产生的光子就越多,与TCBQ的反应速率越大);pH值由5到9时,TCBQ去除率由71.26%降低到55.47%(TCBQ在酸性条件下发生质子化,具有更高的光活性,导致更高的去除率);TCBQ 初始浓度由20 μg/L增加到80 μg/L、经240 min反应后,TCBQ去除率由52.15%增加到66.23%(随着浓度的增大,其对光源的利用率增加,去除率增加)。
Qian等[31]使用UV对超纯水、自来水中4种HBQ(DCBQ、DCMBQ、TCBQ、DBBQ)进行去除研究, 4种HBQ浓度均为0.25 nmol/L。超纯水中,在200 mJ/cm2光强的UV254照射下,4种HBQ的去除率均超过90%。其中,DCMBQ最易被UV254降解,在UV254为100 mJ/cm2光强下,去除率达到了95%。随着UV的强度变大,HBQ的去除率也会变大。当UV强度达到 1 000 mJ/cm2时,HBQ可以全部被去除。自来水中有着相似的去除率,在50 mJ/cm2光强的UV254照射下,4种HBQ的去除率均超过80%。
3.4 加热光照联用法
上述已经表明,UV照射对HBQ的去除有一定的作用,且Zhu等[33]报道了在室温下,OH-取代TCBQ中的氯原子可使TCBQ毒性降低,根据Arrhenius方程,通过提高反应温度可以加快反应速度。因此,同时施加光照射和高温,可使DCBQ的降解率大大提高。Pei等[34]发现,当质谱仪电离源温度升高时,DCBQ可能发生降解,在0.004 m3的黑暗空间内、DCBQ初始浓度为4 mg/L条件下,用16 W便携式UV灯、室内灯照射、水浴加热100 ℃分别进行研究。结果发现,反应17 min后,在UV254、室内光照射、水浴加热条件下,DCBQ的去除率分别为98%、28%和73%;在加热和室内光照射组合条件下,1 min内DCBQ的去除率超过99%。DCBQ降解遵循一级动力学,各种条件下的降解速率:室内光照射水浴加热(DCBQ降解速率常数k=4.597 min-1)>UV254照射(k=0.222 min-1)>水浴加热(k=0.076 min-1)>室内光照射(k=0.020 min-1)。
3.5 溶解氨基酸法
溶解氨基酸(amino acids,AAs)[3]是地表水中溶解有机氮的主要存在形式,其浓度为20~10 000 μg/L。AAs和HBQ可能共同存在于游泳池水、天然水和人体(AAs是人体肌肉或其他组织的重要组成部分)中。由于HBQ是缺电子结构,AAs富含电子,研究表明,醌可与氮亲核试剂(如4-氯苯胺或磺酰胺)发生共价结合反应,从而将醌去除[35],且AAs与人体中的谷胱甘肽有相同的作用。因此,AAs可以降低水中HBQ的含量和毒性[36]。AAs与HBQ反应过程中,HBQ首先进行羟基化,然后HBQ和OH-HBQ与AAs发生加成/取代反应,最后进一步氧化脱羧成AA-HBQ,使HBQ的毒性减弱。
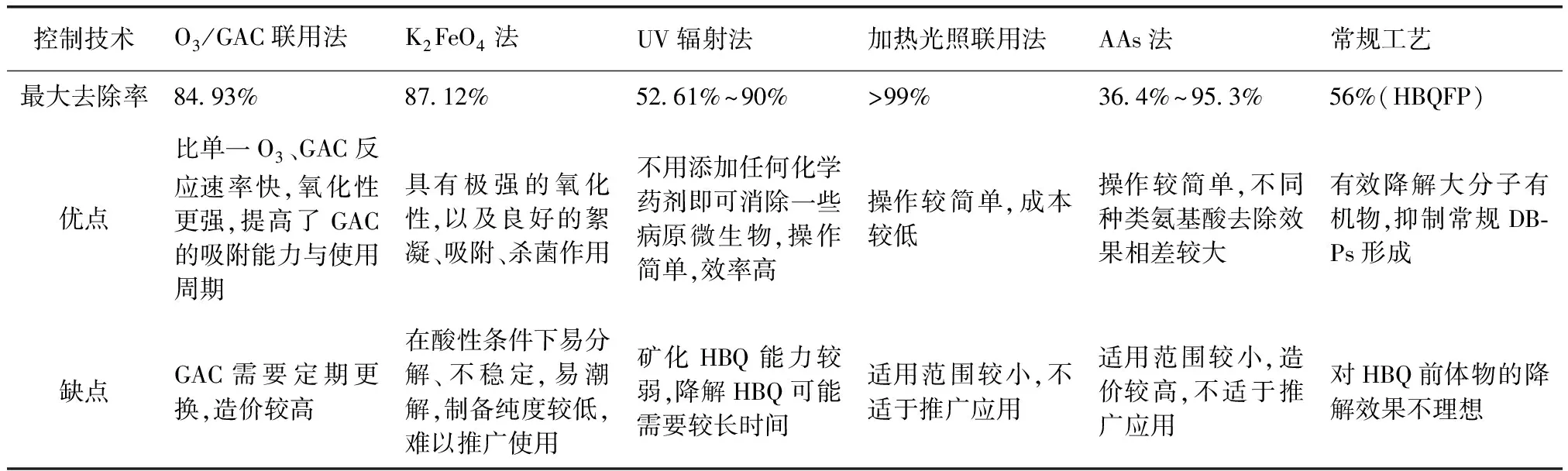
Du等[3]探究了几种AAs对HBQ的去除研究,结果表明,当AAs[组氨酸(histidine,His)、半胱氨酸(cysteine,Cys)、苏氨酸(threonine,Thr)和苯丙氨酸(phenylalanine,Phe)]浓度为30 μmol/L、HBQ[2-氯-1,4-苯醌(2-chlorobenzoquinone,CBQ)、DCBQ、TCBQ]浓度为10 μmol/L、pH值为7.0±0.2时,各AAs对HBQ的去除率在36.4%~95.3%,3种HBQ的去除率大小顺序为CBQ 在水处理过程中,控制DBPs前体物含量也可以有效限制DBPs形成。Wang等[11]的研究发现,混凝对DOC、DCBQ、DCMBQ、TCBQ、DBBQ前体物的去除率分别为56%、4.7%~39%、7.7%~19%、0.9%~24%、18%~45%。HBQ前体物可能主要为小分子有机物,因此,混凝对HBQ前体物的去除效果并不理想。GAC工艺使HBQ生成势(HBQFP)水平降低10%~20%,DOC的去除率仅为0.2%~4.7%,GAC工艺对HBQ前体物的控制可能主要是生物降解而不是吸附去除。O3工艺使HBQFP降低10%~30%,而砂滤和UV辐射对HBQ前体物并没有影响。 对于HBQ本身的去除研究较少,主要集中在上述介绍的几种方法,即O3/GAC联用法、K2FeO4法、加热光照联用法、AAs法,其对HBQ去的除效果较好,但又各有不足。GAC重复使用一段时间后,去除效果会降低,影响效率;其他方法适用范围较小,不便推广。UV辐射法虽然操作简单,去除率较好,但即使HBQ被光降解,处理后水样的细胞毒性仍较大,这说明UV辐射法并不能使HBQ完全矿化,UV辐射法并不理想。常规工艺(混凝、GAC、O3)可以降解部分HBQ前体,但是对HBQ前体的控制效果不佳。表3为不同控制技术的特点。 表3 不同控制技术特点Tab.3 Features of Different Control Technology HBQ是一类新型的DBPs,毒性比常规DBPs要大得多,检出频率很高。在饮用水、游泳池中,HBQ的浓度最高分别可达274.5、299 ng/L。HBQ的预测不良反应水平最低仅有5 μg/kg。如果不加以治理,势必危害人类健康安全。几种对HBQ本身的控制技术虽然有所研究,但是效果并不理想,不适于深入推广,因此,关于HBQ需要做更多相关研究。 (1)国内饮用水、管网等中HBQ含量尚不明确,有必要对国内饮用水从水源到水厂到管网开展全面深入的HBQ污染现状调研,明确其污染特性。 (2)开展HBQ暴露相关潜在健康风险评价,确定HBQ在饮用水中的最大限值。 (3)HBQ形成研究及生成控制仍不够细化,需明确HBQ的形成机制,探究适合不同水质的科学有效的HBQ生成控制技术体系,如采用混凝等技术对其前体物进行控制以减少HBQ的生成。 (4)HBQ去除技术的研究较少且不细致、不系统,而高级氧化方法具有处理效率高、氧化性强、操作简单、适合大规模推广应用等优点,可深入系统地开展高级氧化技术对HBQ自身及前体的相关研究。3.6 常规工艺
4 结论与展望
