电针对AD大鼠学习记忆能力及杏仁核SIRT1/FOXO3a表达的影响*
2020-09-16许志鹏
许志鹏,叶 伟,光 磊,王 智,丁 见 , 王 林
(1.皖南医学院临床医学院2016级,安徽 芜湖 241002;2.基础医学院)
阿尔茨海默病(Alzheimer’s disease,AD)又称老年性痴呆,是一种缓慢进行的中枢神经退行性疾病,其特征是认知能力及行动能力的退化越来越严重,逐渐丧失生活能力[1]。通过将STZ注入侧脑室可引发大鼠皮质与海马的葡萄糖代谢减慢,导致突触丢失、神经元损伤,使Aβ异常增加,形成AD实验模型[2]。SIRT1是哺乳动物体内的Sirtuins家族成员之一,它能够参与抗氧化应激、抗感染和抗凋亡等过程,当神经系统发生退行性病变时,SIRT1通过上调表达量,从而发挥神经保护作用。FOXO3a是FOX (forkhead box) 蛋白家族的一个重要成员,通过磷酸化、泛素化降解、乙酰化或去乙酰化及microRNA方式在抑制细胞周期进程、促进凋亡及氧化应激和延长寿命中发挥重要作用[3]。杏仁核 ( amygdale) 是大脑边缘系统的重要组成部分,其具有处理情感反应和记忆等功能。在阿尔茨海默症的疾病治疗中,针灸干预AD的作用机制主要体现在减少Aβ沉积、抑制Tau蛋白过度磷酸化、抑制神经细胞凋亡、增强中枢神经传递、改善能量代谢、调节氧化应激以及调控炎性反应等方面[4]。而电针是电刺激结合针灸,能够减少脑内 Aβ1-42的异常沉积、改善AD大鼠的认知功能障碍从而达到治疗AD的目的。所以本实验通过研究电针对AD大鼠杏仁核SIRT1和FOXO3a表达的影响,探讨电针对AD大鼠学习记忆能力改善的可能机制。
1 材料与方法
1.1动物分组 成年雄性SD健康大鼠36只,体重(200 ± 20)g,购自浙江省实验动物中心,生产许可号SCXK(浙)2014-0001。放在室温21~25 ℃,相对湿度60 %~65 %的环境中适应性喂养一周,自由采光与饮水。随机分为对照组、模型组和电针组,每组12只(6只用于免疫组化实验,6只用于Western Blot实验)。实验过程中对动物的操作和处理严格遵守2006年国家科技部发布的《关于善待实验动物的指导性意见》的规定。
1.2主要试剂与仪器 链脲佐菌素(STZ-S0130)购自Sigma公司;通透液(P0097-100ml)购自碧云天生物技术有限公司;SIRT1(bs-2257R)抗体购自北京博奥森生物技术有限公司;FOXO3a(bs-1548R)抗体购自北京博奥森生物技术有限公司;β-actin购自碧云天生物技术有限公司;兔IgG-免疫组化试剂盒(SABC浓缩型)(SA2002 1/4KIT)购自博士德生物工程有限公司;Nissl staining溶液购自北京索莱宝科技有限公司;轮转式石蜡切片机购自德国Leica公司,华佗牌电子针疗仪购自苏州医疗用品厂有限公司,BX51显微镜和Express C图像分析系统购自日本的OLYMPUS,还有低温超速离心机、制冰机、电热恒温箱、超声波细胞粉碎机、高压蒸汽灭菌箱等。
1.3模型制备 动物术前采用30 mg/kg戊巴比妥钠腹腔注射进行麻醉,麻醉剂量为300 mg/kg。待麻醉药起效后,将大鼠固定在立体定位仪上(耳杆不要插入过深);固定后,在头部进行备皮和消毒,沿矢状线做一切口(约1.5 cm)。参考《大鼠脑立体定向图谱》,在各组大鼠中线旁1.4 mm,前囟后0.8~0.9 mm处钻孔,深度3.6 mm,用微量进样器注射10 %链脲佐菌素(人工脑脊液为溶媒)约3 μL/100 g进入每侧侧脑室,第3 d重复注射此剂量。对照组注射等量人工脑脊液代替10 % STZ。每次注入5 min,留针3 min。使用无菌骨蜡封闭钻孔,缝合消毒。术后肌注青霉素,连用3 d。
1.4治疗方法 对照组和模型组不给予任何治疗手段。对电针组大鼠用30 mg/kg戊巴比妥钠腹腔注射进行麻醉,麻醉成功后将大鼠侧卧位放置,对“大椎”穴和“足三里”穴,用频率2 HZ、强度3 V、波宽1 ms的连续波连续电针治疗4周,1次/d,30 min/次。
1.5水迷宫检测 定位航行时间:历时5天,将平台放在第4象限,离水面约1~2 cm,平台距离池壁约30 cm,第1天将每组大鼠引至平台适应10 s,以第2象限为入水点,在水池中自由游泳120 s。之后的第2 d至第5 d将各组大鼠分别从4个象限的相同投放点面壁放入水中,用录像系统记录大鼠找到平台的时间(在平台滞留时间超过5s定为找到平台),即逃避潜伏期。以120 s为限,若未找到,则将大鼠引至平台学习10~15 s,将其擦干,放回笼中,记录该鼠的逃避潜伏期为120 s。每天训练4次,4次训练的逃避潜伏期的平均值作为大鼠当日的学习成绩。空间探索实验:第6 d将平台撤去,将大鼠按照相同方法从4个象限放入水中,记录大鼠120 s内在平台象限的滞留时间和穿越原平台的次数。
1.6标本取材 治疗结束后,各组大鼠采用30 mg/kg戊巴比妥钠腹腔注射麻醉,暴露心脏,用4 ℃ 4 %多聚甲醛磷酸缓冲液经左心室升主动脉灌注固定后,根据George Paxinos的《大鼠脑定位立体图谱》取出脑组织,放入4 %多聚甲醛溶液固定24 h,常规石蜡包埋。
1.7免疫组化检测 取各组大鼠脑组织石蜡切块进行切片,片厚5 μm。按免疫组化试剂盒说明书依次各步骤,封片,镜下观察。结合显微镜、大鼠脑立体定位图谱、图像分析系统对杏仁核部的SIRT1和FOXO3a的免疫阳性细胞进行拍照、计数和测灰度值,并统计阳性细胞数量和平均灰度值。
1.8Western blot实验 制胶(10 %分离胶,5 %浓缩胶),加样(每一组的样本连续加三次),电泳,转膜(电泳和转膜采用冰水浴);封闭:5 %脱脂牛奶,放在摇床上,室温下2 h。TBST洗10 min,洗3次;放在一抗(用一抗稀释液稀释一抗,SIRT1稀释比例1∶1 000,FOXO3a稀释比例1∶1 000)中孵育,4 ℃过夜(>12h);TBST洗10 min,洗3次;放在二抗(用5%脱脂牛奶稀释二抗,稀释比例1∶5 000)中,室温下放在摇床上2 h;TBST洗10 min,洗3次;曝光。测定各组大鼠杏仁核中β-actin、SIRT1和FOXO3a蛋白的光密度值,得到其相对表达量。
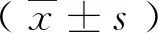
2 结果
2.1各组大鼠Morris水迷宫学习记忆能力的比较 模型组大鼠4d平均逃避潜伏期高于对照组(P<0.05);平台象限滞留时间百分比低于对照组(P<0.05);电针组大鼠的4d平均逃避潜伏期低于模型组(P<0.05),平台象限滞留时间百分比高于模型组(P<0.05)。见图1。
2.2各组杏仁核中SIRT1和FOXO3a表达的比较 在光学显微镜下可见切片上大鼠杏仁核有胞膜和胞浆呈棕黄色的SIRT1阳性神经元和FOXO3a阳性神经元。模型组SIRT1阳性神经元数量相比对照组显著减少(P<0.05),而染色明显变浅,平均灰度值显著增加(P<0.05);电针组的SIRT1阳性神经元数量相比模型组显著增加(P<0.05),染色明显加深,平均灰度值显著降低(P<0.05)。模型组FOXO3a阳性神经元数量相比对照组显著增加(P<0.05),而染色明显加深,平均灰度值显著降低(P<0.05);电针组的FOXO3a阳性神经元数量相比于模型组显著减少(P<0.05),而染色明显变浅,平均灰度值显著增加(P<0.05)。见图2。
2.3各组杏仁核中SIRT1和FOXO3a蛋白行对表达量的比较 模型组中的SIRT1蛋白的表达较对照组显著降低(P<0.05),电针组中SIRT1蛋白的表达较模型组显著升高(P<0.05);模型组中的FOXO3a蛋白的表达较对照组显著升高(P<0.05),电针组中的FOXO3a蛋白的表达较模型组显著降低(P<0.05)。见图3。
3 讨论
阿尔茨海默症(Alzheimer’s disease,AD)俗称老年痴呆症,是一种进行性神经退行疾病,会导致人的认知记忆功能障碍。其主要病变为:Aβ异常聚集和老年斑的沉积形成;杏仁核、海马、颞叶等部位神经元丢失;神经纤维缠结(neurofibrillary tangles,NFTs)和颗粒空泡变性(granulovacuolar degeneration,GD)等。Horínek等研究发现在AD早期,杏仁核与海马有着同样的诊断价值,并且都在短期记忆过程中发挥重要作用;当AD出现轻微的精神症状时,杏仁核普遍发生了早期的损害。Hampel等研究表明杏仁核不仅是AD脑内重要的病变部位之一,而且其Aβ异常沉积发生的时间可能比海马、皮质等区域更早。所以我们选用杏仁核区域作为本实验的研究部位。Morris水迷宫系统检测到各组AD大鼠的平均逃避潜伏期明显高于对照组,各组AD大鼠的平台象限滞留时间百分比明显低于对照组。据此推断实验造模成功,可用于接下来的治疗研究。
阿尔茨海默症的病因、发病机理至今不明,其病因假说中包括基因学说,碱能学说,钙代谢紊乱学说,铝中毒学说,自由基损伤学说等。AD的发病机制非常复杂,其中涉及的因素包括携带易感基因、淀粉样蛋白在脑内的沉积、炎症和氧化应激、突触受损等[5]。沉默信息调节因子1(silence information regulator 1,SIRT1)是哺乳动物体内的Sirtuins家族成员之一。最新研究显示,上调SIRT1表达水平及活性可起到一定的神经保护作用,对AD有着重要的影响[6]。转录因子FOXO3a是Forkhead家族的一个重要成员,参与细胞的凋亡及抗氧化应激,并具有延长寿命的作用[3]。SIRT1-FoxO3a通路发挥抗氧化应激反应的作用已被证实,SIRT1通过去乙酰化降解FOXO3a,降低FOXO3a蛋白水平,抑制FOXO3a诱导细胞死亡,增强细胞抗氧化应激及炎症反应能力,发挥细胞抗氧化应激及炎性反应作用[7]。本实验中,免疫组化的结果显示,模型组FOXO3a阳性神经元数量相比对照组显著增加(P<0.05),而染色明显加深,平均灰度值显著降低(P<0.05);模型组SIRT1阳性神经元数量相比对照组显著减少(P<0.05),而染色明显变浅,平均灰度值显著增加(P<0.05)。Western Blot的结果显示,模型组中的FOXO3a蛋白的表达较对照组显著升高(P<0.05),模型组中的SIRT1蛋白的表达较对照组显著降低(P<0.05)。FOXO3a与SIRT1在模型组和对照组中的表达趋势相反,这与SIRT1通过去乙酰化降解FOXO3a,降低FOXO3a蛋白水平这个观点相一致。
电针疗法是指毫针刺入腧穴得气后,在针具上通以接近人体生物电的微量脉冲电流,利用针和电的两种刺激,激发并调整经络之气以防治疾病的一种方法。大椎穴是督脉经的主要穴位,督脉入络于脑,具有“通督调神,健脑益髓”的作用[8]。通过电针刺激“足三里”穴可能通过下调AD小鼠大脑皮层APP及Aβ蛋白的表达水平,从而抑制老年斑的形成,达到保护神经细胞的作用,延缓AD进程。电针治疗缓解AD症状的途径之一是干预Aβ的生成途径,即调控β分泌酶的表达,抑制淀粉样前体蛋白APP的异常水解[9]。研究表明电针可通过上调AD大鼠额叶皮质SIRT1的表达,增强脑组织抗氧化应激能力,从而达到对AD大鼠的脑保护作用[10]。本实验中,免疫组化结果显示,电针组的SIRT1阳性神经元数量相比模型组显著增加(P<0.05),染色明显加深,平均灰度值显著降低(P<0.05);电针组的FOXO3a阳性神经元数量相比于模型组显著减少(P<0.05),而染色明显变浅,平均灰度值显著增加(P<0.05)。Western Blot实验结果显示,电针组中SIRT1蛋白的表达较模型组显著升高(P<0.05),电针组中的FOXO3a蛋白的表达较模型组显著降低(P<0.05)。这些结果反映出电针可以增加大鼠大脑中SIRT1的表达水平,降低了大鼠大脑中FOXO3a的表达水平,提示电针可能通过增强脑组织的抗氧化应激能力,促进神经纤维的良性再生,发挥对神经元的损伤修复作用。可以看出电针通过上调SIRT1,下调FOXO3a,对AD大鼠的学习记忆有着改善作用,但其具体的机制有待进一步的研究。
