APN-AMPK信号通路调节骨代谢作用于激素性股骨头坏死的机制研究
2020-09-15张翔吴泱董晓俊张鸿振王萧枫梅凌张涛
张翔 吴泱 董晓俊 张鸿振 王萧枫 梅凌 张涛

[摘要] 目的 通過观察激素性骨坏死模型造模前后骨代谢变化,阐述干预APN-AMPK信号通路调节骨坏死的作用机制。 方法 共20只健康成年白兔,随机分为正常组和造模组,每组10只,应用LPS联合醋酸泼尼松龙诱导激素性股骨头坏死模型,疗程为9周。实验过程中记录动物一般情况,造模前后分别对所有兔耳缘静脉取血2 mL,进行ELISA检测;通过病理组织学检查确定造模成功,同时分别进行骨细胞AMPK mRNA表达、TNF-α/OPG相关性分析。 结果 造模后,造模组兔血浆APN水平(2.49±0.48)ng/mL,较同组造模前(6.74±0.04)ng/mL比较明显降低,差异有统计学意义(P<0.05);造模组兔骨细胞AMPK mRNA表达为(0.364±0.017),较造模前显著降低,差异有统计学意义(P<0.05)。此外,血清APN含量和AMPK mRNA表达与OPG含量呈正相关性,与TNF-α表达呈负相关性。 结论 脂联素体内含量可直接引起骨坏死疾病进程,也许APN-AMPK信号通路在疾病转归过程中承担重要角色,通过干预APN-AMPK信号通路正向传导,可以为临床治疗激素性股骨头坏死提供新的思路和方法。
[关键词] 激素性股骨头坏死;APN-AMPK信号通路;动物模型;机制研究
[中图分类号] R580 [文献标识码] A [文章编号] 1673-9701(2020)21-0035-05
Study on mechanism of APN-AMPK signal pathway regulating bone metabolism in steroid-induced femoral head necrosis
ZHANG Xiang1 WU Yang2 DONG Xiaojun3 ZHANG Hongzhen1 WANG Xiaofeng1 MEI Ling3 ZHANG Tao4
1.Department of TCM Orthopedics,Wenzhou Hospital of Integrated Traditional Chinese and Western Medicine in Zhejiang Province, Wenzhou 325000, China; 2.Internal Medicine of TCM,Wenzhou Hospital of Integrated Traditional Chinese and Western Medicine in Zhejiang Province, Wenzhou 325000, China; 3.Department of Orthopedics, Wuhan Hospital of Traditional Chinese Medicine, Wuhan 430014, China; 4. Hubei University of Traditional Chinese Medicine, Wuhan 430014, China
[Abstract] Objective To expound the mechanism of regulating osteonecrosis by intervening APN-AMPK signal pathway through observing the changes of bone metabolism before and after the modeling of steroid-induced femoral head necrosis. Methods A total of 20 healthy adult rabbits were randomly divided into the normal group and the model group,with 10 rabbits in each group. LPS and prednisolone acetate were used to induce the steroid-induced femoral head necrosis. The course lasted for 9 weeks. During the experiment,the general conditions of the animals were recorded. Two ml of blood was taken from the ear veins of all rabbits before and after the modeling,and ELISA was performed. Histopathological examination was conducted to determine the success of the modeling. In the meantime, how the AMPK mRNA expression in the bone cells was correlated with the level of TNF-α and the level of OPG was also analyzed respectively. Results The plasma APN level of rabbits in the model group after modeling (2.49±0.48)ng/mL was significantly lower than that before modeling(6.74±0.04) ng/mL, the difference was statistically significant(P<0.05). The AMPK mRNA expression in the rabbit bone cells in the model group after modeling(0.364±0.017)was significantly lower than that before modeling, the difference was statistically significant(P<0.05). In addition,the serum APN content and AMPK mRNA expression were positively correlated with OPG content and negatively correlated with TNF-α expression. Conclusion The content level of adiponectin can directly trigger the progression of osteonecrosis. Perhaps the APN-AMPK signal pathway plays an important role in the process of disease progression. By intervening in the positive conduction of the APN-AMPK signal pathway, new ideas and methods can be generated for the clinical treatment of steroid-induced femoral head necrosis.
[Key words] Steroid-induced femoral head necrosis; APN-AMPK signal pathway; Animal model; Study on mechanism
股骨头缺血性坏死(Avascular necrosis of femoral head,ANFH)是一种累及骨的渐进破坏,最终导致软骨下骨塌陷和髋关节损伤的疾病。这种疾病是一个日益严重的全球健康问题,美国每年确诊ANFH患者2~3万例[1],而中国15岁以上ANFH患者有812万[2-3]。激素性股骨头坏死(SANFH)是ANFH中较为常见的一种类型,诱因源自于大量使用糖皮质激素,国内外研究显示SANFH发病率已占该病种首位[4-5],研究SANFH治疗转归一直是国内外学者的焦点。AMPK被认为是体内的一类能量传感器,可维持体内稳态[6],在机体中通过AMPK信号通路可干预细胞能量代谢,调节糖脂代谢,促进能量代谢趋于平衡。通过改善体内脂联素(Adiponectin,APN)血浆浓度,促进AMPK信号通路正向传导,加强脂质代谢,从而对血管内皮起到保护和改善细胞凋亡作用[7-8]。因此,干预APN-AMPK信号通路在调控激素性股骨头坏死转归过程中具有正向作用。
1 材料与方法
1.1 实验动物
成年新西兰大耳白兔20只,每只体重(2.5±0.2)kg,雌雄各半,所有动物实验均经武汉市中医医院医学伦理委员会批准进行[9],并由药学实验基地提供[动物许可证号:SKXK(鄂)2010-0056]。
1.2 实验试剂
主要包括:TRIZOL 试剂盒(Invitrogen Company);荧光定量PCR试剂盒(Bio-Rad 公司,批号1725201);反转录试剂盒(Takara 公司);兔肿瘤坏死因子免疫组化试剂盒(北京中杉金桥生物技术有限公司);兔脂联素(ADP)ELISA 試剂盒(上海亚培生物科技有限公司);此外,40%甲醛溶液、10%水合氯醛溶液/中性树脂封固剂等辅助试剂等均由武汉市中医医院药学实验研究基地提供。
1.3 方法
1.3.1 造模方法 于2014年11月~2018年6月在武汉市中医医院药学实验研究基地国家中医药管理局三级实验室完成,由作者与导师董晓俊教授团队一同组织完成,采用内毒素联合糖皮质激素法造模[10]。
1.3.2 分组方法 动物实验室采用恒温系统,定时喂养1周,然后随机分为正常组和造模组,每组10只。造模组采用内毒素联合激素造模方法:造模开始第1天首先采用耳缘静脉注射LPS(10 μg/kg,美国Sigma公司,批号111M4035V),24 h后重复给药;第2次注射LPS立即醋酸氢化泼尼松龙8 mg/kg(浙江仙琚制药股份有限公司,125 mg/支,批号H33020824)臀肌注射,注射3周,停药3周,继续用药3周。正常组与造模组在相同实验时间点注射等量生理盐水。两组动物均单笼标准化饲养,第9周末在正常组和造模组随机抽取2只兔拍股骨头正位片,观察股骨头囊性变区域和防止股骨头塌陷。研究期间,所有动物采用青霉素钠8.0×105 U/kg肌注(哈药集团制药总厂,80万U/支,批号A080700411),每周2次。
1.3.3 取材和组织学切片 血液样本:造模前后经耳缘静脉对所有兔取血,离心取上层血清液保存。所有兔在实验第9周末处死,处死后迅速解剖出兔左侧股骨,利用锯条将兔股骨干分成数块,每块长约1.5 mm,剔除骨外膜,用PBS将髓腔冲洗干净,再用锡纸包裹骨组织。先将骨组织置于-75℃冰箱中12 h,再投入液氮中保存。将右侧股骨头沿冠状面切开,固定,脱钙,石蜡包埋,连续切片,厚度4 μm,进行HE染色在光镜下观察组织形态。
1.4 观察指标
1.4.1 病理组织学检查 光镜下观察组织学切片,观察骨小梁镜下变化,并进行相关计数,同时对单位体积内空骨陷窝率进行测算。
1.4.2 兔脂联素(APN)ELISA指标 造模前后分别对所有兔进行耳缘静脉采血2 mL,然后立即离心取上层血清液保存。实验结束后按照ELISA试剂盒(上海亚培生物科技有限公司)说明书进行酶联免疫吸附法(ELISA)检测:收集兔耳缘静脉取2 mL,血清:1000×g离心10 min将血清和红细胞迅速小心分离。血浆:1000×g离心30 min去除颗粒。细胞上清液:1000×g离心10 min去除颗粒和聚合物。使用前,将所有试剂充分混匀。不要使液体产生大量的泡沫,以免加样时加入大量的气泡,产生加样上的误差。加入稀释好后的标准品50 μL于反应孔,加入待测样品50 μL于反应孔内。立即加入50 μL的生物素标记的抗体,盖上膜板,轻轻振荡混匀,37℃温育1 h。甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作3次。如果用洗板机洗涤,洗涤次数增加一次。每孔加入80 μL的亲和链酶素-HRP,轻轻振荡混匀,37℃温育30 min。甩去孔内液体,每孔加满洗涤液,振荡30 s,甩去洗涤液,用吸水纸拍干。重复此操作3次。如果用洗板机洗涤,洗涤次数增加一次。每孔加入底物A、B各50 μL,轻轻振荡混匀,37℃温育10 min,避免光照,取出酶标板,迅速加入50 μL终止液,加入终止液后应立即测定结果。在450 nm波长处测定各孔的OD值。
1.4.3 股骨头局部TNF-α/OPG免疫组化检测 将样本、试剂和标准品加入37℃反应30 min,随后洗板5次;加入酶标实际,37℃反应30 min;再次洗板5次,加入显色液,37℃显色10 min,最后加入终止液,15 min之内读取OD 值,进一步计算。
1.4.4 兔股骨头骨细胞中AMPK mRNA表达 将取材的兔股骨头组织取出,向兔股骨头组织中加入1 mL TRIZOL裂解液裂解细胞,按照invitrogen TRIZOL说明书进行RNA提取:向兔股骨头组织中加入1 mL TRIZOL裂解液裂解细胞,用移液枪反复轻柔吹打使细胞裂解。转移细胞至1.5 mL EP管中加入氯仿0.2 mL,充分混匀,室温孵育2 min,4℃低温离心机 12 000 r/min离心10 min。弃去上清液后加入75%的乙醇1 mL,清洗沉淀,12 000 r/min下离心2 min。去除乙醇溶液,室温下干燥沉淀物 5~10 min,加入去离子水,溶解沉淀。取3 μL细胞总RNA采用1%琼脂糖凝胶电泳检测RNA,然后用紫外凝胶成像系统观察,判定RNA完整性。取逆转录试剂盒试剂,测量各RNA浓度,取普通八连管,加入体系:(1)5×primescript RT Enzyme MIX 2 μL/4 μL;(2)Total RNA 500 ng/1 μg(按体系计算体积);(3)RNase Free ddH2O up to 10 μL/up to 20 μL于普通PCR仪上进行逆转录(37℃ 15 min,85℃ 15 s,4℃ forever)。根据NCBI公布的AMPK基因序列分别设计AMPK-R作为q-PCR引物,内部参照(内参)基因为肌动蛋白(Actin),引物为ActR,引物序列见表1。
1.5 统计学分析
采用SPSS19.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示,采用t检验;两变量相关性以Pearson相关系数r表示。P<0.05为差异有统计学意义。
2 结果
2.1 两组动物一般观察比较
造模第2天造模组兔即出现神志萎靡症状,第4周均出现食欲不振,体重明显减轻,步态异常,活动明显减少,可见脱毛现象;至第9周末大部分兔子出现站立困难,跛行。正常组动物未出现明显异常,两组兔均无脱失。
2.2 两组动物血浆APN水平比较
造模前分别对两组兔血浆APN水平进行检测,造模前两组血浆APN水平比较差异无统计学意义(P>0.05);造模后,正常组兔血浆APN水平(6.41±0.36)ng/mL,较同组造模前差异无统计学意义(P>0.05);造模组兔血浆APN水平(2.49±0.48)ng/mL,较同组造模前比较水平明显降低,且明显低于正常组,差异有统计学意义(P<0.05),说明糖皮质激素可影响兔血浆APN水平,从而引起骨坏死,见表2。
2.3 两组动物病理组织学检查比较[11]
造模组HE染色切片和组织形态学观察显示骨小梁减少,密度降低,局部骨小梁连续性中断。骨细胞核固缩,空骨陷窝明显增多。骨髓腔内有新出血区,骨髓腔内脂肪细胞增多,骨坏死显著,正常组未见明显异常,见封三图2~3。造模组空骨陷窝率较对照组明显升高,说明股骨头骨组织破坏较大(P<0.01),见表3。根据早期激素性股骨头坏死的病理学判断标准[12-13],可确定兔早期激素性股骨头坏死模型成功建立。
2.4 两组动物X线检查结果比较
造模完成后,随机在正常组和造模组中抽取2只实验兔进行X线片检查,造模组可见股骨头密度不均匀,骨小梁模糊,正常组未见明显异常,说明造模成功,见图1。
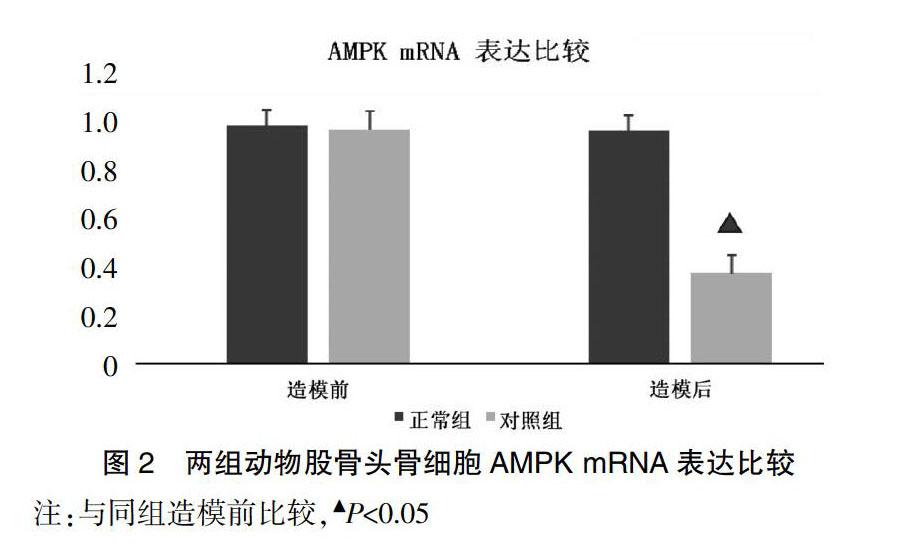
2.5 两组动物股骨头骨细胞AMPK mRNA表达比较
造模前,所有兔骨细胞AMPK mRNA表达检测结果显示无明显差异(P>0.05);实验9周末,造模组兔骨细胞AMPK mRNA表达为(0.364±0.017),较造模前显著降低,差异有统计学意义(P<0.05)。说明激素性骨坏死可导致兔股骨头骨细胞中AMPK mRNA表达明显减少,见图2。
2.6 造模组造模前后TNF-α/OPG 免疫组化IOD值比较
造模前后分别对造模组进行TNF-α/OPG免疫组化检测,造模后兔股骨头坏死区域内TNF-α炎性因子表达呈强阳性,IOD值较造模前明显升高,差异有统计学意義(P<0.05)。同时,造模后坏死区域内OPG表达降低,IOD值较造模前显著降低,差异有统计学意义(P<0.05)。见表4。
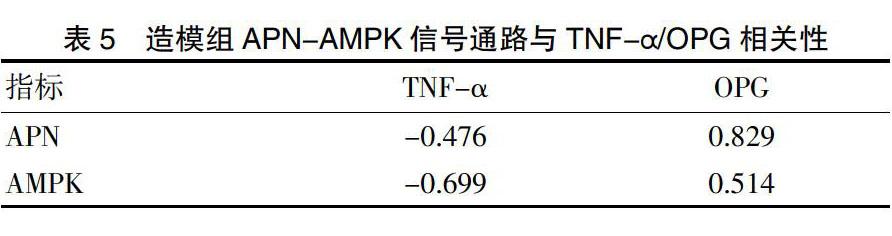
2.7 造模组APN-AMPK信号通路与TNF-α/OPG相关性分析
分析APN-AMPK信号通路与TNF-α/OPG相关性,可见血清APN含量和AMPK mRNA表达与OPG含量呈正相关性,与TNF-α表达呈负相关性,见表5。
3 讨论
脂肪组织是一种特殊的能量储存器官,分泌促炎细胞因子,合成多种脂肪因子,调节其他组织的生理功能[14]。在这些脂肪因子中,脂联素(APN)又称Acrp30、apM1和adipoQ,最初被认为是一种脂肪特异性蛋白,主要是由分化的脂肪细胞分泌。随着现代研究的深入,APN已成为脂肪细胞最丰富的生化产物,具有影响能量平衡、干预胰岛素敏感性、血管粥样硬化转归和改变炎症反应等作用。以往研究显示,APN是能量消耗和代谢的调节因子,但是最近观点认为APN可参与机体炎症反应和细胞凋亡过程[15-16],已有学者指出APN可促进骨髓间充质干细胞(BMSCs)的成骨及骨缺损的修复[17];也有学者通过应用APN干预大鼠脑缺血再灌注损伤模型,可有效改善损伤进程[18]。众所周知,激素性股骨头缺血性坏死诱因源自于大量使用糖皮质激素,导致股骨头脂质代谢异常,以及血管结构和功能破坏。已有研究证实刺激APN基因adipoq表达,可调节股骨头局部血管重建[19-20]。除此之外,APN能够通过减少糖异生而减少甘油三酯的积累[21],对激素性股骨头坏死的结构重建起到重要作用。通过本次实验发现,APN在激素性股骨头坏死血管重建和结构改善进程中承担了重要角色,通过干预体内APN水平或许能够为治疗激素性股骨头坏死提供新的方法。
腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一个异源三聚体蛋白,普遍存在于真核生物中,由催化亚基α、调节亚基β和γ三个亚基组成[22]。能被AMP与ATP 的比值变化所把控,广泛参与机体内代谢和能量需要[23]。研究显示,AMPK的α亚基在骨骼肌、心肌和肝脏中广泛表达,可以通过增强骨骼肌对糖脂类的摄取,干预脂肪组织和葡萄糖的转化,从而维持机体内环境的稳定。
通过本次研究,能够验证APN是AMPK的激活剂之一[24],造模组动物造模后血浆APN浓度明显降低,说明糖皮质激素能够降低APN含量,进而作用于AMPK信号通路负向传导,减低脂质代谢。此外,通过本次研究发现,骨坏死兔模型中AMPK mRNA表达明显较造模前降低,同时TNF-α/OPG免疫组化指标也相应的出现波动,因此在激素性股骨头坏死模型构建过程中,由于糖皮质激素堆积引起AMPK酶活性降低,降低AMPK信号通路正向传导,加剧骨坏死的形成。以往研究表明AMPK的激活会引起成骨细胞的分化和矿化[25-26],促进骨髓间充质干细胞介导的骨修复过程,本次研究能够证实通过干预APN-AMPK信号通路也许是治疗激素性股骨头坏死的潜在方法。
综上,脂联素体内含量可直接引起骨坏死疾病进程,也许APN-AMPK信号通路在疾病转归过程中承担重要角色,如果通过干预体内APN含量,诱导APN-AMPK信号通路正向传导,能够有效降低股骨头坏死区域炎症反应,降低血脂,进而保护血管内皮细胞、促进骨组织结构修复,这可能成为治疗激素性股骨头坏死的新的思路和方法。
[参考文献]
[1] Moya Angeler J,Gianakos AL,Villa JC,et al. Current concepts on osteonecrosis of the femoral head[J]. World J Orthop,2015,6(8):590-601.
[2] Microsurgery Department of the Orthopedics Branch of the Chinese Medical Doctor Association,Group from the Osteonecrosis and Bone Defect Branch of the Chinese Association of Reparative and Reconstructive Surgery,Microsurgery and Reconstructive Surgery Group of the Orthopedics Branch of the Chinese Medical Association. Chinese guideline for the diagnosis and treatment of osteonecrosis of the femoral head in adults:Guideline for ONFH[J]. Orthop Surg,2017,9(1):3-12.
[3] Ichiseki T,Ueda S,Ueda Y,et al. Involvement of necroptosis,a newly recognized cell death type,in steroid-induced osteonecrosis in a rabbit model[J]. Int J Med Sci,2017,14(2):110.
[4] 張立岩,孙新,田丹,等. 兔早期激素性股骨头缺血性坏死模型建立及其MRI与病理特征研究[J]. 中国修复重建外科杂志,2015,29(10):1240-1243.
[5] Wang XS,Zhuang QY,Weng XS,et al. Etiological and clinical analysis of osteonecrosis of the femoral head in Chinese patients[J]. Chin Med J(Engl),2013,126(2):290-295.
[6] 张兴,花金宝. 基于AMPK信号通路探究肺瘤平膏调控自噬影响肺癌进展的效应机制[D]. 北京:北京中医药大学,2019.
[7] 韩裕壁,张福利. 化瘀温胆汤对糖耐量低减大鼠胰岛素抵抗及AMPK信号通路的影响[D]. 黑龙江:黑龙江中医药大学,2017.
[8] 玄玲玲,侯琦. AMPK与肺部炎症研究进展[J]. 药学学报,2014,49(8):1089-1096.
[9] 中华人民共和国科学技术部.关于善待实验动物的指导性意见[S].2006-09-30.
[10] 佟鹏,王样,梁瀛. 激素性股骨头缺血性坏死动物模型的建立及综合评估[J]. 中国组织工程研究,2018,22(32):5169-5174.
[11] 张翔,董晓俊,吴泱,等. 早期激素性股骨头缺血性坏死动物模型的建立研究[J]. 中国中医骨伤科杂志,2018, 26(2):67-71.
[12] Russo BD,Baroni EL,Saravia N,et al. Prevention of femoral head deformity after ischemic necrosis using ibandronate acid and growth factor in immature pigs[J]. Surg Sci,2012,3(4):194-199.
[13] Banaszkiewicz PA. Idiopathic bone necrosis of the femoral head. early diagnosis and treatment[J]. J Bone Joint Surg Br,1985,67(1):3-9.
[14] Signorino JA,Jayaseelan DJ,Brindle K. Atypical clinical presentation of rapidly progressing femoral head avascular necrosis[J].Orthop Sports Phys Ther,2017,47(3):217.
[15] Ghoshal K,Bhattacharyya M. Adiponectin:Probe of the molecular paradigm associating diabetes and obesity[J]. World J Diabetes,2015,6(1):151-166.
[16] 陈亮,魏民,刘玉杰. 脂联素对骨性关节炎影响的研究进展[J]. 中华老年多器官疾病杂志,2017,16(8):620-623.
[17] Wang Y,Zhang X,Shao J,et al. Adiponectin regulates BMSC osteogenic differentiation and osteogenesis through the Wnt/β- catenin pathway[J]. Sci Rep,2017,17(4):3652.
[18] Dong Y,Li T,Li Y,et al. Micro RNA-23a-3p inhibitor decreases osteonecrosis incidence in a rat model[J]. Mol Med Rep,2017,16(6):9331-9336.
[19] 熊成海,刘保龙,闫华,等. 升高脑脊液瘦素水平预防兔骨质疏松的实验研究[J]. 中华骨科杂志,2016,36(18):1191-1201.
[20] 周俊,林文静,林森,等. 脂联素介导APPL1/AMPK信号通路对小鼠肾脏缺血再灌注损伤后期纤维化的影响[J]. 广东医学,2016,37(16):2384-2388.
[21] Tian ZJ,Liu BY,Zhang YT,et al. MiR-145 silencing promotes steroid-induced avascular necrosis of the femoral head repair via upregulating VEGF[J]. Eur Rev Med Pharmacol Sci,2017,21(17):3763-3769.
[22] Cao C,Huang W,Zhang N,et al. Narciclasine induces autophagy-dependent apoptosis in triple-negative breast cancer cells by regulating the AMPK-ULK1 axis[J]. Cell Prolif,2018,51(6):el12518.
[23] Herzig S,Shaw RJ. AMPK:Guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol,2018, 19(2):121-135.
[24] Tamargo-Gomez I,Marino G. AMPK:Regulation of metabolic dynamics in the context of autophagy[J]. Int J Mol Sci,2018,19(12):el1452.
[25] 李永志,董博,歐国峰,等.骨复生对激素性股骨头坏死大鼠骨组织中OPG及RANK表达的影响[J]. 中国中医骨伤科杂志,2018,26(11):1-6.
[26] Howell JJ,Hellberg K,Turner M,et al. Metformin inhibits hepatic mTORC1 signalling via dose-dependent mechanisms involving AMPK and the TSC complex[J]. Cell Metab,2017,25(2):463-471.
(收稿日期:2019-09-10)
