景虎通脉方抗ApoE⁃/⁃小鼠动脉粥样硬化的作用机制研究
2020-09-15杨迎飞和凤军王明明朱智芸胡旭红童晓云
麻 莉 杨迎飞 黄 丰 和凤军 周 敏 王明明 朱智芸 胡旭红 童晓云*
(1.云南中医药大学第一附属医院, 云南昆明650021; 2.昭通市中医院, 云南昭通657000; 3.云南中医药大学中药学院, 云南昆明650500; 4.宁乡市中医医院, 湖南宁乡410600)
动脉粥样硬化(Atherosclerosis,AS) 与多种心脑血管病变相关,其病理变化与多种因素相关,其中,免疫炎症反应扮演了重要角色[1]。研究表明,免疫炎症反应参与AS 斑块形成的起始环节,也是斑块不稳定的重要因素[2]。景虎通脉方为云南省荣誉名中医、云南省心脑血管病专家赵淳教授的临床验方,临床实践表明其有较好抗动脉粥样硬化的作用。课题组前期实验表明,景虎通脉方能有效降低高脂血症模型兔的颈动脉斑块形成,降低血总胆固醇(TC)、甘油三酯(TG) 及低密度脂蛋白(LDL⁃C) 水平,并能降低外周血的炎症因子,如细胞间黏附分子⁃1 (Intercellular Cell Adhesion Molecule⁃1,ICAM⁃1)、IL⁃6 的表达,该作用可能与其抑制Toll 样受体4 (Toll⁃like receptor 4,TLR4) 信号通路密切相关[3⁃4]。大量研究表明TLR4 通路异常激活在AS 免疫炎症中发挥重要作用,因此,干预TLR4 通路的异常激活,可能对防治AS 有重要意义。近年的研究提示核受体77(Nuclear Receptor Nur77) 基因缺失斑块内的TLR4基因表达会增高,促进AS 形成[5]。为探寻景虎通脉方是否通过调控Nur77 蛋白抑制TLR4 信号通路,本研究拟利用高脂饲料饲养ApoE-/-小鼠,通过多种指标观察景虎通脉方作用机制。同时,为进一步深入研究景虎通脉方的作用机制,本实验还采用miRNA 基因芯片分析景虎通脉方可能的作用途径,观察其与TLR4 及Nur77 信号通路的其他分子是否有关系。
1 材料
1.1 动物 SPF 级C57BL/6/J 小鼠6 只(作为正常组),ApoE-/-小鼠30 只(分5 组),体质量(25±5) g,雄性,购于维通利华实验有限公司 (北京),生产许可证号SCXK (京) 2012⁃0001。
1.2 药物与试剂 景虎通脉方组成为红景天10 g(河北金叶子药业有限公司,批号171101C180)、虎杖20 g、三七10 g、茯苓15 g (云南省中医医药中药房)、菲牛蛭冻干粉1 g (云南海瑞迪生物公司,批号201309199)、隔山消15 g (安国市聚药堂药业有限公司,批号1604001),经云南省中医医药药学部李松梅主任鉴定为正品,制成浸膏,于4 ℃保存备用。阿托伐他汀(立普妥,辉瑞制药有限公司,批号H20051407)。TG 试剂盒(中生北控生物科技股份有限公司,批号177761);TC 试剂盒(中生北控生物科技股份有限公司,批号177601);LDL⁃C 试剂盒(中生北控生物科技股份有限公司,批号170701);高密度脂蛋白(HDL⁃C) 试剂盒(中生北控生物科技股份有限公司,批号170651);肿瘤坏死因子α (TNF⁃α) 试剂盒(杭州联科生物科技有限公司,批号220680726);白介素⁃1β (IL⁃1β) 试剂盒(杭州联科生物技术有限公司,批号2201870231);白介素⁃6 (IL⁃6)试剂盒 (杭州联科生物技术有限公司,批号220680124)。Luminex 试剂盒 (美国R&D 公司,批号L123808)。
1.3 仪器 HERAEUS MEGAFUGE 台式离心机(美国Thermo 公司);Spectra Max i3x 酶标仪(美国Molecular Devices 公司);Dm 2500 图像分析系统(德国Leica 公司)。
2 方法
2.1 造模、分组及给药 雄性C57BL/6/J 小鼠6只为正常组,予普通饲料。6 周龄ApoE-/-小鼠共30 只,适应性饲养1 周,予高脂膳食饲料(含脂肪21%,胆固醇0.15%) 继续喂养8 周,以建立AS 模型。随机分为模型组、阳性对照组(阿托伐他汀10 mg/kg) 及景虎通脉方高、中、低剂量组(18.20、9.10、4.55 g/kg),每组各6 只,然后开始药物干预,灌胃给药,1 次/d,8 周后处死动物取材。
2.2 检测指标
2.2.1 血脂4 项 取小鼠外周血,3 000 r/min 离心10 min,取血清,按照试剂盒说明书测定血脂TC、TG、HDL⁃C 及LDL⁃C 水平。
2.2.2 HE 染色 取小鼠主动脉根部制成常规石蜡切片,HE 染色,观察、拍照并采用Image⁃pro⁃plus 5.0 图像处理软件计算斑块面积。
2.2.3 Masson 染色 取小鼠主动脉根部制成常规石蜡切片,经Masson 染色,观察后拍照并采用IPP 5.0 图像处理软件计算斑块内胶原比例;AS 斑块面积= [(斑块面积/血管腔总面积)] ×100%。
2.2.4 炎性因子TNF⁃α、IL⁃1β、IL⁃6 检测 根据ELISA 试剂盒说明书对小鼠血清进行测定。
2.2.5 免疫组化检测TLR4、Nur77 表达 免疫组化检测主动脉根部中TLR4、Nur77 表达,观察后拍照。阳性表达为胞质或胞膜呈棕褐色颗粒。采用Image⁃Pro⁃Plus、IPP 6.0 图像处理软件计算阳性面积。
2.2.6 Western blot 检测TLR4、Nur77 表达 取适量新鲜血管,提取总蛋白,用Western blot 法分别检测TLR4、Nur77 表达,采用Image⁃Pro⁃Plus,IPP 6.0 图像处理软件进行定量。
2.2.7 基因芯片杂交技术筛选差异基因 取适量新鲜主动脉,提取总RNA,与miRNA 芯片进行杂交得到数据进行分析。
2.3 统计学方法 多组间的比较采用单因素方差分析,两组间的比较采用t检验,研究中的计量资料采用 () 表示。P≤0.05 为差异有统计学意义。
3 结果
3.1 血脂检测 与正常组小鼠比较,模型组小鼠外周血中TC、TG、LDL⁃C、HDL⁃C 水平升高(P<0.05,P<0.01);与模型组比较,阳性对照组及景虎通脉方各剂量组TC、TG、LDL⁃C 水平均有不同程度降低(P<0.05,P<0.01),景虎通脉方各剂量组HDL⁃C 水平不同程度升高 (P<0.05,P<0.01),见表1。
表1 各组小鼠血脂水平(, n=6)Tab.1 Serum lipid levels of mice in each group (, n=6)

表1 各组小鼠血脂水平(, n=6)Tab.1 Serum lipid levels of mice in each group (, n=6)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
3.2 HE 染色 正常组小鼠的血管内膜比较完整,未见AS 斑块;模型组小鼠的血管内见到较多斑块,血管壁厚度呈不均匀状态(图1);相比于模型组,阳性对照组及景虎通脉方组小鼠主动脉血管内斑块面积减小(P<0.01),见表2。
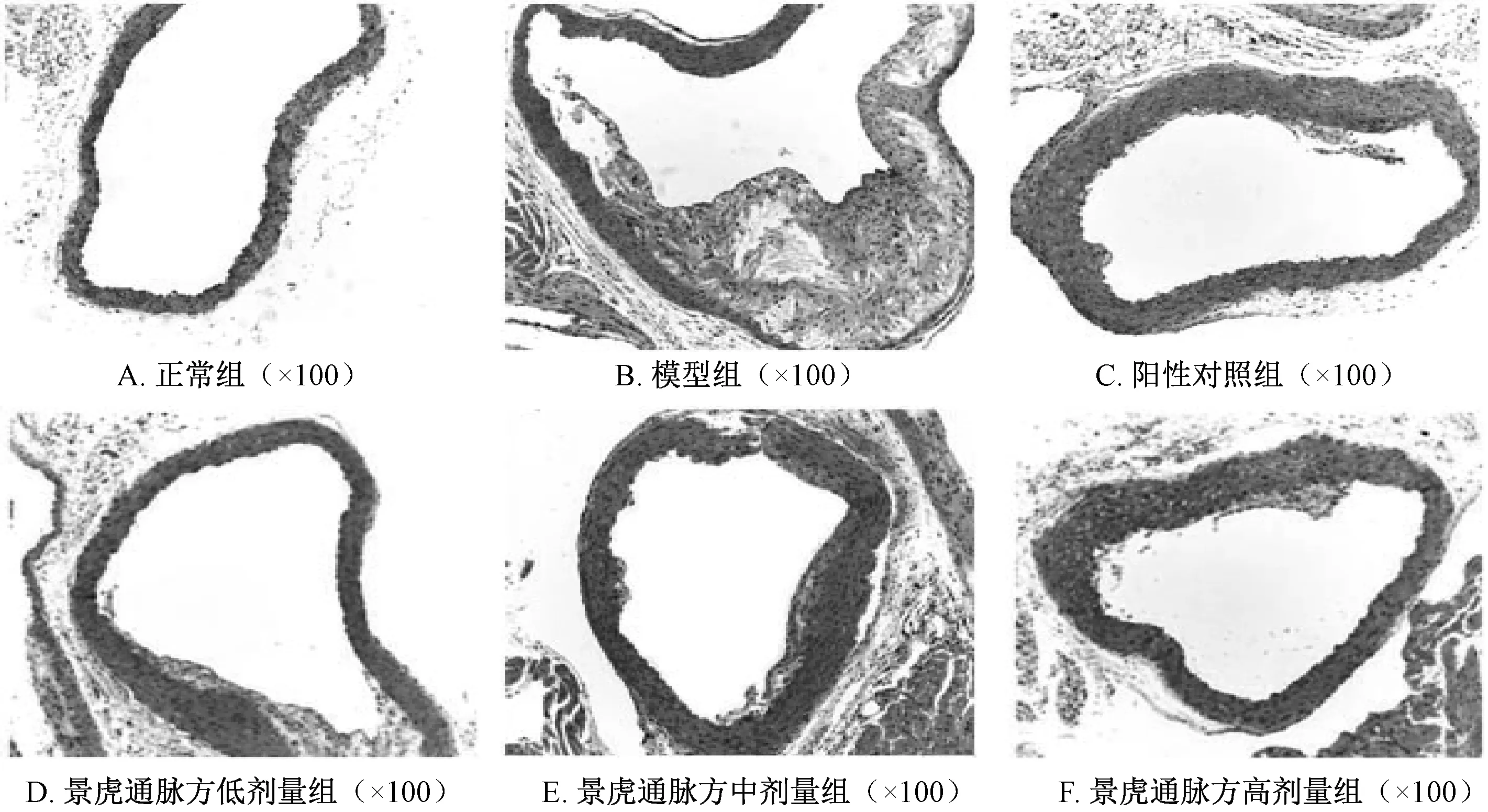
图1 小鼠HE 染色在各组中的变化Fig.1 Changes of HE staining in mice of each group
表2 各组小鼠AS 斑块面积(, n=6)Tab.2 AS plaque areas in mice of each group (,n=6)

表2 各组小鼠AS 斑块面积(, n=6)Tab.2 AS plaque areas in mice of each group (,n=6)
注:与模型组比较,##P<0.01。
3.3 Masson 染色 正常组小鼠的主动脉内未见斑块,且无斑块内胶原纤维;相比于模型组,阳性对照组及景虎通脉方高、中、低剂量组小鼠的主动脉斑块内可见胶原纤维增加(P<0.01),见图2、表3。
3.4 ELISA 检测炎性因子TNF⁃α、IL⁃1β、IL⁃6 水平 与正常组比较,模型组血清中的炎性因子TNF⁃α、IL⁃1β、IL⁃6 水平均升高(P<0.01);与模型组比较,景虎通脉方各剂量组小鼠血清TNF⁃α、IL⁃1β、IL⁃6 水平均下降(P<0.01),见表4。

图2 Masson 染色在各组中的变化Fig.2 Changes of Masson staining in each group
表3 各组小鼠AS 斑块内胶原纤维表达(, n=6)Tab.3 Expression of collagen fibers in AS plaques in mice of each group (, n=6)

表3 各组小鼠AS 斑块内胶原纤维表达(, n=6)Tab.3 Expression of collagen fibers in AS plaques in mice of each group (, n=6)
注:与模型组比较,#P<0.05,##P<0.01。
3.5 免疫组化检测TLR4、Nur77 表达 正常组小鼠主动脉组织中未见斑块,未见TLR4、Nur77 表达。与模型组比较,阳性对照组和景虎通脉方各剂量组小鼠主动脉组织TLR4 阳性面积减小 (P<0.01)。与模型组比较,阳性对照组和景虎通脉方各剂量组小鼠主动脉组织Nur77 阳性面积增加(P<0.05,P<0.01),见图3~4、表5。
表4 各组小鼠炎性因子水平(, n=6)Tab.4 Levels of inflammatory factors in mice of each group (, n=6)

表4 各组小鼠炎性因子水平(, n=6)Tab.4 Levels of inflammatory factors in mice of each group (, n=6)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01。
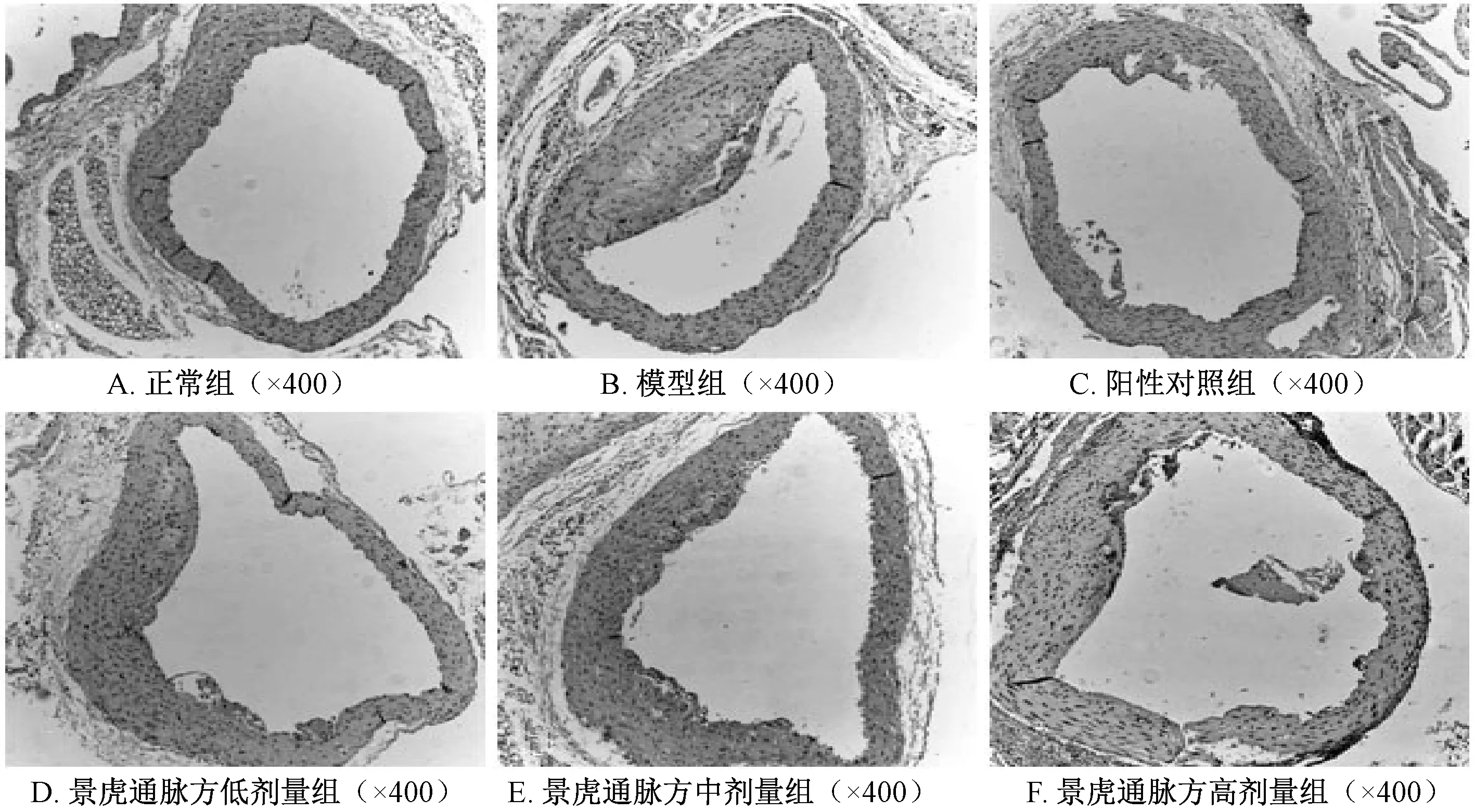
图3 TLR4 蛋白表达在各组中的变化(免疫组化)Fig.3 Changes of TLR4 protein expression in each group (immunohistochemical)
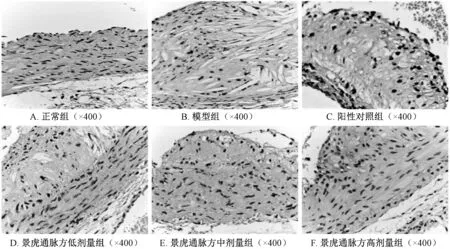
图4 Nur77 蛋白表达在各组中的变化(免疫组化)Fig.4 Changes of Nur77 protein expression in each group (immunohistochemistry)
表5 各组小鼠AS 斑块内免疫组化阳性面积(, n=6)Tab.5 Immunohistochemical positive area of AS plaques in mice of each group (, n=6)
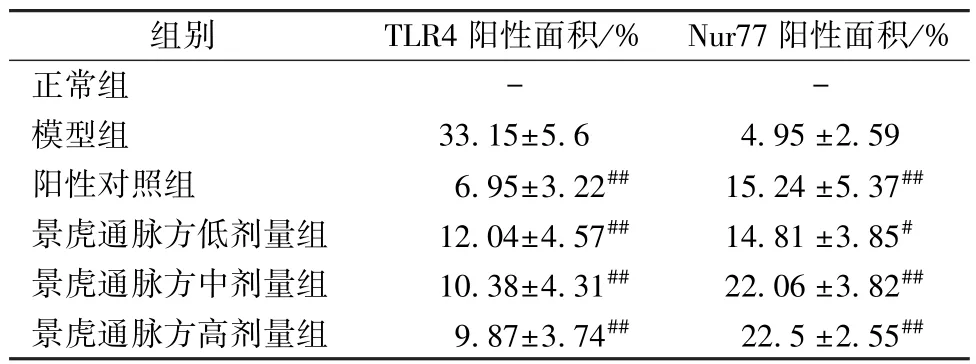
表5 各组小鼠AS 斑块内免疫组化阳性面积(, n=6)Tab.5 Immunohistochemical positive area of AS plaques in mice of each group (, n=6)
注:与模型组比较,#P<0.05,##P<0.01。
3.6 Western blot 检测TLR4、Nur77 表达 与正常组比较,模型组小鼠主动脉TLR4 蛋白表达增加(P<0.01);与模型组比较,阳性对照组及景虎通脉方中、高剂量组小鼠主动脉TLR4 蛋白表达降低(P<0.05,P<0.01),表明阿托伐他汀与景虎通脉方中、高剂量组均可抑制TLR4 的表达。与正常组比较,模型组小鼠主动脉Nur77 蛋白表达降低(P<0.01);与模型组比较,阳性对照组与景虎通脉方各剂量组小鼠主动脉Nur77 表达增加 (P<0.01),表明阿托伐他汀与景虎通脉方各剂量组均可促进小鼠主动脉Nur77 蛋白表达(图5、表6)。

注: A~F 分别为正常组、模型组、阳性对照组、景虎通脉方低剂量组、景虎通脉方中剂量、景虎通脉方高剂量组。
表6 各组小鼠主动脉Nur77 和TLR4 蛋白表达(, n=6)Tab.6 Expression of aortic Nur77 and TLR4 proteins in mice of each group (, n=6)

表6 各组小鼠主动脉Nur77 和TLR4 蛋白表达(, n=6)Tab.6 Expression of aortic Nur77 and TLR4 proteins in mice of each group (, n=6)
注:与正常组比较,** P <0.01;与模型组比较,# P <0.05,##P<0.01。
3.7 小鼠动脉miRNA 差异基因的筛选及相关通路富集分析
3.7.1 RNA 的检测与芯片杂交 样品总RNA 经定量并检测其完整性,其中定量系统为NanoDrop ND⁃2000 (Thermo Scientific),检测系统为Agilent Bioanalyzer 2100 (Agilent Technologies),质检合格后进行样本的标记、芯片的杂交以及洗脱。其中标记物为Cyanine⁃3⁃CTP (Cy3)。标记好的RNA 经过纯化后和芯片杂交、洗脱,之后经扫描得到原始图像,其中扫描系统为Agilent Scanner G2505C (Agi⁃lent Technologies)。
3.7.2 数据分析 提取原始数据的软件为Feature Extraction (Version10.7.1.1,Agilent Technologies),quantile 标准化和后续处理利用Genespring 软件(Version13.1,Agilent Technologies),对标准化后的数据进行过滤,留下进行后续分析的样本中至少有一组100%标记为D 探针。
3.7.3 差异miRNA 的筛选 差异miRNA 的筛选标准为倍数变化值(FC),其中选取的标准为FC≥2.0。选取C 组VSM 组差异的miRNA 集合,共198个,其中上调108 个,下调98 个,进行后续分析。
3.7.4 差异miRNA 的表达量变化 用“3.7.3” 项下差异miRNA 在阳性对照组、景虎通脉方低剂量组、景虎通脉方中剂量组、景虎通脉方高剂量组中的表达量来进行STEM 分析,筛选出变化趋势P≤0.01 的miRNA 共49 个,以表达量绘制热图(图6)。

图6 差异miRNA 表达热图Fig.6 Heat map of differential miRNA expression
3.7.5 靶基因预测 利用Target Scan、PITA、microRNA org 3 个数据库对差异miRNA 进行靶基因预测,取3 个数据库预测到的靶基因交集,共1 277个,如图7 所示,取共同基因进行通路富集分析(KEGG)。
3.7.6 KEGG 利用KEGG 分析来判定差异miRNA主要影响的生物学功能或通路,每个pathway 按照P值进行升序排列,富集越显著(P值越小) 越靠前,结果如图8 所示,选取P<0.05 的前20 条通路进行下一步分析。结果显示,景虎通脉方的作用于多条信号通路相关,关系最密切的是Axon guidance 通路,该通路可能与Nur77 及TLR4 存在相互调节作用,且在AS 中扮演重要角色[6⁃7]。其他也包括与AS相关的 Neurotrophin、PI3K/Akt 及 MAPK 通路等[8⁃9]。

图7 靶基因预测Fig.7 Target genes prediction
4 讨论
AS 的形成和发生与多种因素相关,其机制尚未完全阐释,因此治疗方面仍存在多种问题。中医药在AS 方面近些年取得一定进展,但机制研究不够深入,加强相关的研究具有重要的实际意义[10⁃11]。

图8 KEGG 通路富集分析Fig.8 KEGG pathway enrichment analysis
中医学认为,AS 的发病多与饮食失节、先天禀赋不足及年老体虚等因素有关。脾胃受损,肝肾亏虚,水谷精微失于健运,痰凝气滞,血脉不利;痰瘀互结,日久生热化毒,故“虚、痰、瘀、毒” 贯穿本病全过程,其病性属本虚标实,本虚为脾气不足、肝肾精虚,标实为痰浊、气滞、瘀血、热毒等。景虎通脉方为云南省荣誉名中医、云南省心脑血管病专家赵淳教授的经验方。方中红景天益气活血,虎杖清热解毒、活血祛湿,水蛭破血逐瘀(在此选用了水蛭素含有量最高、抗凝血活性最强的菲牛水蛭),茯苓健脾利湿化痰,隔山消补益肝肾、强健筋骨,全方可补气益肾、活血通络、化痰解毒,且虚、痰、瘀、毒同治,通补兼施。本方在治疗AS 方面取得了较好的临床效果[12],但其具体机制尚待研究。为进一步深入评价景虎通脉方对AS 血管斑块的作用,采用ApoE-/-小鼠,并用高脂饲料造模进行观察。
AS 的发生常伴TC、TG、LDL⁃C 水平升高。其中,以LDL⁃C 升高为特征的血脂异常更是AS 形成的重要因素。经景虎通脉方干预后,小鼠TC、TG、LDL⁃C 水平较模型组明显降低。景虎通脉方能够通过降低TC、TG、LDL⁃C 水平发挥抗AS 作用。通常认为HDL⁃C 对血管具有保护作用,但也有研究者提出在没有心血管事件史的个体中,低浓度的HDL⁃C与未来发生心血管事件的风险成反比。但是,这种关系可能不适用于患有代谢异常或表现为心血管疾病的患者[13]。本研究所采用的ApoE-/-小鼠本身存在脂质代谢异常的情况,因此,HDL⁃C 水平升高与AS 发生的关系仍有待于进一步研究。
AS 斑块的发展及其后期的脱落是引起心肌梗死、中风和外周血管疾病的危险因素。HE 和Masson 染色显示模型组小鼠主动脉血管内存在大量较不稳定的斑块[14],而景虎通脉方各组小鼠则可见到明显减少的血管斑块面积以及主动脉斑块中胶原表达的增加。因此,景虎通脉方可能通过减小斑块面积、增加斑块稳定性来发挥治疗AS 的作用。
炎症反应的失调是AS 的特征之一,激活的T细胞或者其他免疫应答均会影响现有的斑块,成为导致斑块纤维帽破裂的重要因素之一,而炎症与此密切相关。比如,IL⁃1β 过度活化会涉及多种炎性疾病的发病机制,包括类风湿性关节炎、I 型糖尿病和AS[15],而降低IL⁃1β 可减少AS 患者复发性心血管事件发生率[16]。TNF⁃α 与IL⁃1β 可通过多种信号通路参与AS 的形成及破裂。IL⁃6 是前炎症细胞因子,在炎症反应早期发挥重要作用,它可促进单核细胞在血管内皮下的聚集,并能促进体内脂质沉积从而有利于血管斑块形成[17]。本研究结果显示,与正常组相比,模型组小鼠血清中TNF⁃α、IL⁃1β、IL⁃6 水平明显升高。经景虎通脉方干预后,血清TNF⁃α、IL⁃1β、IL⁃6 水平降低,提示景虎通脉方干预AS 斑块形成的机制可能与抑制血清TNF⁃α、IL⁃1β、IL⁃6等炎性因子的水平相关。
大量研究显示,TLR4 在AS 的炎症病变中扮演重要角色,在AS 的各时期能分别检测到其在多种细胞中表达[18]。TLR4 的表达促进了NF⁃κB p65 在体内和体外的活化。抑制NF⁃κB 可减少炎症因子TNF⁃α、IL⁃1β、IL⁃6 的表达,降低TC 和LDL⁃C 水平[19⁃20]。AS 形成与TLR4 激活关系密切。因此,抑制TLR4 通路过度激活具有潜在的治疗意义,而Nur77 对TLR4 的负向调控研究不断受到重视。
Nur77 是AS 的早期反应基因,是炎症反应上游调节的关键[21],与AS 形成过程中的关键细胞如内皮细胞、平滑肌细胞及巨噬细胞等密切相关。Nur77基因的缺陷可激活TLR4 通路并刺激巨噬细胞分泌促炎因子,从而加重炎症反应。同时,Nur77 可调控NF⁃κB 信号传导影响炎症反应。Nur77 降低,TLR4 和TNF⁃α 表达增加,促使巨噬细胞向促炎性表型方向极化,并且这与增强NF⁃κB 活性相关。上调ApoE-/-小鼠Nur77 表达可减少高脂饮食所致AS斑块,并可减少脂质沉积、泡沫细胞形成和多种炎性因子的生成,同时,也能对抗单核细胞内皮细胞之间的黏附反应[22⁃23]。故调节Nur77 的表达可能成为体内抑制过度炎症反应的潜在治疗靶点。前期研究显示,景虎通脉方可通过调节颈动脉粥样硬化兔中TLR4、NF⁃κB、MCP⁃1 mRNA 的表达发挥作用[3]。进一步研究发现,景虎通脉方含药血清可抑制泡沫细胞的炎症反应,该作用可能与抑制泡沫细胞的清道夫受体CD36 和CD204 的表达相关[24],而清道夫受体在动脉粥样硬化的病变中与TLR4 密切相关[25]。本研究免疫组化和Western blot 结果均显示,模型小鼠中TLR4 表达增高,经景虎通脉方干预后其表达可降低。同时,模型小鼠中Nur77 蛋白表达降低,而景虎通脉方干预后其表达可增高。这些结果提示,景虎通脉方可能通过提高Nur77 蛋白表达、降低TLR4 表达,减少炎症因子TNF⁃α、IL⁃1β、IL⁃6 的分泌,从而减少模型小鼠中血管斑块的形成。
为了进一步深入研究景虎通脉方的作用机制,运用miRNA 基因芯片进行了分析。结果显示,有多条信号通路与其作用机制相关,值得注意的是轴突导向(Axon guidance) 通路中的差异基因变化最显著。Axon guidance 是1993 年左右被两个课题组先后发现并报道,在神经的发育及病理变化中扮演重要角色,后来发现其家族蛋白与多种免疫调节相关。最新的报道显示,它与AS 病变中扮演重要角色的多种细胞密切相关[26],而且Axon guidance 家族蛋白与Nur77 可能存在相互调控关系[6]。进一步的生物信息学分析发现,景虎通脉方的作用可能与TLR4相关且在AS 扮演重要角色的Neurotrophin、PI3K/Akt 及MAPK 等通路存在较高相关性[27]。这些结果提示,景虎通脉方可能有多种作用机制,如该方可能通过调节血脂,减少炎性因子分泌,调控Nur77表达,降低TLR4 表达,起到保护血管,稳定AS 斑块的目的;该方也可能通过调节与Nur77 相关的Axon guidance 蛋白家族的基因变化从而干预动脉粥样硬化的炎症反应。这些可能的作用机制,如该方是如何调控Nur77、Axon guidance 蛋白家族以及TLR4 通路发挥抗AS 作用,以及具体哪些miRNA 或蛋白发生明显变化等均有待进一步深入研究。
