补充维生素D对糖尿病足溃疡患者创面愈合、糖代谢、炎症及氧化应激的影响Δ
2020-09-15王少婷吴佩佩王振竞李东杰邓文涛王淑萍
王少婷,吴佩佩,王振竞,李东杰,邓文涛,王淑萍#
(1.东营市人民医院内分泌科,山东 东营 257091; 2.东营市人民医院泌尿外科,山东 东营 257091)
糖尿病足溃疡(diabetic foot ulcer,DFU)是糖尿病常见并发症,在糖尿病患者中的发病率高达10%~25%。DFU患者的溃疡和截肢的发病率也高达2.5%~10.7%和0.25%~1.8%[1]。DFU患者死亡率约为非DFU糖尿病患者的2倍,糖尿病神经病变和周围血管疾病是DFU的主要病因。胰岛素抵抗、血脂异常、炎症和氧化应激在DFU的发病机制中发挥着重要作用[2-3]。近年来,医学专家一直在探索维生素D缺乏对糖尿病患者的影响,包括维生素D在胰岛素分泌和胰岛素行为、免疫系统以及减少炎症和氧化应激中的作用。DFU患者的25羟维生素D3[25(OH)D3]水平较低,而关于补充维生素D对DFU患者胰岛素抵抗、炎症和氧化生物标志物影响的研究较少。研究结果显示,严重抑郁症患者每周补充50 000 IU的维生素D,连续补充8周,可以显著改善葡萄糖稳态和氧化应激指标,但不影响血脂水平[4];摄入维生素D可以加速创面愈合,并具有抗炎和抗氧化作用[5-6]。因此,本研究的目的是评价补充维生素D对DFU患者创面愈合和代谢状态、炎症和氧化应激的影响,现报告如下。
1 资料与方法
1.1 资料来源
选取2018年8月至2019年7月在东营市人民医院(以下简称“我院”)内分泌科治疗的DFU患者186例。诊断标准:依据美国糖尿病学会2016年制定的糖尿病和DFU诊断标准对患者进行诊断[7]。纳入标准:(1)患者符合上述DFU的诊断标准;(2)Wagner分级≥3;(3)年龄18~70岁。排除标准:(1)过去3个月内服用维生素D者;(2)存在除糖尿病以外的其他疾病造成的足部溃疡者;(3)合并免疫系统紊乱、骨髓炎和肿瘤等影响DFU愈合的疾病者;(4)接受放疗、化疗者,或长期使用抗凝血药、免疫抑制剂及糖皮质激素者。本研究经过我院伦理委员会的批准,患者或家属均签署了知情同意书。根据随机数字表法将患者分为维生素D组(n=93)和对照组(n=93)。收集两组患者的人口统计学资料、治疗情况与营养摄入情况。维生素D组与对照组患者年龄、体重和体重指数(BMI)、代谢当量(MET)、胰岛素和二甲双胍治疗患者所占比例、饱和脂肪酸(SFA)、多不饱和脂肪酸(PUFA)、单不饱和脂肪酸(MUFA)、总膳食纤维(TDF)水平及饮食中的大量和微量营养摄入量等基线资料的均衡性较高,具有可比性,见表1。
1.2 方法
所有患者入组前均接受相同的糖尿病健康宣传教育、饮食和运动指导。维生素D组患者口服维生素D滴剂(规格:每粒含维生素D3400 IU)治疗,1次2 000 IU,1日2次,连续口服12周。对照组患者服用形状和大小相似的安慰剂胶囊进行治疗。每2周对患者进行1次门诊随访,以进行中间评估和溃疡清创术。

表1 两组患者基线资料比较Tab 1 Comparison of baseline data between two groups
1.3 观察指标
检测并比较治疗前、治疗12周后两组患者25(OH)D3、溃疡、糖代谢、胰岛素、炎症、氧化应激和血脂指标水平,以评价补充维生素D对糖尿病足溃疡患者上述指标的影响。采用AU480型全自动生化分析仪(美国贝克曼公司)测定空腹血糖(FPG)、空腹胰岛素(FINS)、甘油三酯(TG)、总胆固醇(TC)、极低密度脂蛋白胆固醇(VLDL-C)、低密度脂蛋白胆固醇(LDL-C)高密度脂蛋白胆固醇(HDL-C)及糖化血红蛋白(HbA1c)水平。采用Ves-matic20型全自动动态红细胞沉降率(ESR)分析仪(意大利Diedded公司)测定ESR。稳态模型胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5;稳态模型胰岛素分泌指数(HOMA-β)=20×FINS/(FPG-3.5);定量胰岛素敏感性指数(QUICKI)=1/(log FINS+log FBG)。采用LIAISON全自动化学发光免疫分析系统(意大利Diasorin公司)测定25(OH)D3水平。采用酶联免疫吸附法测定高敏C反应蛋白(hs-CRP)、丙二醛(MDA)与趋化因子5(CCL5)水平。采用微量酶标法测定总谷胱甘肽(GSH)水平,采用硝酸还原酶法测定一氧化氮(NO)水平,采用化学比色法测定总抗氧化能力(TAC),试剂盒购于南京建成生物有限公司。创面面积(cm2)=创面宽度×创面长度,创面宽度是指创面内最宽距离,创面长度是指创面内最长距离,如果创面多于1处,则选取最大的创面面积进行记录,采用专用标尺进行测量;使用医用无菌棉签置入创面最深处,采用专用标尺测量创面深度;采用《贝茨-詹森伤口评分标准》[8]对患者伤口进行创面评分,评分内容包括肉芽组织、渗液量、坏死组织量、伤口潜行、周围皮肤颜色、渗液类型、坏死组织类型及边缘表皮等8个项目,每个项目分值1~5分,分值越高表示病情越重。在12周的研究过程中,患者不改变日常体育活动,也不服用任何营养补品。通过Nutritionist Ⅳ软件对每日大量和微量营养素摄入量进行分析。
1.4 统计学方法

2 结果
2.1 两组患者治疗前后25(OH)D3水平、创面愈合指标水平比较
治疗前,维生素D组与对照组患者25(OH)D3水平、创面面积、创面深度及创面评分比较,差异无统计学意义(P>0.05)。治疗后,维生素D组患者25(OH)D3水平较治疗前明显升高,差异有统计学意义(t=4.556,P<0.001);且维生素D组患者25(OH)D3水平较对照组明显升高,差异有统计学意义(t=5.794,P<0.001)。治疗后,维生素D组与对照组患者创面面积、创面深度及创面评分均较治疗前明显降低,差异有统计学意义(P<0.001);维生素D组患者创面面积、创面深度及创面评分较对照组明显降低,差异有统计学意义(P<0.05),见表2。提示连续12周补充维生素D可显著改善DFU患者的25(OH)D3水平和创面愈合指标。
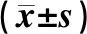
表2 两组患者治疗前后25(OH)D3水平、创面愈合指标水平比较Tab 2 Comparison of 25(OH)D3 levels and wound healing indicators between two groups before and after treatment
2.2 两组患者治疗前后糖代谢、胰岛素指标水平比较
治疗前,维生素D组与对照组患者FPG、HbA1c、FINS、HOMA-IR、HOMA-β及QUICKI比较,差异均无统计学意义(P>0.05)。治疗后,维生素D组患者FPG、HbA1c及HOMA-IR较治疗前明显降低;维生素D组患者HbA1c、FINS、HOMA-IR与HOMA-β均较对照组明显降低,QUICKI较对照组明显升高,差异均有统计学意义(P<0.05),见表3。提示补充维生素D可以显著改善DFU患者的糖代谢、胰岛素抵抗。
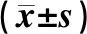
表3 两组患者治疗前后糖代谢、胰岛素指标水平比较Tab 3 Comparison of glycometabolism and insulin levels between two groups before and after treatment
2.3 两组患者治疗前后炎症、氧化应激指标水平比较
治疗前,维生素D组与对照组患者hs-CRP、ESR、CCL5、NO、TAC、GSH及MDA水平比较,差异均无统计学意义(P>0.05)。治疗后,维生素D组患者ESR、CCL5、TAC及MDA水平较治疗前明显降低,NO水平较治疗前明显升高;维生素D组患者hs-CRP、ESR、CCL5及MDA水平均较对照组明显降低,差异均有统计学意义(P<0.05),见表4。提示补充维生素D可以抑制DFU患者的炎症反应,减少氧化应激。
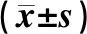
表4 两组患者治疗前后炎症、氧化应激指标水平比较Tab 4 Comparison of inflammatory and oxidative stress levels between two groups before and after treatment
2.4 两组患者治疗前后血脂指标水平比较
治疗前,维生素D组与对照组患者TG、TC、VLDL-C、LDL-C及HDL-C水平比较,差异均无统计学意义(P>0.05)。治疗后,维生素D组患者TG水平较治疗前和对照组治疗后明显降低,差异均有统计学意义(P<0.05),见表5。提示维生素D可以改善DFU患者的血脂指标。
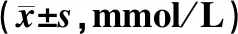
表5 两组患者治疗前后血脂指标水平比较Tab 5 Comparison of blood lipid levels between two groups before and after treatment
3 讨论

本研究结果显示,连续补充12周维生素D的DUF患者FPG、HbA1c、FINS、HOMA-IR与HOMA-β均较对照组显著降低,QUICKI较对照组明显升高,差异均有统计学意义(P<0.05)。提示补充维生素D可以显著改善糖尿病足患者糖代谢和胰岛素抵抗。尹万军等[13]的Meta分析结果表明,补充维生素D显著降低了妊娠糖尿病患者的FPG(SMD=-0.29,95%CI=-0.56~-0.02)、FINS(SMD=-0.42,95%CI=-0.69~-0.15)水平,改善了患者的HOMA-IR(SMD=-0.53,95%CI=-0.89~-0.17)、HOMA-β(SMD=-0.39,95%CI=-0.61~-0.18),提高了QUICKI(SMD=0.87,95%CI=0.41~1.32)。王炜等[14]的研究结果表明,新诊断T2DM患者血清25(OH)D3水平与HOMA-IR(r=-0.288,P=0.002)、Matsuda胰岛素敏感指数(r=-0.259,P=0.005)相关,提示维生素D与胰岛素分泌和胰岛素抵抗有关。维生素D缺乏是胰岛素抵抗增加和胰岛素分泌减少的促进因素,维生素D通过存在于β细胞质内的钙离子促进胰岛素的分泌。维生素D缺乏与胰岛素敏感性、分泌和合成相关。维生素D严重缺乏会降低机体适应性免疫应答,产生炎症,导致胰岛素抵抗和血管功能不良。维生素D能提高维生素D受体(vitamin D receptor,VDR)数量,并进一步提高胰岛素敏感性[15]。缺乏胰岛β细胞造成的胰岛素分泌不足是T2DM的主要发病机制,维生素D可以降低L型钙通道表达,而过多的钙信号能够诱导包括β细胞在内的细胞凋亡[9, 16]。
本研究结果表明,与安慰剂相比,补充维生素D,并连续服用12周,可降低DFU患者的血清hs-CRP、ESR、CCL5和MDA等炎症、氧化应激指标水平,差异均有统计学意义(P<0.05),但对NO、TAC与GSH等氧化应激生物标志物影响的差异无统计学意义(P>0.05)。提示补充维生素D可以抑制DFU患者的炎症反应、减少氧化应激。邓慧慧等[17]的研究结果表明,DFU患者的25(OH)D3水平显著低于健康对照组,DFU患者的CRP、ESR水平显著高于对照组。补充维生素D对DFU患者炎症反应的影响机制主要包括以下2个方面:(1)DFU患者缺乏维生素D时免疫功能受损,造成患者发生感染,加重了患者病情。补充维生素D后, 维生素D与VDR结合的活性产物在树突细胞、活化B细胞和T细胞中表达,促进抗菌肽产生,并对机体免疫进行调节。(2)血液中升高的炎症因子水平能够导致糖尿病和并发症发生。当DFU患者缺乏维生素D时,巨噬细胞吞噬功能和趋化功能发生障碍,造成抗炎反应调节不平衡。补充维生素D后,维生素D可以对抗炎性细胞因子诱导的细胞凋亡基因进行蛋白表达,进而发挥抗炎作用[6,17-18]。
本研究结果表明,治疗后, 维生素D组患者的CCL5水平较对照组显著降低,提示补充维生素D 12周可显著降低DFU患者的CCL5水平。维生素D能够激活VDR发挥抗炎作用,VDR具有抗炎作用,能够通过抑制核因子κB(NF-κB)来抑制蛋白的泛素化和磷酸化,通过抑制κB激酶活性等对NF-κB的转录表达进行抑制,NF-κB是糖尿病肾病炎症反应的重要转录因子,可调控包括CCL5在内的多种炎症相关因子表达[19]。
氧化应激是发生糖尿病足的生理和病理基础,补充维生素D能够减少DFU患者的氧化应激。非酯化脂肪酸和血糖水平过高导致的胰岛素抵抗能够促进机体产生活性氧,增加患者氧化应激。活性氧能够损害DNA、碳水化合物、脂质和蛋白质等生物大分子,造成细胞功能障碍甚至死亡。MDA水平可以显示机体脂质过氧化作用的稳定性。研究结果表明,血液透析患者补充3个月维生素D受体激动剂帕里骨化醇后,体内的MDA水平迅速降低,而维生素D主要通过清除机体酶类并产生离子来降低氧化应激[20]。
本研究结果表明,补充12周维生素D后,维生素D组患者的TG水平较对照组显著降低,差异有统计学意义(P<0.001)。Muoz-Aguirre等[21]的研究结果表明,T2DM女性患者连续6个月补充4 000 IU/d的维生素D会导致血清TG水平显著降低,而不会影响其他脂质谱的水平,与本研究结果一致。提示维生素D可能对DFU患者的血脂产生有利影响。有研究结果表明,维生素D摄入可能会增加钙的吸收,进而导致脂肪吸收增加;也有研究结果表明,维生素D通过改善胰岛素敏感性可能介导其对脂质分布的潜在益处[3,22]。目前,关于维生素D对血脂影响的机制还不清楚,还需要进一步研究。
综上所述,DFU患者补充维生素D可以显著改善DFU修复期的创面情况,加速创面组织生长;可以显著改善葡萄糖稳态和血脂,抑制炎症反应,减少氧化应激。
