小麦富含半胱氨酸的类受体激酶TaCRK2 与翻译控制肿瘤蛋白TaTCTP 的相互作用
2020-09-15安瑞朋王冬梅
顾 佳,李 浩,安瑞朋,刘 刚,王冬梅
(华北作物改良与调控国家重点实验室/河北省植物生理与分子病理学重点实验室/河北农业大学 生命科学学院, 河北 保定 071001)
类受体蛋白激酶(Receptor-like protein kinases,RLKs)是植物蛋白激酶家族中最大的家族,在跨膜信号传导中起着至关重要的作用。富含半胱氨酸的类受体激酶(Cysteine-rich receptor-like kinases, CRKs)是RLKs 中最大的亚家族。典型的CRKs 胞外含有2 个具有抗菌活性的DUF26 结构域(Domain of unknown function 26, DUF26)[1],DUF26 结构域包含3 个半胱氨酸(C-Xn-C-X2-C)的保守序列,可能作为氧化还原调节的潜在靶标,表明CRKs 可能会受到活性氧(Reactive oxygen species,ROS)的调节,而ROS 是植物响应多种逆境胁迫共同的信号分子,这意味着CRKs 可能在多种胁迫应答中起重要作用。
目前对模式植物拟南芥中CRKs 的研究较多,通过T-DNA 插入序列集合的大规模细胞组学分析,确定了与氧化应激相关的AtCRK 的主要作用[2]。AtCRK6 和AtCRK7 均参与胞外氧化胁迫的信号转导过程[3]。AtCRK13 的上调导致与细胞死亡相关的超敏反应,并诱导对病原体的防御[4]。AtCRK28过表达增加拟南芥抵抗丁香假单胞菌的能力[5]。AtCRKs 的研究成果引起了对该基因家族的极大关注,近几年,人们逐渐增加了对不同农作物抵抗病原菌侵染过程中CRKs 功能的研究。大麦HvCRK1在感染白粉菌后高表达,瞬时沉默HvCRK1 增强了大麦抵御白粉菌的能力,表明HvCRK1 在大麦抵抗白粉菌侵染过程中发挥负调控作用[6]。沉默OsCRK1 后获得的转基因植株表现出明显的感病性状,表明OsCRK1 正调控水稻对白叶枯病菌的抗 性[7]。同时,六倍体小麦中CRKs 的功能研究也已经展开,试验证明TaCRK1 在抗病品种CI12633 受到纹枯病菌侵染时有较高水平的表达[8]。以上研究表明CRKs 在植物应答生物或非生物胁迫过程中起到了至关重要的作用。
在研究小麦抵抗叶锈菌侵染的抗病机制过程中,本实验室通过RNA-Seq 分析分离克隆了小麦中富含半胱氨酸的类受体激酶2(Cysteine-rich receptorlike kinases2, TaCRK2),利用VIGS 和RNAi 技术沉默TaCRK2 后导致小麦抵御叶锈菌的能力降低[9],借助串联亲和纯化-质谱鉴定(TAP-MS)技术,发现了1 个TaCRK2 潜在的互作蛋白即翻译控制肿瘤蛋白(Translationally controlled tumor proteins,TCTP)。但对于TaCRK2 与TaTCTP 的相互作用缺乏试验验证。
TCTP 是一种广泛存在于植物、动物和酵母等真核生物中且高度保守的亲水蛋白,在细胞内、外均能发挥作用,对细胞的增殖、分化和凋亡起调控作用,参与细胞免疫应答等[10-12]。AtTCTP 的过表达抑制了BAX 蛋白诱发的细胞程序性死亡,表明其参与了对细胞程序性死亡的调控[13]。另外,Meng 的研究发现,黄瓜TCTP 基因超表达会导致黄瓜对白粉病的抗性降低,表明其对白粉病起负调控作用[14]。在小麦中对TCTP 也有了初步的认识,TaTCTP 正调控小麦抵抗叶锈菌侵染的过程[15]。虽然利用TAP-MS 技术发现了TaTCTP 是TaCRK2 的互作蛋白,但对TCTP 互作蛋白的研究还鲜有报道。本试验利用DUALmembrane系统酵母双杂交(DUALmembrane system yeast-twohybrid)和双分子荧光互补(Bimolecular fluorescence complementation,BiFC)试验验证两者间的相互作用。
本研究使用的DUALmembrane 系统不同于可溶性蛋白质间相互作用验证的酵母双杂交系统[16-17]。DUALmembrane 系统是利用分裂泛素机制来检测细胞内自然环境中膜整合蛋白或膜相关蛋白间或与其他蛋白质间的相互作用,能够在膜上原位检测到发生相互作用的蛋白。Zhang 等人利用DUAL 膜系统从感染甘蔗花叶病毒的植株中筛选并检测到与SCMV-6K2 相互作用的蛋白[18]。本实验室前期工作已经证明TaCRK2 定位在内质网膜上[9],因此利用DUALmembrane 系统可以更准确的验证TaCRK2 与TaTCTP 的相互作用。
借助DUALmembrane 系统酵母双杂交、BiFC试验验证TaCRK2 与TaTCTP 二者间的相互作用,有助于进一步了解TaCRK2 在小麦与叶锈菌互作过程中的作用机制,对揭示小麦抗叶锈病的机理及信号转导机制具有重要意义。
1 材料方法
1.1 植物和叶锈菌材料
小麦(Triticum aestivum L.)近等基因系TcLr26与本生烟草(Nicotiana benthamiana)均为本实验室长期保存的材料。小麦叶锈菌(Puccinia triticina)生理小种260 与TcLr26 组成不亲和组合,利用感病品种‘郑州5389’进行小麦叶锈菌的繁殖。
TcLr26 小麦幼苗在23 ~25 ℃的温室中培养,7 日龄TcLr26 接种小麦叶锈菌生理小种260。根据Qiao[19]的方法种植小麦及接种叶锈菌。本生烟草在23 ~25 ℃ 的温室中培养大约30 d,可以注射农杆菌,进行双分子荧光互补试验,根据Sparkes[20]的方法种植 烟草。
1.2 试验引物合成
利 用primer premier 5.0 软 件, 根 据TaCRK2 (GenBank 登录号: MK424819)核苷酸序列,设计出具有Sfi I 限制性位点的基因特异性引物Y2HTaCRK2 F/R 和具有Sal I 和Kpn I 限制性位点的基因特异性引物BiFC-TaCRK2 F/R。根据TaTCTP(GenBank 登录号:542949)核苷酸序列,设计出具有Sfi I 限制性位点的基因特异性引物Y2HTaTCTP F/R 和具有Sal I 和Kpn I 限制性位点的基因特异性引物BiFC-TaTCTP F/R。除 M13 F/R 外,其余引物均由上海生工生物工程技术服务有限公司合成(表1)。
1.3 目的序列的扩增
在7 日龄小麦叶片表面接种Puccinia triticina生理小种260,在接种48 h 时取样,利用Trizol (生工,上海)的方法提取总RNA,依据TaKaRa 反转录试剂盒 PrimeScriptTMRT reagent Kit with gDNA Eraser (TaKaRa,大连)合成cDNA。以该cDNA 为模板,利用引物TaTCTP F/R,使用高保真酶PrimeSTAR®Max DNA Polymerase (TaKaRa,大连) 扩增得到TaTCTP 的编码区,长度为507 bp,连接至克隆载体pEASY-T1 (全式金,北京) 上,利用引物M13F/R 筛选阳性克隆,测序由北京华大基因股份有限公司完成。通过5’RACE 技术克隆得到TaCRK2 编码区全长1 482 bp[9]。

表 1 试验所用引物Table 1 Primers used in the study
1.4 重组表达载体的构建
为构建TaCRK2 和TaTCTP DUALmembrane 系统酵母双杂交载体,使用具有Sfi I 限制性位点的基因特异性引物Y2H-TaCRK2 F/R 和Y2H-TaTCTP F/R (表1),扩增TaCRK2 和TaTCTP 的编码序列,将扩增产物进行琼脂糖凝胶电泳,使用SanPrep 柱式DNA 胶回收试剂盒 (生工,上海) 回收目的片段,目的片段与载体pPR3-N 和pBT3-N 经Sfi I 进行酶切后,用Solution I DNA 连接酶进行连接,然后转化到大肠杆菌 (Escherichia coli) DH5α 感受态细胞。对得到的阳性克隆进行酶切验证和测序。测序结果用DNAMAN 软件进行比对分析。
为构建TaCRK2 和TaTCTP 双分子荧光互补载体,使用具有Sal I 和Kpn I 限制性位点的基因特异性引物BiFC-TaCRK2 F/R 和BiFC-TaTCTP F/R(表1),扩 增TaCRK2 和TaTCTP 的编码序列。过程与构建DUAL- membrane 系统酵母双杂交载体相同,将构建成功的重组质粒通过热激法转化到根癌农杆菌(GV3101)中。
1.5 DUALmembrane 系统酵母双杂交
使用PEG/LiAc 法转化酵母NMY51。pPR3-N和pBT3-N 为 空 载 体 对 照、pPR3-N 和pBT3-NTaCRK2、pPR3-N 和pBT3-N-TaTCTP 为阴性对照,检测2 个基因的自激活。pPR3-N-TaTCTP 和pBT3-N-TaCRK2 共 转 化、pPR3-N-TaCRK2 和pBT3-NTaTCTP 共转化作为试验组。将重组质粒转化到NMY51 酵母感受态细胞中,菌液涂布于缺陷型二缺 (SD/-Leu/-Trp) 培养基上,28 ℃倒置培养3 d ,挑取较大的单个菌斑到二缺液体培养基中,28 ℃振荡培养,直至OD546大约为0.6,用双蒸水稀释至OD546为0.2,稀释后的菌液点在二缺、三缺 (SD/-Leu/-Trp/-His) 和四缺 (SD/-Leu/-Trp/-His/-Ade) 的培养基上,28 ℃倒置培养3 ~4 d 后观察并拍照。
1.6 双分子荧光互补
在烟草叶片中,将含有目的基因的重组质粒瞬时表达。对分别携带有pSPYNE、pSPYCE、pSPYNE-TaCRK2、pSPYCE-TaCRK2、pSPYNETaTCTP 和pSPYCE-TaTCTP 重 组 质 粒 的GV3101农杆菌进行过夜培养,4 000 r/min,15 min 离心,所得菌体用侵染缓冲液(10.06 g/L MES、0.76 g/L Na3PO4、5 g/L 葡萄糖、0.1 mmol/L AS)洗涤,再用侵染缓冲液重悬菌体,调OD600值约为0.6。将携带有pSPYNE 和pSPYCE-TaCRK2、pSPYNETaCRK2 和 pSPYCE、pSPYNE 和 pSPYCETaTCTP、pSPYNE-TaTCTP 和pSPYCE、pSPYNETaCRK2 和pSPYCE-TaTCTP、pSPYNE-TaTCTP 和pSPYCE-TaCRK2 的农杆菌均按1∶1 的比例混合,然后注射烟草,在48 h 后使用激光扫描共聚焦显微镜(OLYMPUS FV1000,日本)进行观察并拍照。
2 结果与分析
2.1 DUALmembrane 系统酵母双杂交载体的构建
以pPR3-N 和pBT3-N 为载体,使用单酶切连接法构建DUALmembrane 系统酵母双杂交载体。使用引物Y2H-TaCRK2 F/R 扩增TaCRK2 编码区,使用引物Y2H-TaTCTP F/R 扩增TaTCTP 编码区。用Sfi Ⅰ将目的基因和表达载体pPR3-N 和pBT3-N酶切,用连接酶进行连接、转化到DH5α 感受态细胞中。在大约1 482 bp(图1-a, b)和507 bp(图1-c, d)处检测到目的条带,结果表明TaCRK2 和TaTCTP基因的DUALmembrane 系统酵母双杂交载体构建成功。

图1 DUALmembrane 系统酵母双杂交载体的酶切鉴定Fig. 1 Restriction enzyme digestion of the DUALmembrane system yeast two-hybrid vectors
2.2 双分子荧光互补载体的构建
使用引物BiFC-TaCRK2 F/R 扩增带Sal I 和Kpn I 酶切位点的TaCRK2 编码区,使用引物BiFCTaTCTP F/R 扩 增 带Sal I 和Kpn I 酶 切 位 点 的TaTCTP 编码区。将目的基因TaCRK2 和TaTCTP 与表达载体pSPYNE 和pSPYCE 用Sal I 和Kpn I 双酶切,用连接酶进行连接、转化到DH5α 感受态细胞中。结果显示,在大约1 482 bp(图2-a, b)和507 bp(图2-c, d)处检测到目的条带,表明TaCRK2 和TaTCTP 基因的双分子荧光互补载体构建成功。
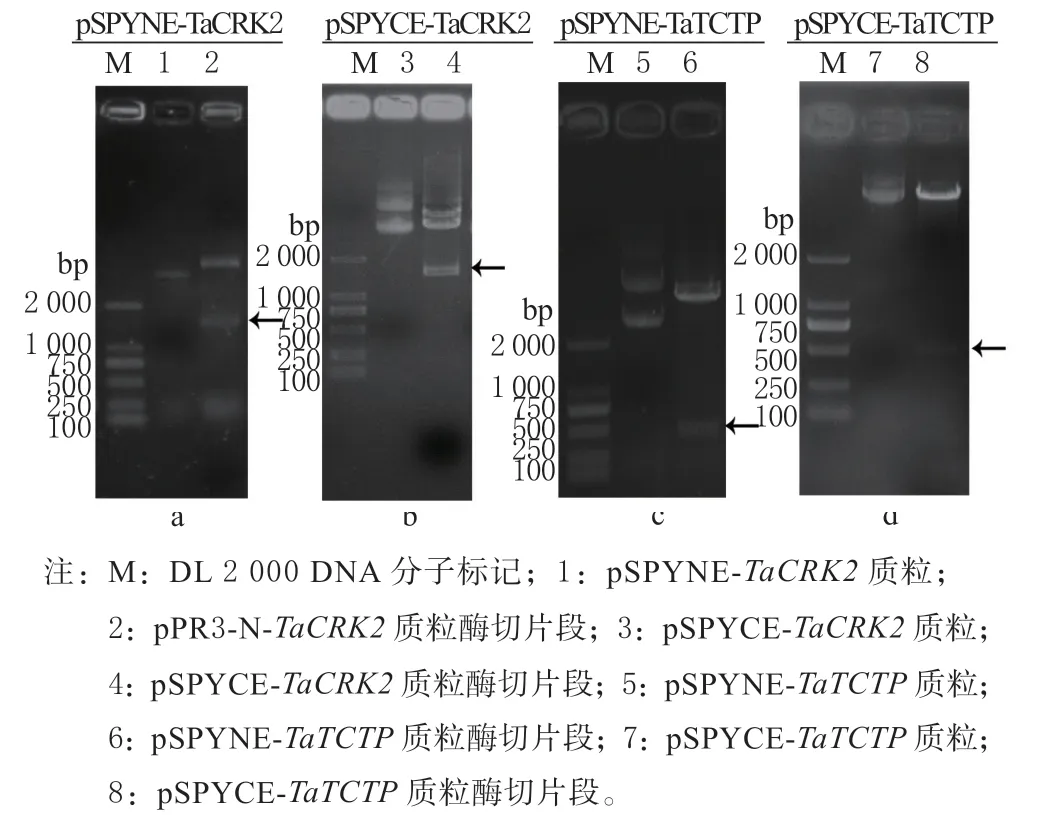
图2 双分子荧光互补载体的酶切鉴定Fig. 2 Restriction enzyme digestion of the bimolecular fluorescence complementary vectors
2.3 TaCRK2 与TaTCTP 相互作用的DUALmembrane系统酵母双杂交检测
在SD/-Leu/-Trp(-LW)平板培养基上,pPR3-N 和pBT3-N 空载体、pPR3-N 和pBT3-N-TaCRK2 共转化、pPR3-N 和pBT3-N-TaTCTP 共转化、pPR3-N-TaTCTP 和pBT3-N-TaCRK2 共 转 化、pPR3-NTaCRK2 和pBT3-N-TaTCTP 共转化的酵母均正常生长,并且其生长状态基本一致。在SD/-Leu/-Trp/-His(-LWH)培养基上,只有pPR3-N-TaTCTP和pBT3-N-TaCRK2 共 转 化、pPR3-N-TaCRK2 和pBT3-N-TaTCTP 共转化的酵母正常生长(见图3)。在SD/-Leu/-Trp/-His/-Ade(-LWHA)培养基上的生长状况与SD/-LWH 平板培养基上的生长状况基本一致。结果表明TaCRK2 与TaTCTP 在酵母中发生了相互作用。

图3 DUALmembrane 系统酵母双杂交检测 TaCRK2 与TaTCTP 的相互作用Fig. 3 DUALmembrane system yeast two-hybrid detection of TaCRK2 and TaTCTP interaction
2.4 TaCRK2 与TaTCTP 相互作用的双分子荧光互补试验检测
在酵母细胞中TaCRK2 与TaTCTP 能发生相互作用,为了进一步检测TaCRK2 与TaTCTP 是否会在植物体内相互作用,使用双分子荧光互补试验验证TaCRK2 与TaTCTP 在烟草细胞中的相互作用。将 携 带TaCRK2 与TaTCTP 的pSPYNE 和pSPYCE载体单独或共同注射烟草叶片,用激光扫描共聚焦显微镜观察。结果显示,TaCRK2 和TaTCTP 共同转化的烟草下表皮细胞的荧光信号很强,而单独注射的对照组烟草没有荧光(图4),其荧光信号的分布特征与前期对TaCRK2 进行的亚细胞定位结果极其相似[9]。结果表明,TaCRK2 与TaTCTP 可以在植物细胞内相互作用,由于TaCRK2 定位于内质网膜,所以二者的相互作用很可能发生在内质网 膜上。

图4 双分子荧光互补检测 TaCRK2 与TaTCTP 的相互作用Fig. 4 Bimolecular fluorescence complementary detection of TaCRK2 and TaTCTP interaction
3 讨论与结论
植物通过识别病原菌效应物蛋白,激发抗病防卫反应,导致寄主细胞发生超敏反应(Hypersensitive reaction, HR),从而使病原菌的生长受到抑制[21]。已经证明Ca2+作为信号分子参与调控小麦-叶锈菌互作中HR 的发生[19,22]。然而,Ca2+如何调控HR 尚不清楚。本课题组前期借助转录组分析发现一个受Ca2+调控的基因TaCRK2,以Ca2+依赖的方式调控小麦对叶锈菌的抗性[9]。CRK 是RLKs 的亚家族成员,在植物抗病性和细胞死亡中起重要作用。在拟南芥中AtCRK4、AtCRK6 和AtCRK36 的过表达导致对对丁香假单胞菌的抗性增强,并且增强了早期和晚期PTI 反应的激活[23]。AtCRK13 过表达也会诱导细胞死亡[5]。但目前人们对CRKs 参与生物胁迫和非生物胁迫的作用机制却知之甚少。AtCRK36 的过表达植株表现出高敏感性细胞死亡,与BIK1 相互作用,介导ROS 产生,增强气孔防御[24]。AtCRK28 在拟南芥中过表达增强了对丁香假单孢菌的抗性,在烟草中瞬时表达AtCRK28 可以诱导细胞死亡,AtCRK28 能够和BAK1-FLS2 复合体启动寄主的防卫反应,诱导细胞死亡[5]。在本试验中通过DUALmembrane 系统酵母双杂交和BiFC 试验证明了TaCRK2 与TaTCTP 之间存在相互作用。
TaCRK2 定位在内质网膜上,TaTCTP 定位于细胞质和细胞核。通过DUALmembrane 系统酵母双杂交验证TaCRK2 与TaTCTP 存在相互作用后,进一步使用BiFC 试验在活细胞的生理环境中原位显示蛋白质的相互作用,结果显示TaCRK2 与TaTCTP的相互作用可能发生在内质网膜上,说明TaTCTP可能在TaCRK2 调控小麦抵抗叶锈菌侵染诱导HR的信号转导网络中起作用,参与胞质内信号的传递,但二者的上下游关系仍有待进一步探讨。下一步的工作将通过免疫共沉淀技术进一步证明二者在体内存在互作。前期研究表明TaCRK2 的激酶结构域缺少了催化核心域(VIb 和VII)[9],那么TaCRK2与TaTCTP 相互作用的本质,互作位点的特征将是研究的重点。已知TaTCTP 和TaSnRK1 存在相互作用[25],因此推测TaTCTP 可能作为磷酸化靶标,在TaTCTP 和TaCRK2 之间进行信号传递,但TaCRK2是否与TaSnRK1 发生相互作用仍需要试验验证,这些问题的澄清将有助于完善TaCRK2 参与小麦抵抗叶锈菌侵染诱导HR 的信号转导机制。在以后研究中将利用VIGS 和RNAi 技术沉默TaCRK2、TaTCTP 或将二者同时沉默,观察基因沉默对叶锈菌发育及HR 的影响,对其上下游关系进行探究;通过位点突变进一步研究TaCRK2 与TaTCTP 相互作用的实质。这为阐明TaCRK2 调控叶锈菌侵染小麦后诱发HR 的分子机制奠定了重要基础, 亦对全面地阐释TaCRK2 在植物免疫过程中的作用机制具有重要的理论意义和实践意义。
